异红藻糖苷对HT1080肿瘤细胞侵袭转移作用的影响
2020-10-27杨胜涛陈佳丽萧振邦洪鹏志周春霞
杨胜涛,陈佳丽,刘 怡,萧振邦,洪鹏志,3,周春霞,3
异红藻糖苷对HT1080肿瘤细胞侵袭转移作用的影响
杨胜涛1,陈佳丽1,刘 怡2,萧振邦2,洪鹏志1,3,周春霞1,3
(1. 广东海洋大学食品科技学院//广东省水产品加工与安全重点实验室//广东省海洋食品工程技术研究中心,广东 湛江 524088;2. 广东海洋大学化学与环境学院,广东 湛江 524088;3. 南方海洋科学与工程广东省实验室(湛江),广东 湛江 5240225)
【】分析异红藻糖苷(-Isofloridoside,DIF)对HT1080肿瘤细胞侵袭转移作用的影响。用MTT法检测细胞存活率,细胞划痕实验检测细胞迁移能力,明胶酶谱实验检测细胞中基质金属蛋白酶-2(MMP-2)和基质金属蛋白酶-9(MMP-9)的活性,Western blot法检测低氧诱导因子-1α(HIF-1α)蛋白的表达情况,ELISA法检测血管内皮生长因子(VEGF)的释放量,分子对接预测DIF与MMP-2、MMP-9和HIF-1α蛋白的相互作用。MTT和划痕实验表明DIF对HT1080细胞无明显毒性作用(> 0.05),且能极显著降低肿瘤细胞的体外迁移能力(< 0.01);与对照组相比,随着实验组DIF浓度增加,MMP-2和MMP-9的活性以及HIF-1α和VEGF蛋白的表达极显著减少(< 0.01)。分子对接预测结果表明,DIF与MMP-2、MMP-9和HIF-1α均能形成稳定的氢键,具有相互作用的可能性。DIF可明显抑制HT1080肿瘤细胞的MMP-2、MMP-9、HIF-1α和VEGF蛋白的表达,表现出很好的抑制肿瘤细胞迁移的活性。
异红藻糖苷;HT1080细胞;基质金属蛋白酶;低氧诱导因子-1α;抗肿瘤
恶性肿瘤是严重威胁人类健康和生命,引起人类死亡的主要疾病之一[1]。2018年,恶性肿瘤死亡人数占我国城市和农村主要疾病总死亡人数的25.98%和22.96%[2]。肿瘤患者的高死亡率主要由于肿瘤细胞有无限增殖和侵袭转移能力[3],故抑制肿瘤的转移是降低患者死亡的关键环节[4]。另外,血管新生被认为是肿瘤侵袭性的标志[5],因此,血管新生被认为是引起肿瘤细胞侵袭转移的关键控制节点[6]。如何通过建立有效的控制肿瘤细胞转移和血管新生技术,是目前抑制肿瘤侵袭转移的主要手段。在肿瘤细胞侵袭转移过程中,基质金属蛋白酶-2(MMP-2)和基质金属蛋白酶-9(MMP-9)是通过水解肿瘤周围基质引起肿瘤转移的关键蛋白,具有促进肿瘤侵袭转移的能力[7]。在肿瘤内部的低氧环境中,低氧诱导因子-1α(HIF-1α)会被激活,从而促进血管内皮生长因子(VEGF)的分泌[8],进一步刺激血管内皮细胞生长,最终导致血管新生[9]。因此,有效控制MMP-2和MMP-9以及HIF-1α的活性,可以在细胞水平上抑制肿瘤细胞的侵袭转移能力。
我国海藻资源丰富,但从中获得有效药用化合物尚未被完全开发。人们从不同海藻中分离得到具有活性的萜烯类[10]、生物碱类[11]、蛋白质类[12]、多糖类[13]、酚类化合物[14]、卤代化合物[15]等,其中海藻多糖具有抑制MMP-2和MMP-9以及HIF-1α的活性作用[16-18]。但由于海藻多糖结构复杂、支链多、连接方式多样,难以获得高纯度的制品。有学者认为多糖的生物活性可归因于多糖的前体物质[19]。目前,异红藻糖苷(-Isofloridoside,DIF),作为来源于红藻()[20]的一种低相对分子质量的糖苷[21],是海藻多糖的前体化合物之一。异红藻糖苷是由吡喃半乳糖基和丙三醇构成,在红藻细胞中主要起抗渗透压作用[22],具有抗氧化[23]、抗炎[24]、促成骨分化[25]、神经保护[26]等活性。陈余等[21]发现DIF可以有效抑制人胎肝L-02细胞的氧化损伤,Ryu等[25]发现红藻糖苷具有促进小鼠骨髓间充质细胞成骨分化的作用,翦秋丽等[27]发现红藻糖苷可以抑制酪氨酸酶的活性,从而抑制黑色素的形成。本课题组前期研究[23]发现DIF具有抑制酒精性肝病的作用,而酒精性肝病最终会导致具有侵袭转移能力的肝癌,但DIF在抑制肿瘤侵袭转移和血管新生研究方面报道不多。
本研究旨在探究DIF是否具有潜在抑制肿瘤侵袭转移的活性作用,通过相关生化等检测分析,探讨其在肿瘤细胞侵袭转移过程中的抑制效果,为DIF应用于抑制肿瘤转移抑制剂的开发提供依据,也为红藻来源的药物开发提供新的思路。
1 材料与方法
1.1 材料
1.1.1 实验试剂与细胞株 异红藻糖苷(-Isofloridoside,DIF)由韩国济州国立大学海洋科学学院提供,纯度≥98%,保存温度≤-20 ℃。人纤维肉瘤细胞HT1080购于广州赛库生物技术有限公司。佛波醇12-十四酸酯13-乙酸酯(佛波酯,PMA)和氯化钴(CoCl2)购于上海西格玛奥德里奇贸易有限公司。一抗兔源HIF-1α、二抗山羊抗兔IgG购于美国Cell Signaling Technology 公司。VEGF ELISA试剂盒购于深圳欣博盛生物科技有限公司。
1.1.2 仪器和设备 酶标仪,Bioteck仪器公司;凝胶成像系统和小型垂直电泳系统,Bio-Rad公司;全自动化学发光成像分析系统,上海天能科技有限公司。
1.2 方法
1.2.1 细胞培养 HT1080细胞培养在体积分数为1%双抗和10% FBS的DMEM培养基,于CO2气体体积分数为5%,温度37 ℃的环境中。
1.2.2 样品毒性检测 HT1080细胞在96孔板(1×105cell/mL,100 µL)中培养24 h。随后向新鲜的无血清培养基中加入不同体积的DIF,使其在总体积为100 µL,溶液中的样品浓度为10、20、50、100 µmol/L,培养24 h。移去培养基,并向每个孔中加入100 µL MTT(0.50 mg/mL),然后放入37 ℃培养箱中孵育4 h。移去MTT,并加入100 µL DMSO充分溶解甲瓒晶体。使酶标仪测定(540 nm)。
1.2.3 模拟细胞迁移实验 HT1080细胞在24孔板(1×105cell/ mL,500 µL)中培养24 h。用灭菌的200 µL枪头在细胞上划痕,用PBS冲洗掉细胞碎片。随后向新鲜的无血清培养基中加入不同体积的DIF,使其在总体积为500 µL,溶液中的样品浓度为10、20、50、100 µmol/L,然后分别在0、12、24 h观察细胞向划痕处迁移的情况并拍照记录。
1.2.4 明胶酶谱分析 如1.2.3处理细胞,培养2 h后,加入PMA(浓度为10 µg/L)刺激。60 h后,取细胞培养液用BCA法定量上清液的蛋白浓度。调节蛋白含量使其相等,并利用加入体积分数为1.50%明胶的SDS-PAGE分离蛋白。将分离后的胶放入洗脱液(2.50% TritonX-100,50 mmol/L Tris,5 mmol/L CaCl2)中除去SDS,使蛋白质复性。然后加入孵育液(50 mmol/L Tris,200 mmol/L NaCl, 5 mmol/L CaCl2,0.02% Brij-35)置于37 ℃培养箱中孵育。60 h后,将胶放入体积分数为0.10%考马斯亮蓝溶液中,染色2 h,最后用体积分数为10%醋酸和40%乙醇的脱色液进行脱色,直到观测到蓝色背景上出现透明条带,并拍照记录。
1.2.5 蛋白免疫印迹分析 HT1080细胞在6孔板(5×106cell/ mL,1 mL)中培养24 h。吸弃旧培养基。再向新鲜的无血清培养基中加入不同体积的DIF,使其在总体积为1 mL,溶液中的样品浓度为20、50、100 µmol/L。培养2 h后,加入CoCl2(浓度为100 µmol/L)刺激。24 h后,吸弃旧培养基,用灭菌的4 ℃预冷的PBS洗涤,并加入100 μL含有10 mmol/L PMSF的RIPA裂解缓冲液,在冰上裂解0.5 h。用BCA蛋白定量试剂盒测定蛋白含量,并通过SDS-PAGE和转移膜处理,将目标蛋白转移到硝酸纤维素(NC)膜上。然后用质量分数5%脱脂牛奶封闭2 h、一抗4 ℃孵育12 h、二抗孵育2 h,最后利用显色观察并拍照记录。
1.2.6 酶联免疫分析 如1.2.4处理细胞,培养2 h后,加入CoCl2(浓度为100 µmol/L)刺激。24 h后,提取培养基,根据酶联免疫试剂盒说明书制作VEGF标准曲线。并选取合适稀释倍数的上清稀释液进行实验,检测不同浓度样品处理细胞后,VEGF释放到培养基中分泌量。根据测量数据制作标准曲线,并根据标准曲线计算VEGF的分泌量。
1.2.7 分子对接 采用Autodock vina软件进行半柔性对接[28],先用Chemdraw和Chem3D软件构建了配体(DIF)的3D结构,并确定其能量最小的构象;利用Autodock Tools软件确定配体可旋转键。从PDB数据库中下载MMP-2 (PDB ID: 3AYU)、MMP-9 (PDB ID: 5TH6)和HIF-1α (PDB ID: 1H2N)的X-ray的晶体三维结构;用Autodock Tools软件对受体蛋白的3D结构进行加氢,并确定蛋白的结合中心位置和范围得到相应的参数文件。采用Autodock vina软件进行分子对接,得到的结果用软件进行结果分析。
1.3 统计学分析
采用Image J、Graphpad Prism 5.0、Pymol和SPSS statistics 25软件进行数据处理分析及制图。所有实验结果以平均值 ± SD表示,显著性差异使用单因素方差分析(one-way ANOVA)和-test分析。
2 结果与分析
2.1 DIF对HT080细胞的毒性作用
图1中,与不加DIF的空白组相比,加入DIF(10 ~ 100 µmol/L)的实验组的细胞存活率无明显变化(> 0.05)。说明DIF(10 ~ 100 µmol/L)对HT1080细胞无毒性作用,可选择该浓度下的DIF做后续实验。

不同小写字母表示差异显著(P < 0.05)
2.2 DIF对HT1080细胞迁移的作用
通过细胞划痕实验检测DIF对HT1080细胞迁移的作用(图2),经过12 h和24 h处理后,与不加DIF的空白组相比,加入10 µmol/L DIF的实验组的细胞,迁移能力无明显变化(> 0.05);加入20 ~ 100 µmol/L DIF的实验组的细胞,随着浓度的增加,迁移能力极显著下降(< 0.01)。这说明DIF具有降低HT1080肿瘤细胞的迁移能力的作用。

2.3 DIF对MMP-2和MMP-9活性的作用
通过明胶酶谱实验检测MMP-2和MMP-9的酶活性(图3),与未加DIF和PMA诱导剂的空白组相比,加入PMA的对照组的MMP-2和MMP-9的酶活性有极显著增加(< 0.01)。与对照组相比,加入10 µmol/L DIF的实验组的MMP-2的酶活性无明显变化(> 0.05),加入20 ~ 100 µmol/L DIF的细胞的MMP-2的酶活性极显著下降(< 0.01);而加入10 ~ 100 µmol/L DIF的细胞的MMP-9的酶活性极显著下降(< 0.01),且呈浓度依赖性。这说明DIF具有抑制HT1080肿瘤细胞分泌的MMP-2和MMP-9酶活性的作用,且呈浓度依赖性。
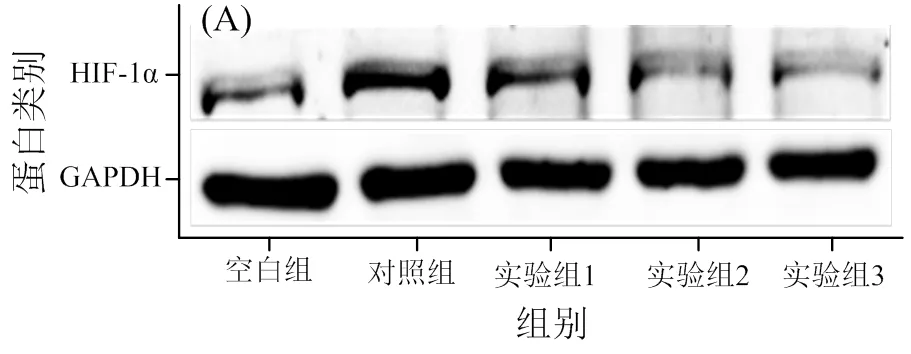
2.4 DIF对HIF-1α表达的作用
通过蛋白免疫印迹实验测定DIF对HIF-1α表达的作用(图4),与不加DIF和CoCl2诱导剂的空白组相比,加入CoCl2的对照组的HIF-1α蛋白表达量有极显著增加(< 0.01)。与对照组相比,加入50 ~ 100 µmol/L DIF的HIF-1α蛋白的表达量极显著减少(< 0.01)。这说明DIF有抑制HT1080肿瘤细胞HIF-1α蛋白表达的作用,且呈浓度依赖性。
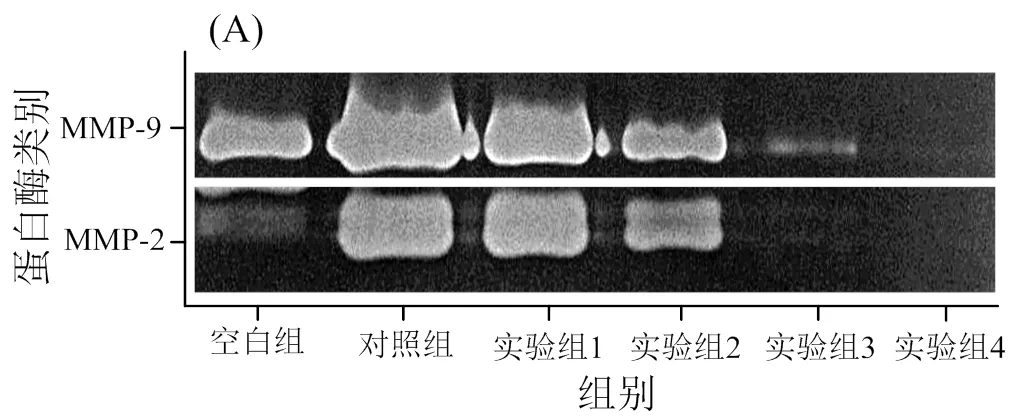
空白组,不加入PMA与DIF;对照组,加入10 µg/L PMA;实验组1,加入10 µg/L PMA与10 µmol/L DIF;实验组2,加入10 µg/L PMA与20 µmol/L DIF;实验组3,加入10 µg/L PMA与50 µmol/L DIF;实验组4,加入10 µg/L PMA与100 µmol/L DIF;不同小写字母表示差异显著(< 0.05);不同大写字母表示差异极显著(< 0.01)
图3 DIF对MMP-2和MMP-9活性的作用
Fig. 3 The effect of DIF on MMP-2 and MMP-9 activity
2.5 DIF对VEGF分泌量的作用
通过酶联免疫实验测定DIF对VEGF分泌量的影响(图5),与不加DIF和CoCl2诱导剂的空白组相比,加入CoCl2的对照组的VEGF分泌量有显著增加(< 0.05)。与对照组相比,加入20 ~ 100 µmol/L DIF细胞的VEGF分泌量极显著下降(< 0.01)。这说明DIF具有减少HT1080肿瘤细胞VEGF分泌量的作用。

空白组,不加入PMA与DIF;对照组,加入10 µg/L PMA;实验组1,加入10 µg/L PMA与10 µmol/L DIF;实验组2,加入10 µg/L PMA与20 µmol/L DIF;实验组3,加入10 µg/L PMA与50 µmol/L DIF;实验组4,加入10 µg/L PMA与100 µmol/L DIF;不同小写字母表示差异显著(P < 0.05);不同大写字母表示差异极显著(P < 0.01)
2.6 DIF与MMP-2、MMP-9和HIF-1α的分子相互作用预测
利用分子对接检测DIF与MMP-2、MMP-9和HIF-1α蛋白之间的相互作用。通过Autodock vina软件得到DIF与MMP-2、MMP-9和HIF-1α蛋白的可能结合位点,取结合能最小值的构象作为最佳构象结果。如图6所示,DIF与MMP-2的对接结合能为-26.79 kJ/mol,与Ala83、Leu82和His130形成3个氢键,键长分别为3.60 × 10-10m、3.80 × 10-10m和5.30 × 10-10m。如图7所示,DIF与MMP-9的对接结合能为-28.88 kJ/mol,与Pro421、Met422、Arg424和Pro415形成4个氢键,键长分别为5.20 × 10-10m、5.40 × 10-10m、4.40 × 10-10m和5.50×10-10m。如图8所示,DIF与HIF-1α的对接结合能为-27.21 kJ/mol,与Phe100、Ser118、Gln147、His199和Asp201形成7个氢键,键长分别为4.00 × 10-10m、4.60 × 10-10m、5.20 × 10-10m、5.20 × 10-10m、5.50 × 10-10m、5.10 × 10-10m和4.80 × 10-10m。

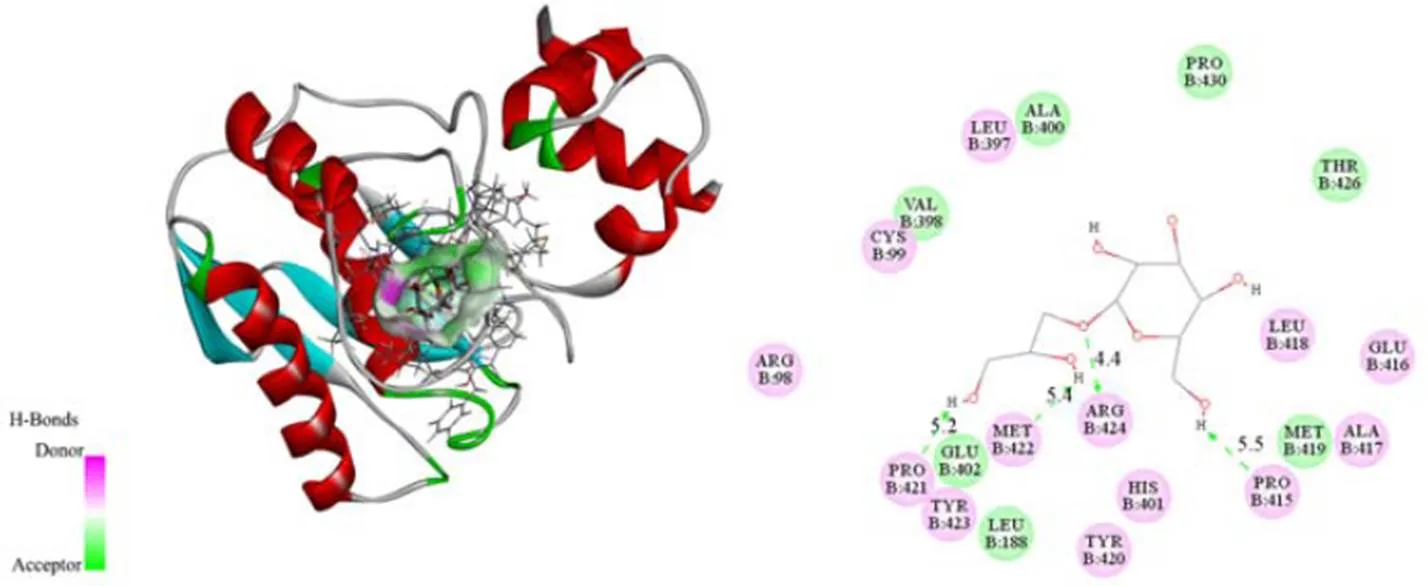
图7 DIF与MMP-9的分子对接三维图和二维图
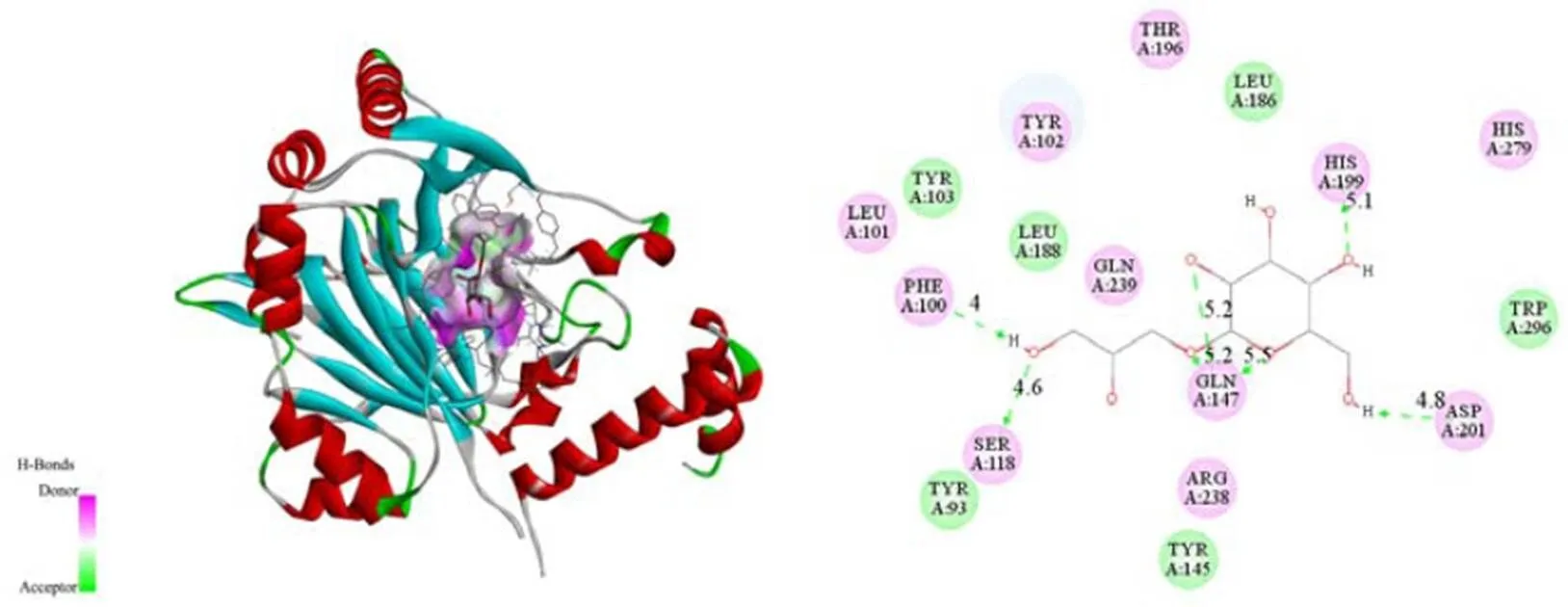
图8 DIF与HIF-1α的分子结合位点预测三维图和二维图
3 讨论
红藻糖苷在红藻中存在的种类以及含量受生长环境、地域以及红藻种类的影响[29]。红藻糖苷与异红藻糖苷的结构均由吡喃半乳糖基和丙三醇构成,但主要区别是二者连接位置不同。本研究发现,从红藻()中提取的异红藻糖苷具有明显抑制MMP-2、MMP-9和HIF-1α活性的作用。MTT和划痕实验结果,证实DIF在对细胞无明显毒性作用的浓度下,具有极显著降低HT1080肿瘤细胞迁移能力的活力(< 0.01)。MMP-2和MMP-9作为肿瘤细胞迁移的关键水解酶,可促进肿瘤细胞向周围基质转移的作用[30]。MMP-2和MMP-9的活性与肿瘤细胞的侵袭转移能力呈正相关,而DIF可以极显著抑制MMP-2和MMP-9的表达(< 0.01),从而控制肿瘤细胞对周围基质的水解作用,使肿瘤细胞侵袭转移能力下降。HIF-1α具有促进肿瘤细胞产生VEGF,从而导致肿瘤周围血管新生的作用[31]。通过对HIF-1α和VEGF蛋白表达的检测发现,DIF可以极显著降低HIF-1α和VEGF蛋白的表达(< 0.01),具有进一步降低肿瘤细胞的侵袭转移能力。通过预测DIF与MMP-2、MMP-9和HIF-1α分子间的结合位点。本研究发现,DIF与MMP-2、MMP-9和HIF-1α均能形成稳定的氢键,这可能是DIF抑制相关蛋白表达的内在原因。
4 结论
DIF可有效控制MMP-2、MMP-9、HIF-1α和VEGF的表达,抑制HT080肿瘤细胞的侵袭转移能力。大分子结构预测分析,间接证实DIF与MMP-2、MMP-9和HIF-1α具有结合位点。因此,DIF具有成为肿瘤预防功能性食品或治疗药物的潜力。
[1] XU J, DU Y, LIU W J, et al. Intensive fibrosarcoma-binding capability of the reconstituted analog and its antitumor activity[J]. Drug Delivery, 2018, 25(1): 102-111.
[2] 国家统计局. 2018年我国城市和农村居民主要疾病死因构成统计表[DB/OL]. 2020 [2020-05-15]. http://data.stats.gov.cn/easyquery.htm?cn=C01.
[3] 肖青雯, 陆金健, 陈修平. 靶向上皮间质转化: 中药抗肿瘤转移和器官纤维化新策略[J]. 医药导报, 2018, 37(4): 401-409.
[4] 陈平圣. 肿瘤侵袭转移机制及其防治对策[J]. 现代医药卫生, 2004, 20(8): 595-596.
[5] 伊日贵, 徐晓艳, 李时荣. 肿瘤侵袭转移机制研究进展[J]. 中华实用诊断与治疗杂志, 2014, 28(10): 937-939.
[6] KIM A, IM M, GU M J, et al. Ethanol extract ofexhibits anti-cancer activity in human cancer cells by suppression of metastatic and angiogenic potential[J]. Scientific Reports, 2016, 6: 36277.
[7] BAE M J, KARADENIZ F, OH J H, et al. MMP-inhibitory effects of flavonoid glycosides from edible medicinal halophyte[J]. Evidence-Based Complementary and Alternative Medicine, 2017, 2017: 6750274.
[8] KIM A, MA J Y. Rhaponticin decreases the metastatic and angiogenic abilities of cancer cells via suppression of the HIF‑1α pathway[J]. International Journal of Oncology, 2018, 53(3): 1160-1170.
[9] FARZANEH BEHELGARDI M, ZAHRI S, MASHAYEKHI F, et al. A peptide mimicking the binding sites of VEGF-A and VEGF-B inhibits VEGFR-1/-2 driven angiogenesis, tumor growth and metastasis[J]. Scientific Reports, 2018, 8(1): 17924.
[10] GAYSINSKI M, ORTALO-MAGNÉ A, THOMAS O P, et al. Extraction, purification, and NMR analysis of terpenes from brown algae[J]. Natural Products from Marine Algae, 2015, 1308: 207-223.
[11] LUCENA A M M, SOUZA C R M, JALES J T, et al. The bisindole alkaloid caulerpin, from seaweeds of the genus, attenuated colon damage in murine colitis model[J]. Marine Drugs, 2018, 16(9): 318.
[12] PIMENTEL F B, ALVES R C, HARNEDY P A, et al. Macroalgal-derived protein hydrolysates and bioactive peptides: enzymatic release and potential health enhancing properties[J]. Trends in Food Science and Technology, 2019, 93: 106-124.
[13] ZHANG R, ZHANG X X, TANG Y X, et al. Composition, isolation, purification and biological activities ofpolysaccharides: a review[J]. Carbohydrate Polymers, 2020, 228: 115381.
[14] SANTOS S A O, FÉLIX R, PAIS A C S, et al. The quest for phenolic compounds from macroalgae: a review of extraction and identification methodologies[J]. Biomolecules, 2019, 9(12): 847.
[15] SHILLING A, VON SALM J L, SANCHEZ A, et al. Anverenes B–E, new polyhalogenated monoterpenes from the Antarctic red alga[J]. Marine Drugs, 2019, 17(4): 230.
[16] ABU R, JIANG Z D, UENO M, et al. Anti-metastatic effects of the sulfated polysaccharide ascophyllan isolated fromon B16 melanoma[J]. Biochemical and Biophysical Research Communications, 2015, 458(4): 727-732.
[17] HLAWATY H, SUFFEE N, SUTTON A, et al. Low molecular weight fucoidan prevents intimal hyperplasia in rat injured thoracic aorta through the modulation of matrix metalloproteinase-2 expression[J]. Biochemical Pharmacology, 2011, 81(2): 233-243.
[18] CHEN M C, HSU W L, HWANG P A, et al. Low molecular weight fucoidan inhibits tumor angiogenesis through down regulation of HIF-1/VEGF signaling under hypoxia[J]. Marine Drugs, 2015, 13(7): 4436-4451.
[19] LEBBAR S, FANUEL M, LE GALL S, et al. Agar extraction by-products fromas a source of glycerol-galactosides[J]. Molecules, 2018, 23(12): 3364.
[20] LI Y X, LI Y, LEE S H, et al. Inhibitors of oxidation and matrix metalloproteinases, floridoside, and D-isofloridoside from marine red alga[J]. Journal of Agricultural and Food Chemistry, 2010, 58(1): 578-586.
[21] 陈余, 蒋丽刚, 李九零, 等. 红藻糖苷对人胎肝L-02细胞抗氧化作用的研究[J]. 营养学报, 2016, 38(6): 607-609.
[22] OCHSENKÜHN M A, RÖTHIG T, D’ANGELO C, et al. The role of floridoside in osmoadaptation of coral-associated algal endosymbionts to high-salinity conditions[J]. Science Advances, 2017, 3(8): e1602047.
[23] YANG S T, CHEN M F, RYU B, et al. The protective effect of the polysaccharide precursor, D-isofloridoside, fromon alcohol-induced hepatotoxicity in HepG2 cells[J]. Molecules, 2020, 25(5): 1024.
[24] KIM M, LI Y X, DEWAPRIYA P, et al. Floridoside suppresses pro-inflammatory responses by blocking MAPK signaling in activated microglia[J]. BMB Reports, 2013, 46(8): 398-403.
[25] RYU B, LI Y X, KANG K, et al. Floridoside fromundulata promotes osteogenic differentiation in murine bone marrow mesenchymal cells[J]. Journal of Functional Foods, 2015, 19(19): 505-511.
[26] BARBOSA M, VALENTÃO P, ANDRADE P B. Bioactive compounds from macroalgae in the new millennium: implications for neurodegenerative diseases[J]. Marine Drugs, 2014, 12(9): 4934-4972.
[27] 翦秋丽, 蒋丽刚, 严江燕, 等. 红藻糖苷抑制黑色素形成的作用研究[J]. 生物学杂志, 2017, 34(5): 39-42.
[28] SEELIGER D, GROOT B L. Ligand docking and binding site analysis with PyMOL and Autodock/Vina[J]. Journal of Computer-Aided Molecular Design, 2010, 24(5): 417-422.
[29] 崔晓山, 陈娟娟, 杨锐, 等. 红藻中红藻糖苷的研究进展[J]. 海洋科学, 2018, 42(4): 162-169.
[30] 张陈. 从海洋藻类中分离抑制肿瘤细胞侵袭和MMP-2和-9的表达的化合物[D]. 长春: 吉林大学, 2012.
[31] MABJEESH N J, AMIR S. Hypoxia-inducible factor (HIF) in human tumorigenesis[J]. Histology and Histopathology, 2007, 22(5): 559-572.
Effects of-Isofloridoside on Invasion and Metastasis of HT1080 Tumor Cells
YANG Sheng-tao1, CHEN Jia-li1, LIU Yi2, XIAO Zhen-bang2, HONG Peng-zhi1,3, ZHOU Chun-xia1,3
(1.,////,524088,; 2.,,524088,; 3.(),524025,)
To analyze the effect of-Isofloridoside (DIF) on the invasion and metastasis effect of HT1080 tumor cells.MTT method was used to evaluate cell survival. Cell scratch test was used to detect cell migration ability. Gelatin zymography test was used to detect the activity of matrix metalloproteinases-2 (MMP-2) and matrix metalloproteinases-9 (MMP-9). Western blot was used to detect hypoxia-inducible factor-1α (HIF-1α) expression. ELISA was used to detect the release of vascular endothelial growth factor (VEGF). The interaction between DIF with MMP-2, MMP-9 and HIF-1α proteins was predicted by molecular docking.The MTT and scratch test have confirmed that DIF has no significant toxic effect on HT1080 cells (> 0.05). It can significantly reduce the ability of tumor cells to migrate in vitro (< 0.01). Compared with the control group, increase DIF concentration caused a significant reduction of MMP-2 and MMP-9 activities and the expression of HIF-1α and VEGF proteins was significantly reduced (< 0.01). The simulation results of molecular docking indicate that DIF can form stable hydrogen bonds with MMP-2, MMP-9 and HIF-1α, and has the possibility of interaction.DIF significantly inhibit the expression of MMP-2, MMP-9, HIF-1α and VEGF protein in HT1080 tumor cells, and show good activity in inhibiting tumor cell migration. These results can provide a theoretical basis for further study of DIF as a potential antitumor active substance.
-isofloridoside; HT1080 cells; matrix metalloproteinases; HIF-1α; antitumor
Q291; R738.7
A
1673-9159(2020)06-0116-07
10.3969/j.issn.1673-9159.2020.06.015
杨胜涛,陈佳丽,刘怡,等. 异红藻糖苷对HT1080肿瘤细胞侵袭转移作用的影响[J]. 广东海洋大学学报,2020,40(6):116-122.
2020-03-11
南方海洋科学与工程广东省实验室(湛江)资助项目(ZJW-2019-07);湛江市海洋经济创新发展示范市建设项目(湛海创2017C8B1)
杨胜涛(1996-),男,硕士研究生,研究方向为水产品高值化加工与利用。Email: 15766385620@163.com
周春霞(1979-),女,副教授,博士,研究方向为水产品加工与贮藏。Email: chunxia.zhou@163.com
