碘量法测定铜含量的应用研究
2020-10-27白晓贺荣莎莎
白晓贺 荣莎莎
(江西铜业集团公司贵溪冶炼厂中心化验室,江西 贵溪 335400)
一、引言
铜是与人类生产、生活非常密切的有色金属,是一种存在于自然界中常见的金属,也是人类最早发现和使用的金属之一,密度8.92克/立方厘米,紫红色,熔点1083.4±0.2℃,具有导电性、延展性和导热性的特点。由于其具有化学性质稳定,机械性不易被损坏,可多次回收的优点,铜被广泛应用于各种领域。
二、铜的检测方法
铜含量的检测方法有多种方式,如电解法、原子吸收光谱法、比色法、可见分光光度法和碘量法等。
1.电解法:
众所周知,国标法(5121.1-85)中恒电流电解重量法测定纯铜及铜合金中铜含量是目前唯一经典的实验方法,该法的优点是准确度高、干扰少,但分析过程太长,不能满足日常铜的快速分析。
2.原子吸收光谱法(AAS法):
该法其有检出限低、选择性好、准确度高和分析速度快等优点,但由于原子吸收光谱仪价格较为昂贵,其适用于样品中微量及痕量组分分析,并主要应用于食品中(奶粉、饮料)中微量及痕量铜元素的测定,局限性大。
3.比色法:
该方法具有分析方法简单、操作简便和流程短等优点,但分析过程中容易引入主观因素带来的系统误差,使分析结果不稳定,精密度差。
4.可见分光光度法:
该方法应用广泛,灵敏度很高,准确度高,选择性好,分析成本低,操作方便。本方法大多用于酞箐颜料或毛发中微量铜的分析,且结果较准确。
5.碘量法:
该方法具有精密度高、准确度高、操作便捷、流程短和适用范围很广,适合一般铜精矿和粗杂铜中铜的常量分析,且分析过程中的干扰因素容易控制,所以一般常量分析选择碘量法测铜,仪器分析误差太大。
三、利用碘量法测定铜含量的化学原理
碘量法是利用I2的氧化性和I-的还原性为基础的一种氧化还原方法。
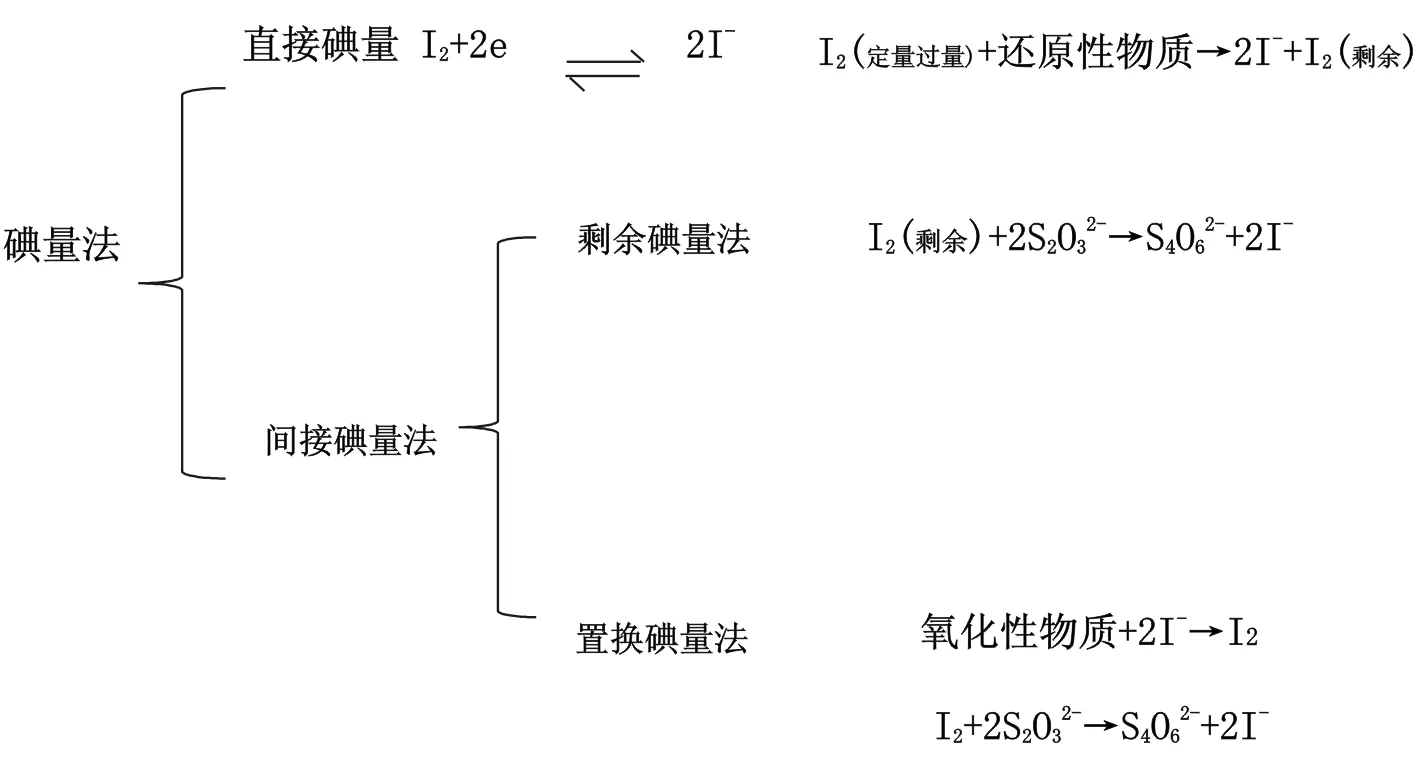
四、碘量法在测铜含量应用中的具体情况分析
(一)碘量法在铜精矿中铜含量测定中的应用
铜精矿中铜的含量一般在13%~50%范围内,根据《GB 3884.1-2012》铜精矿中铜的化学分析方法分为长碘量法和短碘量法。
长碘量法:试料经HCL、HNO3和H2SO4分解,在Na2S2O3溶液中加入硫代硫酸钠溶液使铜离子以CuS状态从溶液中分离。沉淀用混合酸溶解,调节溶液的pH值为3.0-4.0,用NH4HF2掩蔽铁,加入KI与Cu2+作用,析出的碘以淀粉为指示剂,用Na2S2O3标准溶液滴定。分离铜后的滤液采用原子吸收光谱法ASS测定铜量。该法分析流程长,对环境、仪器等因素的控制较严格。
短碘量法:试料经HCL、HNO3分解后,用乙酸-乙酸铵缓冲溶液调节溶液的pH值为3.0~4.0,用NH4HF2掩蔽铁,加入KI与Cu2+作用,析出碘以淀粉为指示剂,用Na2S2O3标准滴定溶液滴定。该方法分析流程短,分析结果准确度相对较高,应用非常广泛。
(二)碘量法在测定粗杂铜中铜的含量分析
粗铜、杂铜中铜的含量一般在5%~99.7%范围内,根据国标《YS/T521.1-2009》,按筛分后的质量比合称3.0000g试样,准确到0.0001g,将试样置于500mL锥形烧杯中,缓慢加入50mL硝酸(1+2),低温加热分解试样(如有很难溶解物,需加少量盐酸),并驱尽氮氧化物(如有较多硫,加入2mL溴),取下,冷却至室温。用漏斗将溶液移入500mL(粗铜)或200mL(杂铜)容量瓶(容量瓶经重量法核准)中,用蒸馏水少量多次清洗烧杯与漏斗,并将洗液注入容量瓶中,用水定容到刻度线,静置、摇匀。移取50mL(粗铜)或20mL(杂铜)试液于500mL锥形烧杯中,加入20mL饱和溴水,将锥形烧杯置于电热板上低温蒸至溶液体积剩余约为1mL,取下,稍冷,用水吹洗杯壁,至30mL混匀。流水冷却至室温,用氨水吹洗杯壁,混匀,加入10mL碘化钾,后用50mL酸式滴定管,以Na2S2O3标准溶液滴定滴至溶液呈淡黄色,加入5mL淀粉指示剂,继续滴定至淡蓝色。加入5mLKSCN溶液,剧烈摇动,待碘释出后。继续滴定,直到淡蓝色彻底消失,此时恰好为滴定终点。
五、关于碘量法分析过程中如何控制和消除干扰因素的探讨
(一)溶液的pH值需控制在3.0~4.0之间
分析过程中用乙酸-乙酸铵缓冲溶液控制溶液的酸度,当酸度过低时,Cu2+易水解,导致反应不彻底,结果会低于标准值,且反应速度较慢,使终点会滞后。当酸度过高时,则I-被空气中的氧氧化为I2(Cu2+催化此反应),导致结果偏高,并且滴定过程中Na2S2O3容易发生分解。
(二)酸性介质的选择
碘量法测定铜含量分析过程中,Cl-能与Cu2+配合,导致碘离子不易从的铜(Ⅱ)氯配合物中将Cu(Ⅱ)定量的还原,因此最好用硫酸而不是盐酸来控制酸度。
(三)淀粉指示剂的配制及使用
淀粉指示剂最好在使用前配制,不宜久存,若在淀粉指示剂中加入少量碘化汞或氯化锌、甘油、甲酰胺等防腐剂,可延长贮存时间。配制时将淀粉混悬液煮至半透明,且加热时间不宜过长,并应迅速冷却至室温。
(四)硫氰酸钾溶液的使用
KSCN可将CuI转变成CusCN,因CuSCN溶解度比CuI小得多,(Ksp中的Cu I=1.1×10-10,Ksp,CuscN=1.1×10-14)能使被吸附的I2从沉淀表面置换出来。使CuI+SCN-=CuSCN+I-反应终点特别明显,从而使测定结果的准确度大大提高,而且此反应过程中产生的I-离子能继续与Cu2+作用。节省了KI的用量,从而降低了分析的成本。但是滴定过程中加入硫氰酸钾后,溶液会等一会才会变色,它要和碘化钾反应了才会看见淀粉变蓝这个变化。所以加入硫氰酸钾后,要剧烈摇晃烧杯,使反应更加充分。
(五)碘量法则同过程中的误差来源
首先保证设备(天平、电炉等)运行稳定,人员严格执行标准化操作,试剂、标液未被污染,样品均匀和有代表性等一系列基本前提下,不能忽略的是碘量法,该方法本身也存在两个主要误差来源:第一:I2的易挥发性;第二:I-易被氧化性。所以我们在分析过程中,加入过量的KI,在室温下反应,使用碘瓶滴定时,不能剧烈晃动碘瓶,析出I2后,应立即滴定,速度要快。
(六)样品中含干扰元素及如何消除
1、如果试样中含有铅(Pb),那么分析过程中在加入KSCN后,需滴定到黄色稍浅一点,然后再加入湿粉指示剂,否则淀粉加进去后蓝色出现,已过终点。或者分析过程中加入硫酸钠使铅以硫酸铅沉淀形式存在,消除铅对铜含量测定的干扰,使终点颜色更加清楚;
2、试样中会有锡(Sn),则用1:1盐酸和30%H202溶解样品,使其氧化挥发,消除干扰;
3、试样中含有砷(As),应预先将砷离子氧化为砷(v),调节溶液的pH为3.5~5时滴定,则可消除干扰。
4、试样中含有锑(Sb),应预先将锑氧化为锑(v),调节溶液的pH为3.5~5时滴定,则可消除干扰。
5、试样中碳(C)、铬(Cr)、镁(Mg)杂质含量高时,需加入高氯酸、硫酸冒烟消除杂质元素;
6、试样中Si含量较高时,溶样过程中样品易粘结,需加入氟化氢铵或氢氟酸处理;
(七)如何对硫代硫酸钠标准溶液进行控制
1、标定过程纯铜片的处理:将铜标放入微沸的冰醋酸(1+4)中煮1分钟,取出后用水和无水乙醇各冲洗两次至三次,在预先设置的温度(100℃)的烘箱中烘大约5分钟,冷却,置于磨口瓶中备用。
2、硫代硫酸钠标准溶液标定结果极差不大于0.0005%。
3、Na2S2O3·5H20固体容易风化,里含杂质,含量较高,溶液性质不够稳定,且水中的二氧化碳、细菌,空气中的氧气、光、热、杂质的催化都会影响溶液的稳定性。所以我们在配置Na2S2O3溶液时,需用新煮沸并冷却的去离子水,除二氧化碳、氧气、杀菌,必要时加入碳酸钠起到抑菌的作用,使用棕色试剂瓶,避光存放,提前配置,充分反应,定期重新标定。
六、对碘量法测铜的含量应用的意见及设想
随着含铜物料越来越复杂,对于检测分析的难度也越来越大,要想获得复杂原料中含铜量的精准数据,要求我们对各种复杂原料的性质都要了如指掌。比如,样品中是否含有干扰元素,如果有几种干扰元素,则干扰元素含量就有多少。所以针对一些特殊样品,我们需要借助仪器分析,明确样品中的具体干扰元素及含量,以确保分析结果准确性。
