生物催化合成1-苯乙醇及其衍生物的研究进展
2020-10-27杜刚
杜 刚
(陕西国防工业职业技术学院化学工程学院,陕西 西安 710302)
手性药物具有独特的药理作用和巨大的经济价值,正在被全世界的药物学家所关注。现阶段手性药物的获得依然是个技术难题,通常认为手性中间体是合成手性药物的前提和基础。1-苯乙醇及其衍生物就是一类重要的手性中间体,如S-(-)-苯乙醇可用于合成抗抑郁药物曲舍林,R-(+)-苯乙醇则可用于合成抑制胆固醇吸收的药物[1],如2′-氯苯乙醇是L-氯丙那林的重要中间体[2]。但是由于技术上的原因,当前还无法对每一种手性醇中间体实现工业化生产。1-苯乙醇及其衍生物的合成方法主要有化学法和生物法。与化学法相比,生物法具有选择性高、反应条件温和、产物光学纯度高等优点,是国内外合成手性中间体的主要方法[3-4],可分为整细胞催化法、酶催化法等。关于1-苯乙醇及其衍生物的合成是目前国内外的研究热点。研究较多的是生物不对称还原潜手性酮,生物催化拆分外消旋混合物也受到极大的关注,手性催化剂的选择、反应体系以及反应条件的优化等都是该领域的研究重点。基于此,作者从生物催化剂的选择、整细胞催化、酶催化等三方面对1-苯乙醇及其衍生物的生物催化合成研究进展进行综述,为手性药物的合成提供帮助。
1 生物催化剂的选择
与化学催化一样,催化剂的选择对生物催化有着重大影响。生物催化剂决定着手性醇的收率及光学纯度的高低,一般通过生物方法从自然界中筛选出高效的生物催化剂。目前,可用于生物催化合成1-苯乙醇及其衍生物的生物催化剂有很多,如蓝藻、酵母、真菌、植物细胞以及酶等。刘慧等[5]利用96微孔板对300株常用菌株进行催化活性测定,发现真菌R.mucilageinosaGIM 2.157对邻-、间-、对-溴苯乙酮均具有较高的催化活性,可得到S-构型手性醇产物,收率达到99%,ee值也达到99%。Perna等[6]从不同菌株中筛选到L.reuteriDSM 20016,此菌株可整细胞催化苯乙酮合成(R)-1-苯乙醇,在较短时间内即可完成转化,ee值高达99%。何军邀等[7]从土壤中分离得到一株具有很强羰基还原能力的菌株厄斯考维菌(Oerskoviaturbata)ZJPH 1604,可不对称催化3-氯苯乙酮合成(R)-1-(3-氯苯基)乙醇,ee值超过99.9%。Mandal等[8]以苯乙酮为底物对真菌的催化活性进行测定(表1),发现生物催化剂对手性产物起着决定性的作用,不仅决定其收率,而且决定其构型。
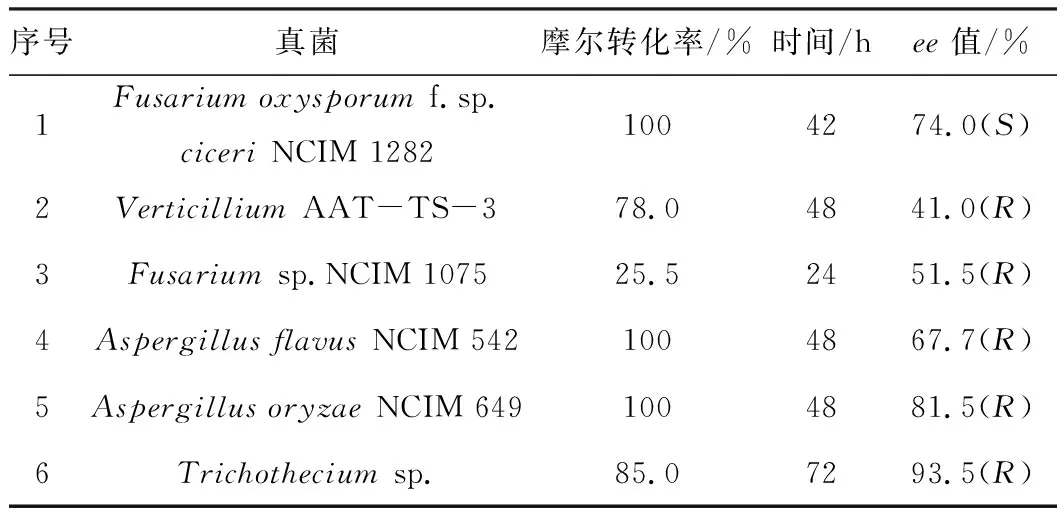
表1 用于催化还原苯乙酮的真菌催化剂的筛选
在生物催化羰基酮的过程中,产物大多遵守Prelog原则[9](图1)。当小的取代基被大的取代基取代时,或者取代基的位置不同时,产物空间构型就有可能发生转变,出现反-Prelog原则,因此通过调整底物分子取代基,可以得到不同构型的手性产物。
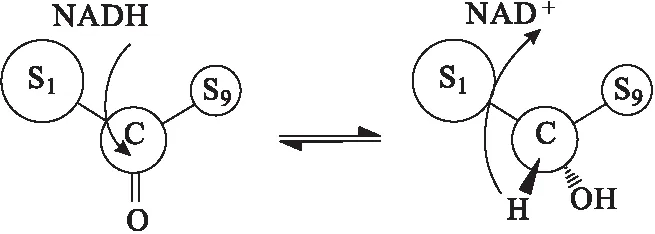
图1 Prelog原则示意图Fig.1 Schematic of Prelog rule
2 整细胞催化
整细胞催化的反应条件温和、操作简单、催化剂廉价易得,反应时无需添加辅酶,大大降低了成本。裴朝红等[10]以从土壤中筛选到的红球菌属菌株Rhodococcussp.为催化剂,将α-羟基苯乙酮不对称还原成(R)-苯乙二醇,菌体转化α-羟基苯乙酮的最优浓度为3.0 g·L-1,转化率高达96.2%,ee值为99.3%。曹纲等[11]在30 ℃条件下,通过乳酸克鲁维酵母(Kluyveromyceslactics)整细胞催化苯乙酮,24 h得到(R)-1-苯乙醇,收率为95%,ee值达到99.5%以上。
利用基因突变或重组技术,整细胞催化往往可以获得更好的效果。李鸣等[12]以羰基还原酶基因SCRⅡ-A220D和葡萄糖脱氢酶基因gdh共表达的重组菌株E.coliBL21/pET-SCRⅡ-A220D-SD-AS-gdh为生物催化剂,催化潜手性酮得到(R)-4-甲氧基-1-苯乙醇,收率达到82%,ee值为98%。
Wei等[13]利用含有羰基还原酶突变体(mut-accr)的BL21(DE3)(pETDuet-gst-mut-accr-gdh)整细胞催化2-羟基苯乙酮转化为(S)-2-苯乙二醇,该生物催化剂的催化活性是原AcCR重组细胞的15.9倍,在最佳条件下,收率为95.2%,ee值达到99%以上。除了利用菌体整细胞进行催化外,Baldassarre等[14]以胡萝卜根为催化剂,50 h得到ee值大于95%的手性醇;柴文等[15]用胡萝卜根部细胞组织生物催化6种苯乙酮衍生物的不对称还原反应(图2),均在72 h内得到S-构型手性醇,还原产物具有良好的化学纯度(60%~70%),ee值可达92%以上。
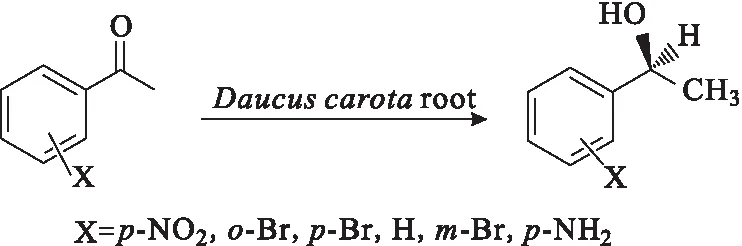
图2 苯乙酮衍生物的不对称催化还原反应Fig.2 Asymmetric catalytic reduction reaction of acetophenone derivatives
在整细胞催化过程中,底物与产物会抑制菌体细胞的生长、降低其催化活性。在水相体系中引入有机相形成两相体系是提高收率与选择性的较好策略。有机相的引入可以增加非极性底物的浓度,同时底物和产物主要存在于有机相,减少了对存在于水相中的菌体细胞的影响,提高了底物转化率和选择性。有机相的引入要考虑生物相容性,溶剂的logP越小,其对菌体细胞的毒性就越大。Cho等[16]发现,乙酸乙酯、环己酮、邻苯二甲酸二辛酯等对重组大肠杆菌细胞具有较高的生物相容性,logP在4.50左右较为合适(表2);欧志敏等[17]研究了溶剂对热带假丝酵母(Candidatropicalis)CGMC 15016细胞催化活性的影响,发现菌体细胞在logP为2~4的有机溶剂中具有中等的代谢活力,而在logP>4的有机溶剂中代谢活力能达到更高。
3 酶催化
酶催化反应效率高、条件温和、容易控制、操作稳定性好、受底物浓度影响小,满足工业化生产要求。用于酶催化反应合成手性醇的酶有水解酶和氧化还原酶。
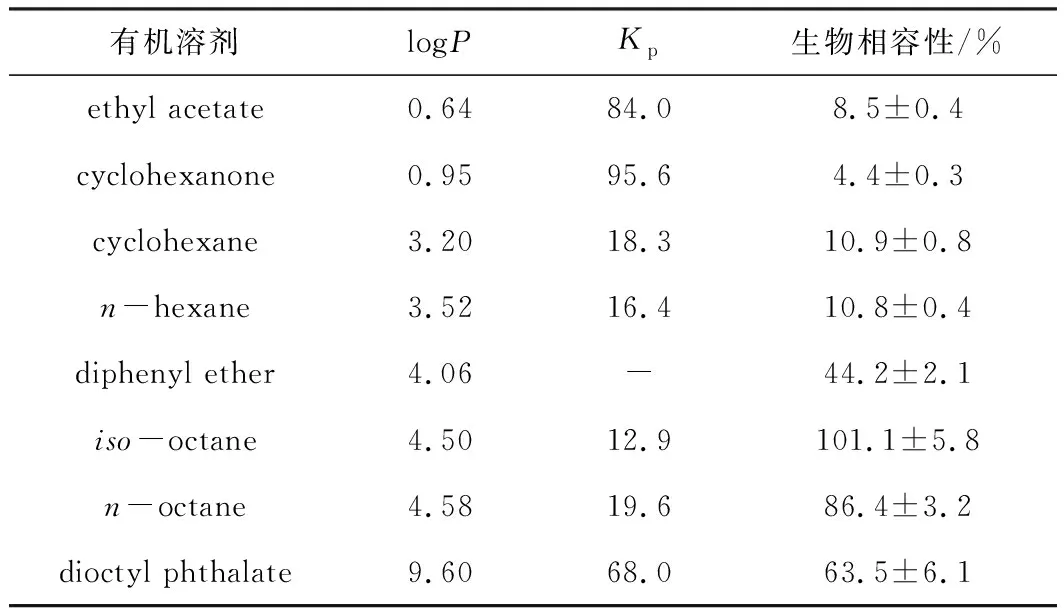
表2 苯乙酮的分配系数及有机溶剂对重组大肠杆菌细胞的生物相容性
水解酶中最常用的是酯酶、脂肪酶、裂解酶等,具有高度的选择性和专一性、不良反应少、价格低廉、在使用中无需添加辅助因子等特点,已成为研究热点。秦燕等[18]以异丙醚为反应介质、乙酸乙烯酯为酰基供体,利用脂肪酶YCJ01催化拆分对位取代1-苯乙醇衍生物,底物转化率可达49.96%,ee值达到97%以上。康丽峰等[19]在有机相中用固定化猪胰脂肪酶(PPL)催化1-苯乙醇转酯化拆分反应,在反应温度为45 ℃、反应时间为13 h的条件下,ee值可达99.3%。Yan等[4]用表面活性剂对米曲霉脂肪酶进行改性后,将其用于(RS)-1-苯乙醇与醋酸乙烯酯交换反应,转化率为46.8%,(R)-1-苯乙酸乙酯ee值大于99%。
氧化还原酶虽然在反应时需要加入辅酶,但是可以在羰基上引入活性基团,具有不可比拟的优势,被认为是最有价值的一类酶催化剂。陈敏等[20]构建了LcSDR和EsGDH双酶耦联体系,将其用于催化不对称还原苯乙酮合成(R)-苯乙醇,2 h收率达到93.8%,ee值不低于99%。杨猛等[21]以Corynebacteriumsp.的酮还原酶KRED30和Bacillussubtilis的D-葡萄糖脱氢酶GDH1构建的双酶复合交联酶聚集体为催化剂,催化还原3-氯苯乙酮,手性醇收率为100%,ee值>98%。Chen等[22]以源于Lactobacilluskefir的变异醇脱氢酶(A94T/F147L/L199H/A202L)结合葡萄糖脱氢酶(GDH)为催化剂,将2-氯-1-(2,4-二氯苯基)乙酮转化为(S)-2-氯-1-(2,4-二氯苯基)乙醇,35 ℃下反应6 h的转化率约为100%,ee值为99.5%。刘丽勤等[23]构建了重组大肠杆菌E.coliBL21-ADH和E.coliBL21-GDH,将乙醇脱氢酶与葡萄糖脱氢酶偶联不对称还原2,6-二氯-3-氟苯乙酮,得到抗癌药物克唑替尼的手性中间体(S)-1-(2,6-二氯-3-氟苯基)乙醇(图3),转化率为93.75%,ee值达到99%。
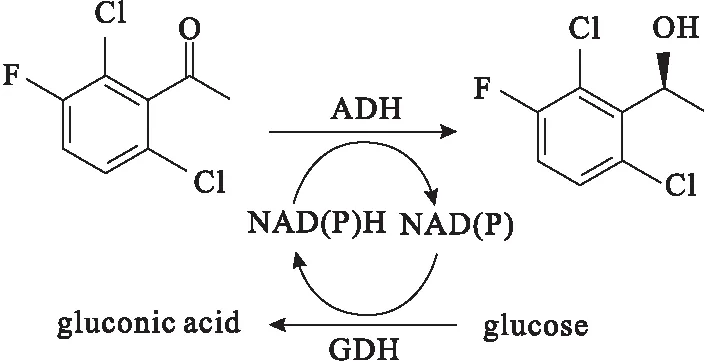
图3 酶催化合成(S)-1-(2,6-二氯-3-氟苯基)乙醇Fig.3 Enzyme catalytic synthesis of (S)-1-(2,6-dichloro-3-fluorophenyl)ethanol
4 结语
与化学法相比,生物催化合成1-苯乙醇及其衍生物具有反应条件温和、光学收率高等特点,但是也存在一些问题:在整细胞催化中,由于生物催化剂会受到细胞耐受性的影响,通常反应底物浓度较低,若底物浓度过高则产物收率可能会下降;酶催化虽然被认为是最有可能实现产业化的途径之一,但在酶的提取、保存、固定化等关键技术上还应有所突破。相信,随着生物技术的发展,生物催化合成1-苯乙醇及其衍生物会得到越来越多的重视与研究。
