专注于胸膜疾病的基础与临床研究——施焕中教授团队
2020-10-27施焕中
施焕中
(首都医科大学附属北京朝阳医院呼吸与危重症医学科 北京呼吸疾病研究所,北京 100020)
1 个人简介
现任首都医科大学附属北京朝阳医院呼吸与危重症医学科主任(图1),2019年入选“北京学者”。

图1 施焕中教授
我1989年毕业于广西医科大学医疗系并留校工作,两年后考取广西医科大学呼吸内科研究生,1994年获得硕士学位后前往日本爱媛大学医学部研修1年。1996年考上广西医科大学儿科呼吸专业博士生,读博期间赴美国哈佛大学Beth Israel Deaconess Medical Center学习2年。2000年获博士学位,毕业论文被评为2002年度全国优秀博士学位论文。2009年获得国家杰出青年科学基金资助。
2009年2月,我从广西医科大学第一附属医院调往华中科技大学同济医学院附属协和医院工作,担任呼吸与危重症医学科主任。2012年10月,调入首都医科大学附属北京朝阳医院工作,担任呼吸与危重症医学科主任。2020年7月起担任首都医科大学胸膜疾病临床诊疗和研究中心主任。
本人自1994年开始从事呼吸疾病的免疫学机制和临床研究,主要学术贡献在于:(1)系统阐述恶性胸腔积液中多种Th细胞的免疫学特征,通过将淋巴细胞生物学引入胸腔积液的研究,为今后的研究工作开辟了新领域。(2)发现一类独特的新型Th细胞亚群-Th27细胞,证实该细胞亚群通过影响胸膜间皮细胞(pleural mesothelial cell,PMC)在结核免疫过程中发挥重要调节作用。(3)提出白细胞介素27(interleukin-27,IL-27)是诊断结核性胸腔积液的可靠指标,其诊断效率优于已知的任何一种可溶性标志物。(4)系统探讨可溶性介质如γ干扰素(interferon-γ,IFN-γ)、腺苷脱氨酶及多种肿瘤标志物对于鉴别诊断良恶性胸腔积液的临床价值,为临床使用这些诊断指标提供循证医学依据。
作为通讯作者在AmJRespirCritCareMed、AmJRespirCellMolBiol、Thorax、Chest以及EurRespirJ等学术期刊发表论文80余篇。
2 主要学术贡献
1994年以来,本人一直从事呼吸病学的临床、教学和科研工作,围绕呼吸疾病的临床问题和免疫学机制提出了一系列具有创新思想的研究方案,系统开展胸膜疾病和气道炎性反应的基础和临床研究并取得系列重要的成果(图2)。
图2 施焕中教授工作照
本人第1篇关于胸膜疾病的研究论文于2005年发表在AmJRespirCritCareMed,在过去15年中,本人一直专注于胸膜疾病的基础和临床研究。这些年来取得的科研成就如下:
2.1 通过将淋巴细胞生物学引入恶性胸腔积液(malignant pleural effusion,MPE)研究,为胸腔积液发生机制的研究开辟了新的领域。系统阐述了MPE中多种TH细胞的免疫学特性,并阐明其对MPE发生发展的影响,为开发干预MPE的新策略奠定了理论基础(图3)
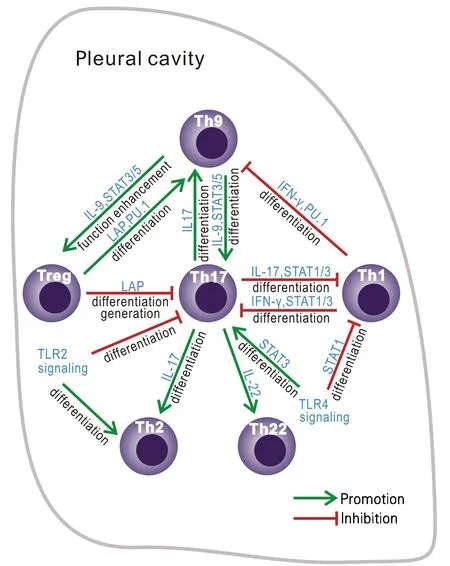
图3 恶性胸腔积液中不同Th细胞之间的相互作用
相比其他类型的胸腔积液,MPE具有更顽固而且难控制的特点,由肺癌转移所致的MPE中位生存时间只有5.5个月。了解MPE的发生机制对于开发MPE的有效干预策略具有重要意义。该项目从T细胞免疫入手深入探索MPE微环境中多种免疫细胞之间的相互调节,免疫细胞与肿瘤细胞之间的相互作用,及其对MPE发生发展的影响。
1)发现MPE中的调节性T细胞可以明显地抑制反应性T细胞的增生反应,调节性T细胞发挥免疫抑制活性有赖于CTLA-4协同刺激通路的参与。调节性T细胞因为抑制反应性T细胞从而促进肺癌细胞浸润和扩散至胸膜,因此寻求影响其抑制活性有望改变MPE患者的转归和预后[1]。
在证实IL-16能够动员CD4+T细胞浸润到胸膜腔的基础上[2],发现MPE中的T细胞、巨噬细胞和肿瘤细胞产生大量的趋化因子CCL22,后者通过与外周血调节性T细胞表面相应的CCR4受体相结合从而将其募集到胸膜腔。这些资料提示,减少局部CCL22的产生或阻断其效应,或封闭CCR4受体有望成为晚期癌症患者的治疗靶位[3]。
2)发现其他多种TH细胞包括TH17[4]、TH9[5]以及TH22细胞[6]可在MPE发生和分化,其所产生的相应的细胞因子影响肺癌细胞的增生、凋亡及迁移活性,并影响肺癌细胞与胸膜间皮细胞之间的黏附。
3)应用IFN-γ-/-和IL-17-/-小鼠的动物研究[7]显示,IFN-γ通过减弱STAT3信号通路,进而抑制TH17细胞的发生和分化;而IL-17通过减弱STAT1信号通路进而抑制TH1细胞的发生和分化。IL-17抑制胸膜微血管渗漏从而抑制MPE的形成;相反,IFN-γ促进微血管渗漏从而促进MPE的形成。这些资料证实了本项目关于体内TH17和TH1细胞之间的相互作用及其对MPE转归的影响。
4)B细胞在免疫应答中的功能研究主要集中在探讨B细胞分化为浆细胞产生抗体,介导抗原特异性体液免疫。本团队的研究结果显示,B细胞缺失小鼠的MPE中TH1细胞减少,TH17细胞增多,同时胸水量减少,生存期延长。将活化的初始B细胞回输到B细胞缺失小鼠体内,可以增加MPE中的TH1细胞,降低TH17细胞,并缩短MPE小鼠的生存期[8]。该研究成果一方面可以加深人们对肿瘤浸润性B细胞免疫学特征的认识,并有助于阐明晚期恶性肿瘤转移的机制,深入了解恶性肿瘤微环境中炎性反应对免疫应答反应的影响;另一方面也揭示MPE发生的新机制。
5)IL-10是调节性B细胞发挥抑制作用最重要的介质。本团队研究发现,IL-10缺失通过刺激TH1细胞分化及上调CXCR3-CXCL10信号通路从而动员TH1和TH17细胞浸润到胸膜腔,最终减轻MPE的发生发展,并延长小鼠的生存时间[9]。本团队最新的研究结果回答了IL-10是如何刺激TH1细胞分化的:IL-10通过调节miR-7116-5p/GPR55/ERK信号通路控制TH1细胞的分化,促进胸膜血管通透性增高、肿瘤血管生成以及肿瘤生长,进而促进MPE的形成[10]。
关于各种淋巴细胞的免疫学特征及其对MPE发生发展影响的系列研究成果,国际著名的胸膜疾病专家Georgios T.Stathopoulos教授发表专题述评予以正面推介[11],并以一副彩图高度概括本项目的主要发现,指出By introducing the new research field of lymphocyte biology in malignant pleural effusion, the work by Lin and colleagues presents the starting point for future studies and raises many questions(图4)。
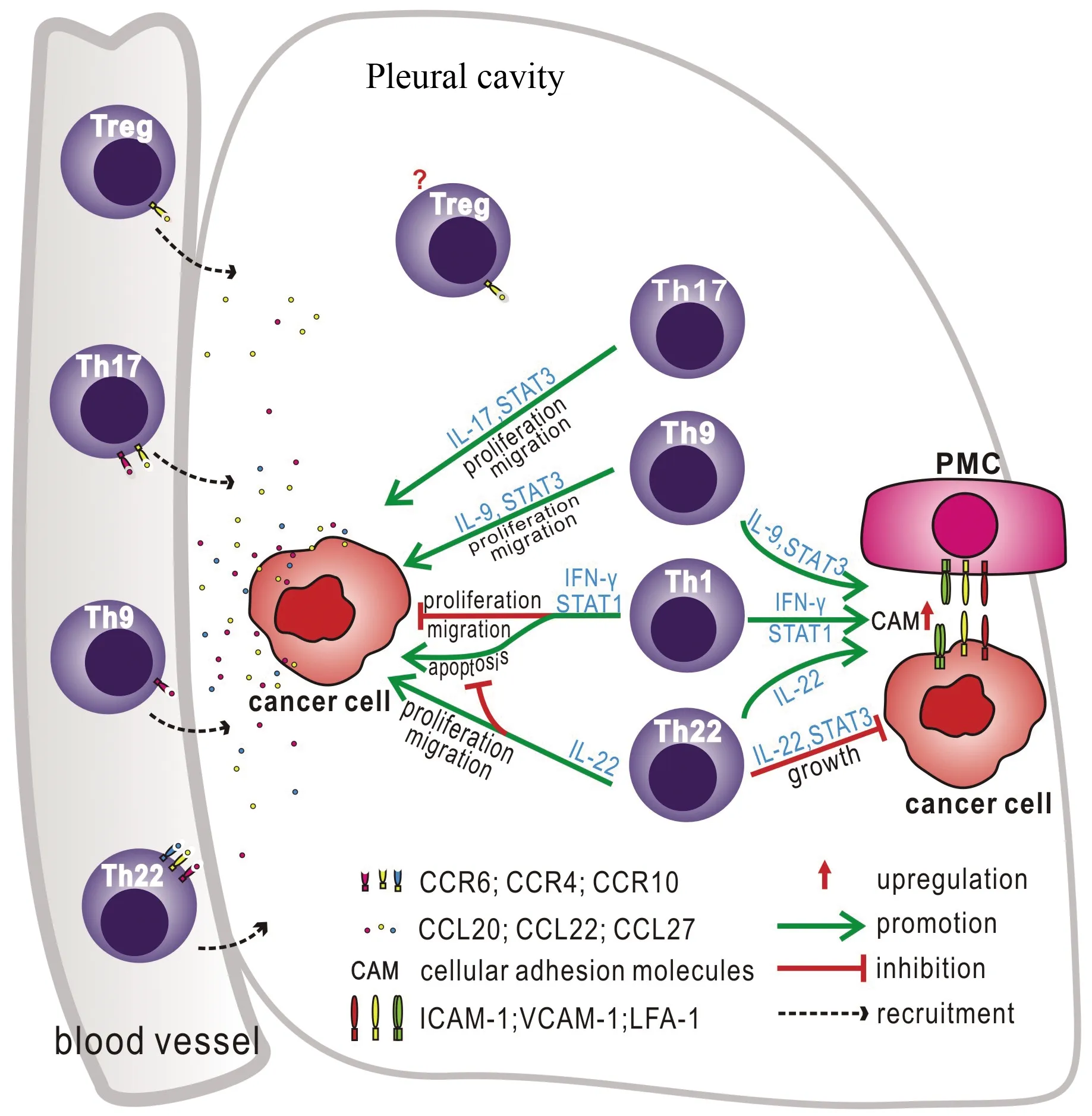
图4 恶性胸腔积液中Th细胞与肿瘤细胞之间的相互作用
2.2 发现一类独特的新型TH细胞亚群——产IL-27的CD4+T细胞,证实该细胞亚群在结核性胸腔积液(tuberculous pleural effusion,TPE)中发挥重要免疫调节作用;发现胸膜间皮细胞在体内具有呈递抗原的能力,通过呈递抗原刺激CD4+T细胞增生,促进TH细胞的发生分化。本部分工作揭示了多种TH细胞对胸膜结核感染过程的影响,加深人们对结核感染免疫及TPE发生机制的认识
我国是结核病高负担国家,结核病的防控在将来相当长的时间内仍面临严峻的挑战,而早期诊断和及时治疗对结核病的有效控制至关重要。TPE是最常见的肺外结核病之一,约占结核病总数的4%~10%。本团队通过研究TPE免疫微环境中多种TH细胞的免疫学特征,揭示了TH细胞对胸膜结核感染过程的影响,为开发新的TPE诊断方法提供了丰富的理论依据。
1)发现胸腔结核杆菌感染时产IL-27的CD4+T细胞主要合成和释放IL-27,也可产生少量的IFN-γ。TH27细胞的发生和分化所需要的核转录因子与TH2、TH17、TH9和TH22细胞完全不同,c-Fos和T-bet是其分化过程中必需的转录因子。通过激活STAT3信号通路,产IL-27的CD4+T细胞不仅可修复PMC损伤,还可以进一步逆转PMC由IFN-γ介导的上皮细胞间质转化的过程。本团队的研究结果显示,这些产IL-27的CD4+T细胞是一类独特的新型TH细胞亚群,并在结核免疫过程中通过影响PMC而具有独特的免疫学功能[12]。
在本团队首次提出产IL-27的CD4+T细胞之后,日本免疫学家Katsuyuki Yui于2016年3月在Immunity发表的最新研究中确认了产IL-27的CD4+T细胞的存在,并证实这类细胞在疟原虫感染中具有调节作用[13]。
2)发现胸膜间皮细胞在体内具有呈递抗原的能力,通过呈递抗原刺激CD4+T细胞增生,促进TH细胞的发生分化。本部分工作揭示了多种TH细胞对胸膜结核感染过程的影响,加深人们对结核感染免疫及TPE发生机制的认识[14-15]。
由于在关于TH细胞参与胸膜结核感染免疫反应的系列研究中取得良好的学术积累,国际著名的结核病专刊Tuberculosis特邀本项目组撰写专题综述Subpopulations of helper T lymphocytes in tuberculous pleurisy[16]。
2.3 系统探讨多种可溶性生物学指标对于鉴别诊断胸腔积液的临床价值,为临床提供新的诊断指标及确切的循证医学依据,成果被写入国内和欧洲关于胸腔积液诊治的指南。率先将尖端可弯曲胸腔镜(内科胸腔镜)应用于临床诊断胸腔积液,并为全国各地培训了大量的专业人才,大大提高胸腔积液鉴别诊断的效能
胸腔积液病因复杂,不同类型胸腔积液的鉴别诊断一直是临床实际工作面临的难题。通过简便易行的方式提高胸腔积液的诊断效率对于有效控制该组疾病至关重要。该项目系统探讨了多种可溶性生物学指标对于鉴别诊断胸腔积液的临床意义。
1)2012年,本团队首次报道TPE中IL-27的浓度显著高于MPE、感染性或漏出液中IL-27的浓度;特别重要的是,结果表明IL-27是诊断TPE的可靠指标[17]。因为能够为人类疾病提供一种无创性的诊断指标,此事事关重大,本团队重复了该项研究并得到了同样的结果[18]。2016年,欧洲的研究者发表了1篇专题综述,推荐将IL-27用于结核高负担和低负担国家TPE的诊断[19]。为了提供更确切的证据,本团队第3次组织了大规模的前瞻性临床研究,再次证明IL-27诊断TPE的灵敏度和特异度分别为96.1%和99.0%[20]。
2)基于自身的临床研究资料,本团队同时汇集国内外关于多种可溶性指标诊断TPE的研究成果,系统评价这些指标对于诊断TPE的临床价值[17, 20-23],为临床应用这些指标提供循证医学依据。
3)基于自身的临床研究资料,本团队同时汇集国内外关于多种可溶性指标诊断MPE的研究成果,系统评价这些指标对于诊断MPE的临床价值[24-30],为临床应用这些指标提供循证医学依据。
4)在此之前,国内外应用正电子发射计算机断层显像-电子计算机断层扫描(positron emission tomography-computed tomography,PET-CT)诊断MPE时使用的都是单个指标,诸如可以采用病灶的标准摄取值(standardized uptake value,SUV)等。单个指标虽然有一定的参考价值,但灵敏度和特异度都不高,不能满足临床的实际需要。本团队探讨联合应用多种PET-CT指标构建一个评分系统(PET/CT评分),以期提高MPE的诊断效率。结果显示,PET-CT评分诊断MPE的灵敏度为83.3%,特异度为92.2%,曲线下面积(area under curve,AUC)为0.949。结果表明,PET-CT评分为MPE患者提供了较为理想的诊断效率,明显优于任何一个单独的PET-CT参数[31]。
5)本团队自2005年6月起在国内率先将尖端可弯曲胸腔镜(内科胸腔镜)应用于诊断胸腔积液。研究[32-34]结果显示,内科胸腔镜对于各种不明原因胸腔积液的总体诊断效率为92.6%,而对于TPE的诊断效率高达99.1%。同时为全国各地培训了大量的专业人才,大大提高全国鉴别诊断胸腔积液的整体能力。
本团队在阐述胸腔积液形成的免疫学新机制的基础上开展胸腔积液鉴别诊断的临床研究,揭示了胸膜腔局部环境中多种免疫细胞和结构细胞在此之前未为人知的诸多免疫学特征,提供了多项提高胸腔积液鉴别诊断效率的新方法及循证医学依据,成果写入国内和欧洲多个胸腔积液诊治指南。研究成果直接在国内数十家大型综合医院推广应用。主持制定了我国首部《恶性胸腔积液诊断与治疗专家共识》,成为规范我国MPE诊治的行业标准,有力推动了我国MPE的规范化管理。研究成果引领了我国胸腔积液研究和临床诊治技术的发展,推动了国际相关领域的科学进步,产生了重大的社会效益。
综上所述,本团队长期坚持呼吸内科的基础和临床研究,取得了一批重要研究成果:本人作为临床一线大夫以通讯作者发表SCI收录论文80余篇,其中6篇发表在呼吸医学领域最具权威性的学术期刊AmJRespirCritCareMed。
