MR750 3.0T DWI ADC值与直肠癌患者临床病理分级及术后复发和吻合口炎性纤维化关系
2020-10-27郭达杨陈周倩周记宇敬宗林
郭达,杨陈, 周倩, 周记宇, 敬宗林
直肠癌是临床常见消化系统肿瘤,早、中期患者预后较好,5年生存率高达80%,但早、中期缺乏明显、典型临床症状,故而临床上容易被忽视,且具有较高侵袭性和转移性致一旦确诊即已进入晚期,错过最佳治疗时期,增加治疗难度[1]。研究显示晚期患者的无瘤生存时间低于38个月,接受放化疗、手术治疗等综合疗法后3年生存率低于65%,因此早期诊断、分期、治疗对于改善预后、降低死亡率至关重要[2-4]。研究发现磁共振扩散加权成像(DWI)表观扩散系数(ADC)值与乳腺癌、肝癌病理分级存在相关性,其中ADC值可作为术前评价及疗效评估影像学量化指标,在临床中具有良好应用价值,但目前对于ADC大小与病理分级相关性研究并未得到一致结论[3]。术后肿瘤复发是影响预后主要因素,尽早发现复发病灶可指导医师及时开展针对性治疗,而常用的影像学检查技术难以区分术后局部复发以及吻合口炎性纤维化[4]。MR扩散加权成像可有效反映直肠肿瘤细胞生物学行为以及诊断直肠癌患者局部复发,但对于不同ADC值与局部复发关系并未见文献探讨,因此本文将通过实例进一步探讨ADC值与直肠癌患者临床病理分级及术后复发和吻合口炎性纤维化关系。
材料与方法
1.基本资料
回顾性分析2016年1月至2018年10月经手术病理证实596例结直肠癌患者资料,均接受直肠癌根治术治疗,排除影像资料不全(306例),未及时治疗、复查(40例),图像肠道运动伪影(54例),最终共96例纳入研究,其中男60例,女36例,年龄34~70岁,平均(51.34±7.46)岁。直肠癌患者纳入标准[5]:①经病理学、影像学检测确诊为直肠癌,均行直肠癌根治术治疗;②所有患者MRI检查前均未经过手术治疗、放化疗及免疫治疗等;③病例资料完整,MRI图像清晰,依从研究方案。排除标准:①心、肾、肝等重要脏器功能障碍;②家族性结直肠腺瘤性息肉病,溃疡性直肠炎、炎性肠病如克罗恩病:③存在其他原发性恶性肿瘤,或者肿瘤转移者。所有患者及家属均签署知情同意书,本研究获得本院伦理委员会批准。
2.分组
临床病理分级分组:由两名高年资病理科医师共同参照WHO 2010版标准将直肠癌患者分为高分化、中分化、低分化级[6]。
术后吻合口局部复发组(复发组):原病灶经根治术后完全消失,治疗结束后至少6个月再行MRI复查显示术区吻合口明显增厚,有肿物灶且经肠镜病理学确诊复发。纳入96例患者中共有40例复发。
吻合口纤维化组(纤维化组)纳入标准:原病灶经根治术后完全消失,治疗结束后至少12个月经病理活检证实为纤维化,再行MRI复查显示肿物形成,但未见肿块行程及肠壁增厚[7]。纳入96例患者中共有56例纤维化。
3.检查方法
所有患者均随访2年,采用门诊复查、电话随访等形式进行,且术后每3个月需开展盆腹腔B超、胸片复查,在根治术结束后≥6个月和≥12个月分别行MRI平扫、增强及DWI检查,均采用GE Discovery MR750 3.0T超导型MR扫描仪,检查前无放化疗及其他盆腔手术史。
受试者检测前约8h服用清肠药,采用GE Discovery MR750 3.0T超导型MRI扫描仪进行检查,选取8通道相控阵线圈。首先通过冠状面确定肿瘤位置后垂直肿瘤肠管行断面T1WI扫描,设置扫描层厚为3.5 mm、层间隔为0.2 mm,TR为600 ms,TE为MinFull,通过矢状面确定肿瘤位置平行肿瘤肠管行冠状面T2WI扫描,层厚为3.5 mm、层间隔为0.3 mm,TR为4000 ms,TE为85 ms。最后行DWI扫描,轴面扫描,采用脂肪抑制以及自动匀场,扫描参数与常规轴面一致,b值为800 s/mm2。

表1 不同病理分期患者ADC值比较

表2 术后复发和纤维化患者ADC值比较
由两名经验丰富主治医师在不知病理结果情况下独立分析图像,若意见不一致则需开展科室讨论进行决定。选择感兴趣区(ROI)测量方法:采用医学影像存档与联络系统调取图像,传送至ADW4.6工作站进行处理,参照直肠指诊、肠镜检查结果以盆腔常规T1WI、T2WI、增强扫描作为参考,观察b为800 s/mm2时DWI图像上直肠肿瘤信号,尽量避开囊变坏死区、伪影以及血管,采用手动方式进行测绘,测绘范围0.4~0.5 cm2,尽可能选择病变区域不同部位实性层面并采用多次测量,多次测量结果中最小值则为最小ADC值,多次测量结果均值则为平均ADC值。
4.统计学分析
结 果
1.不同病理分期患者的ADC值(表1)
三组患者最小ADC值差异显著,其中最小ADC值随着分化程度的增加明显增加(P<0.05),高、中分化组的平均ADC值差异无统计学意义(P>0.05),但均明显高于低分化组(P<0.05)。术前低、中、高分化直肠癌MRI表现以及组织病理学图如图1~3。
2.术后复发和纤维化患者的ADC值(表2)
复发组患者平均ADC值、最小ADC值明显<纤维化组,差异有统计学意义(P<0.05)。术后复发、炎性纤维化MRI表现以及组织病理学图如图4、5。
3.ADC值与肿瘤病理分期相关性
采用Spearman法分析显示最小ADC值与肿瘤病理分期存在负相关性(rs=-0.528,P<0.05)。以0.799×10-3mm2/s为阈值,最小ADC值诊断低分化直肠癌敏感度、特异度分别为70.4%、68.0%,ROC曲线下面积为0.707(95%CI:0.596~0.817),见图6a。以0.875×10-3mm2/s为阈值,最小ADC值诊断高分化直肠癌敏感度、特异度分别为71.0%、75.4%,ROC曲线下面积为0.778(95%CI:0.672~0.884),见图6b。
ROC曲线确定术后局部复发/纤维化的最小ADC值阈值为0.814×10-3mm2/s,最小ADC值诊断术后复发的的敏感度、特异度分别为85.7%、80.0%,ROC曲线下面积为0.853(95%CI:0.771~0.935);平均ADC值阈值为0.867×10-3mm2/s,平均ADC值诊断术后复发的敏感度、特异度分别为91.1%、75.0%,ROC曲线下面积为0.795(95%CI:0.680~0.910),见图6c。最小ADC值诊断术后复发的ROC曲线下面积明显高于平均ADC值(P<0.05)。
讨 论
3.0T MRI具有良好软组织分辨率,通过获取病症部位冠状、矢状面图像而清晰显示直肠癌影像学特征,根据肿瘤组织、正常组织信号差别可有效评估肿瘤侵犯深度、肿瘤边界等[8]。肿瘤细胞生长、增殖旺盛,细胞间组织结构紧密及肿瘤组织间液压力升高,使得自由水分子扩散运动受限,故而DWI呈扩散受限高信号,ADC值存在降低趋势[9]。Woo等[10]认为直肠癌病理分级主要取决于细胞结构差异性和异型性,DWI更多是反映细胞密度增加结构异型性对水分子运动影响,细胞分化异型性可导致胞浆内核质比增加,而DWI难以反映此时大分子蛋白增多对胞内水分子运动程度影响,同时血流灌注、ROI选择、微循环等均可影响水分子运动,干扰ADC值,ADC值甚至可能不降反升。而本次研究发现平均高、中分化组平均ADC值差异无统计学意义,但均明显高于低分化组,与王铮等[11]研究相近。分析认为直肠癌术前病理分级差别主要取决于细胞异型性,术前低分级患者细胞增殖相对活跃,数目增多,异型性增大,故而肿瘤处自由水分子运动空间压缩而导致扩散受限,ADC值处于低水平。Spearman法分析显示平均ADC值与肿瘤病理分期无显著相关性,表明需慎重考虑采用平均ADC值评估肿瘤病理分期。直肠癌肠壁供血血管是由外膜或者浆膜向黏膜面走向,其中肿瘤组织黏膜层容易坏死,而黏膜层与肠腔连通,导致坏死部分可能在肠腔脱落,故而残留肿瘤实体质地均匀,平均ADC值反映是整个肿瘤扩散特性。ADC值大小与肿瘤细胞密度切关联,其中平均ADC值是最疏松区、最密集区的平均值,同时测量时可能受到坏死区、未能完全避开液化等因素干扰,导致不能反应真实增殖情况、密集程度[12],故而平均ADC值区分肿瘤细胞病理学分级存在局限性。本次研究显示不同病理分级患者(高、中、低分化)最小ADC值差异显著,其中最小ADC值随着分化程度增加明显增加(P<0.05),且通过Spearman法分析显示最小ADC值与肿瘤病理分期存在负相关性(rs=-0.528,P<0.05),表明直肠癌患者最小ADC值可用于评估术前肿瘤病理分级。DWI被广泛应用于评估直肠癌分级,但研究方法各不相同,ROI测量有包括肿瘤强化部分、非强化部分,或者包括坏死组织和不包括坏死组织如坏死组织包括在ROI之内,可导致平均ADC值,高低级别肿瘤数据出现重叠。直肠癌组织存在不均质性即肿瘤内部细胞疏密程度不一,同一病灶存在不同分化程度,错误活检部位可能导致级别低估。只有肿瘤分布最密集区域或者最高肿瘤分级部分可更准确反映肿瘤病理学分级、生物学行为,而最小ADC值正是反映肿瘤病灶细胞分布最密集、增殖最活跃区域,故而最小ADC值可准确评估术前直肠癌病理分级[13-14]。小肿瘤或者肿瘤边缘层面容易受到容积效应的影响,从而出现极端值,导致结果出现假阳性,因此在测量肿瘤ADC值时需术后吻合口纤维化是局部炎症反应长期作用结果,毛细血管内皮细胞、成纤维细胞异常增生,同时伴随局部组织水肿充血等病理变化,MRI增强扫描时手术部位吻合口呈“富血供”表现,干扰局部复发灶判断[15]。本次研究发现复发组患者平均ADC值、最小ADC值明显<纤维化组(P<0.05),表明采用ADC可进行区分。Lambregts等[16]认为吻合口炎性纤维化的局部炎性反应使得细胞水肿,细胞外的间隙扩大,导致细胞间隙自由水增加,自由水扩散运动空间增大,故而DWI信号减低,ADC值相应升高。DWI检查可在分子水平评估直肠癌根治术后吻合口局部新发肿瘤细胞增殖情况,细胞数量增多,密度增加,增殖旺盛肿瘤细胞大量合成分泌所需大分子蛋白,导致对水吸附作用增加,细胞内部水分子运动受限,故而呈现扩散受限表现。局部复发灶肿瘤细胞快速增殖,细胞结构变化(核质比例增大、胞浆内大分子物质增多)等,细胞密度增加,细胞外间隙减小,故而水分子扩散运动受限,DWI信号升高,ADC值相应降低。同时经过ROC曲线分析显示最小ADC值诊断吻合口炎性纤维化、局部病灶复发曲线下线面积显著高于平均ADC值,且最小ADC值诊断敏感度、特异度均高于80%,表明最小ADC值有较高诊断效能。DWI-MR可直观显示直肠癌根治术后局部复发病变,更好区分复发肿瘤、炎性病变如直肠壁和肠粪一般为低信号,而直肠癌复发部位因肿瘤扩散受限而表现为高信号,以及更容易发现吻合口、肠壁等部位小病变,同时准确测量病变部位ADC值,准确判断病变性质,具有较高临床价值。
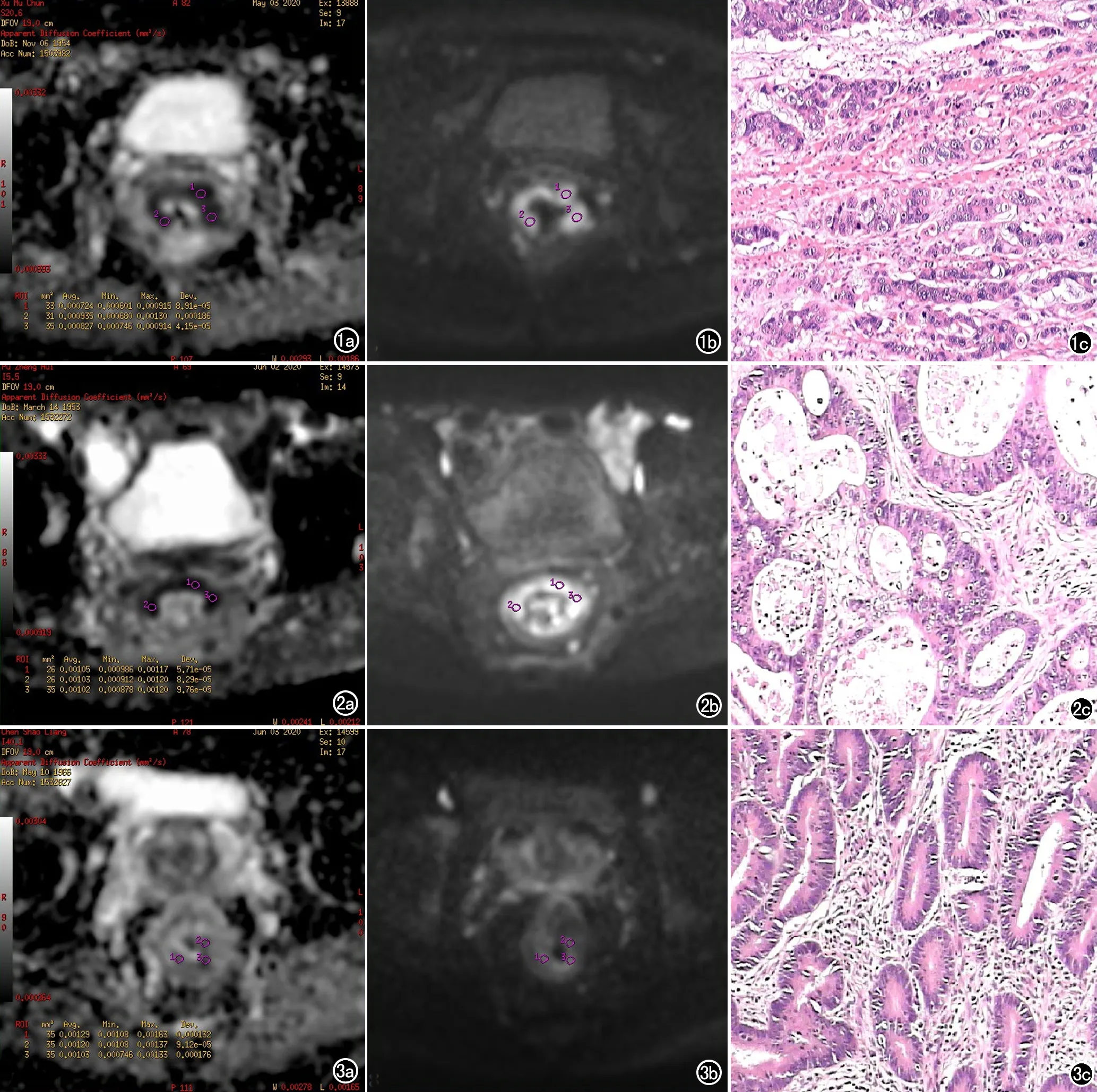
图1 低分化直肠癌。a)ADC图像呈稍低信号,平均ADC值0.820×10-3mm2/s; 最小ADC值0.712×10-3mm2/s;b) 肿瘤DWI(b=800s/mm2)图呈高信号; c) 细胞大小不一,排列松散,呈明显异型性,胞浆浓染,见核分裂相(HE×200)。 图2 中分化直肠癌。a) ADC图像呈低信号,平均ADC值0.936×10-3mm2/s; 最小ADC值0.832×10-3mm2/s;b) 肿瘤DWI(b=800s/mm2)图呈高信号; c) 见腺管形成,核浆比增高,细胞异型性增多(HE×200)。 图3 高分化直肠癌。a) ADC图像呈低信号,平均ADC值1.036×10-3mm2/s; 最小ADC值0.962×10-3mm2/s; b) 肿瘤DWI(b=800s/mm2)图呈高信号; c) 细胞排列较为规整,异型性明显减少,核分裂像不明确(HE×200)。
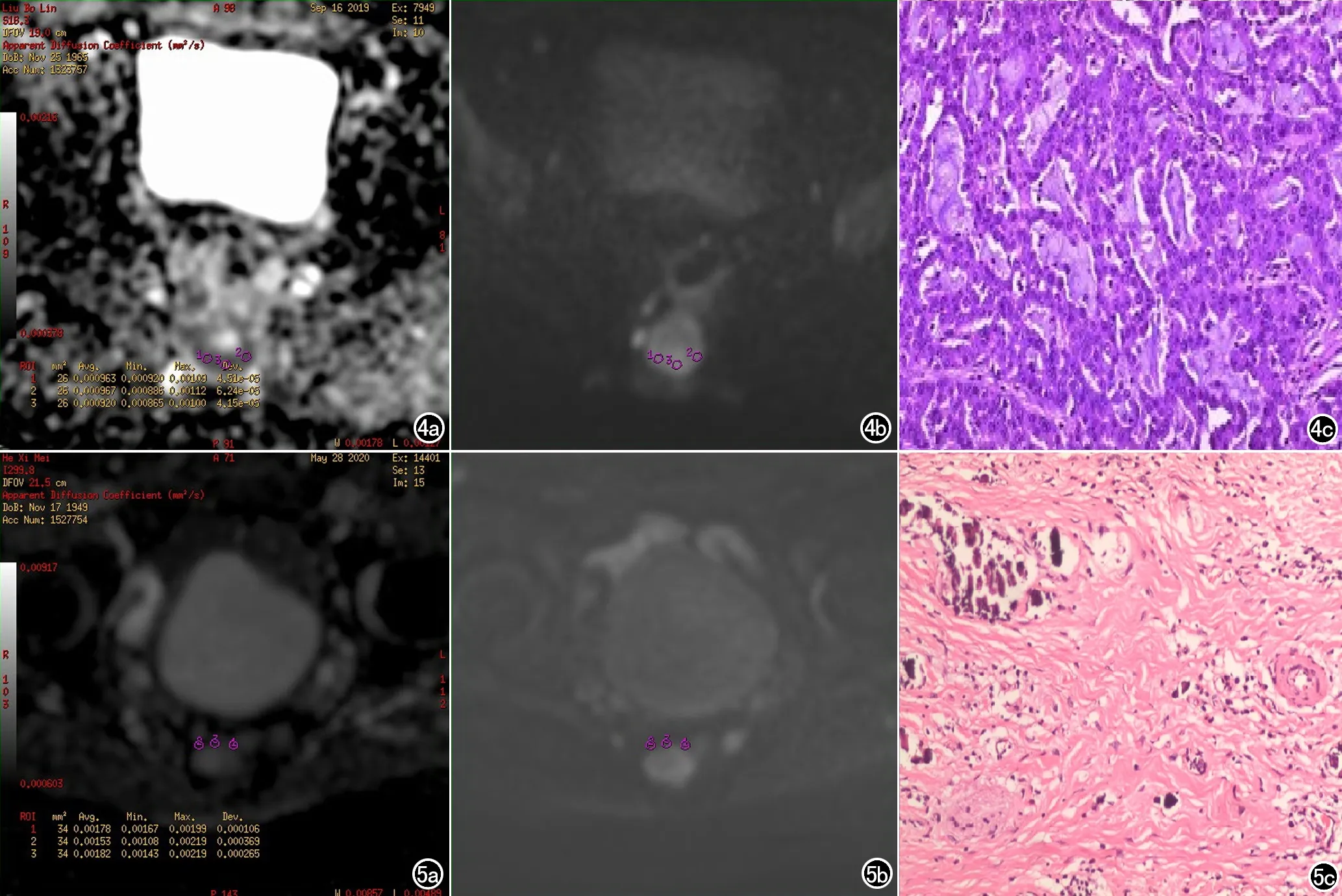
图4 术后吻合口复发。a) 吻合口管壁明显不规则增厚,ADC图像呈低信号; b) 肿瘤DWI(b=800s/mm2)图呈明显强化表现,提示肿瘤复发,平均ADC值0.821×10-3mm2/s;最小ADC值0.663×10-3mm2/s;c) 直肠溃疡型中分化管状腺癌(肿瘤大小4.5×3.0cm),癌组织浸润肠壁全层,未突破外膜,见脉管内癌栓及神经侵犯,肠系膜淋巴结见癌组织转移(HE×200)。 图5 术后炎性纤维化。a) ADC图像呈低信号; b) 肿瘤DWI(b=800s/mm2)图呈明显强化表现,提示肿瘤纤维化,平均ADC值1.022×10-3mm2/s;最小ADC值0.983×10-3mm2/s; c) 肠壁纤维化伴玻璃样变性,盆壁纤维组织活检病理提示明显纤维化(HE×200)。

图6 最小ADC值诊断低分化直肠癌的ROC曲线。 图7 最小ADC值诊断高分化直肠癌的ROC曲线。图8 ADC值诊断直肠癌术后复发/纤维化的ROC曲线。
本次研究存在一定程度局限性,首先纳入样本量相对较少,其次中低分化、中高分化肿瘤不均质性病例以低分化级别纳入研究,进行DWI 扫描时仅选择b值为800s/mm2,b值优化选择仍有欠缺,今后可选择多b值或者选择高b值DWI序列,从而缩小血流灌注对ADC值影响。
总之,直肠癌DWI肿瘤最小ADC值有助于术前预判病理分期以及术后诊断吻合口局部复发、炎性纤维化,可作为结直肠癌诊断、预后参考指标。
