判断中心原子杂化轨道类型的新方法
2020-10-26郑木炎
郑木炎

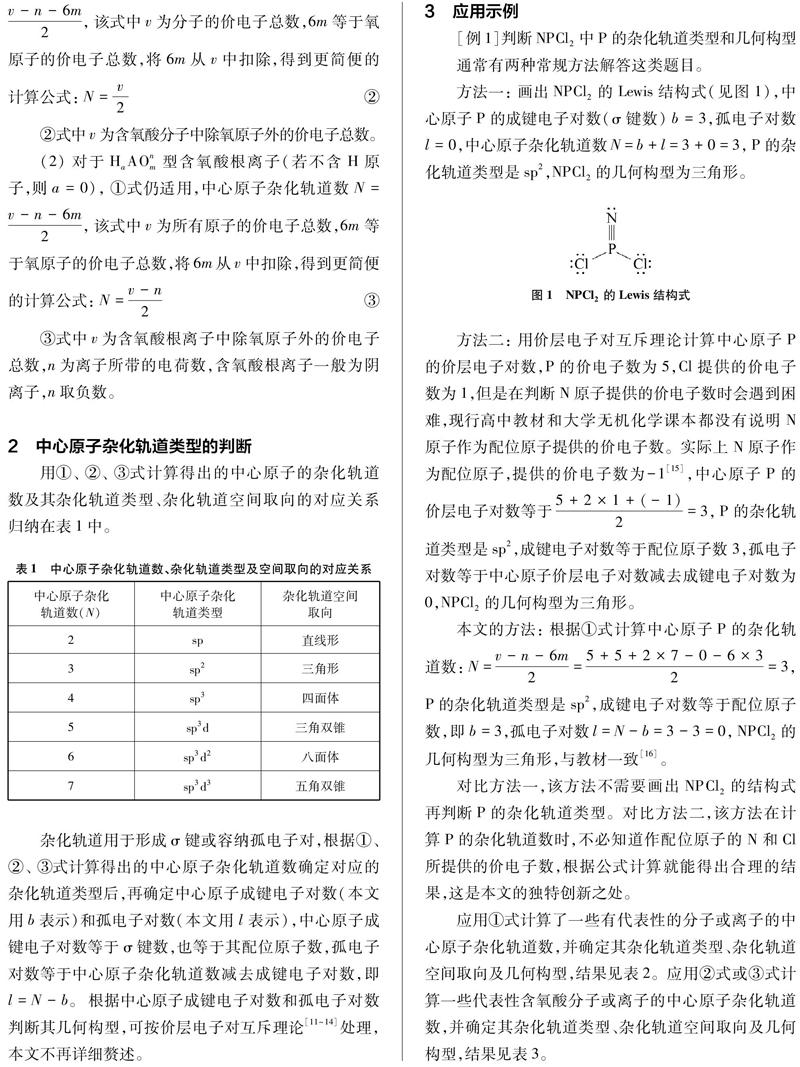
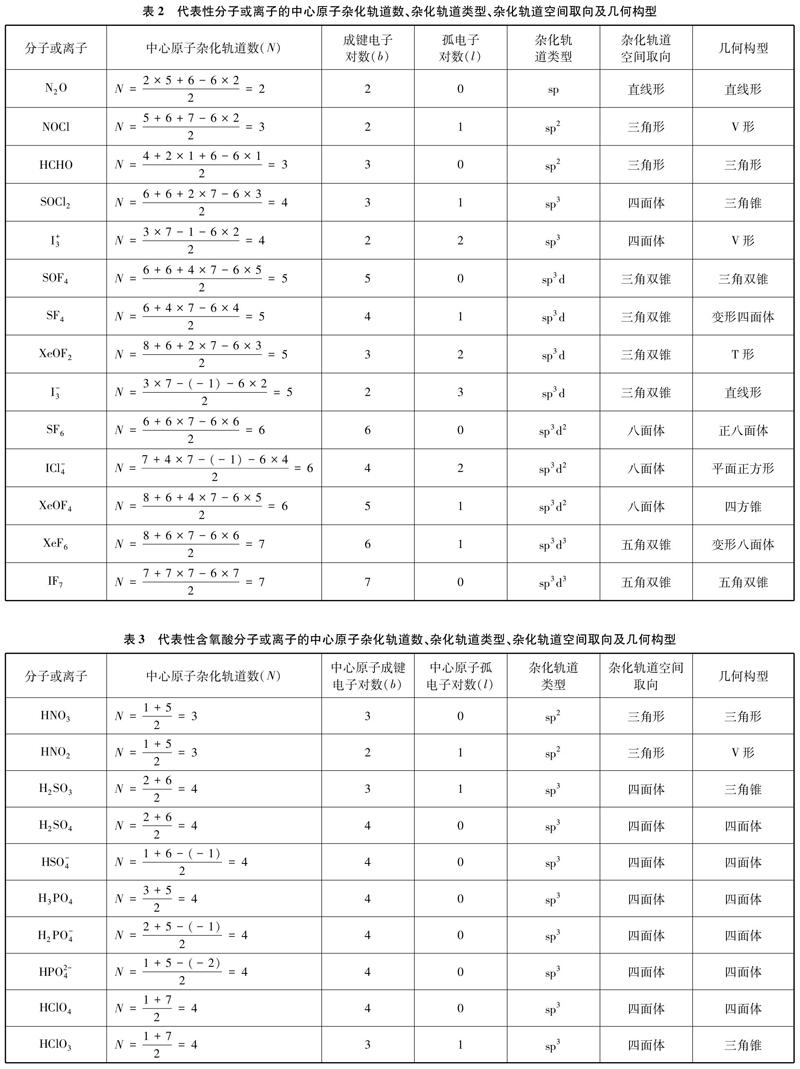
摘要:基于中学杂化轨道理论教学实际,针对学生在判断未知几何构型或价电子总数为奇数的分子、离子的中心原子杂化轨道类型时存在的困惑,总结出AXm型分子或AXnm型离子的中心原子杂化轨道数的计算公式,并作了进一步的修正,分别得出含氧酸分子和含氧酸根离子、价电子总数为奇数的分子或离子的中心原子杂化轨道数的计算公式。用该法计算一些具有代表性的分子或离子的中心原子杂化轨道数,并以此判断其杂化轨道类型和几何构型,结果与相关文献报告一致。
关键词:中心原子; 杂化轨道数; 杂化轨道类型; 教学研讨
文章编号:1005-6629(2020)09-0090-05
中图分类号:G633.8
文献标识码:B
高中化学选修3《物质结构与性质》(苏教版)中介绍了杂化轨道理论,但教材中对杂化轨道理论的介绍不够深入和全面,使该理论一直是公认的教学难点。对于如何判断给定的分子或离子的中心原子杂化轨道类型,教材里并没有系统论述,导致在判断未知几何构型的分子或离子的中心原子杂化轨道类型时比较困难,特别是对于价电子总数为奇数的分子或离子,如何计算其中心原子杂化轨道数是教学的一个难点。查阅相关大学教材[1~4],有些教材没有相关介绍,有些教材则把单电子当作一孤电子对处理,如可以解释NO2的杂化轨道类型,但在解释ClO2的杂化轨道类型时会遇到因难。笔者在教学实践中总结出中心原子杂化轨道数(本文用N表示)的计算公式,并由此确定其杂化轨道类型及几何构型。本文对中心原子杂化轨道数的计算公式及适用范围做一个简单的介绍,旨在对中学化学教学,特别是化学竞赛辅导提供参考。
5 结语
本文提出的计算中心原子杂化轨道数的方法,不需要画出结构式判断中心原子成键电子对数和孤电子对数再确定杂化轨道数,也不必规定不同族的原子作配位原子时提供的价电子数,只需要根据公式即可直接计算中心原子的杂化轨道数。但需要说明的是:一是在教学实践中,仍然需要全面介绍杂化轨道理论和价层电子对互斥理论,切不可舍本求末。当用常规方法判断中心原子杂化轨道类型和几何构型遇到困难时,不妨尝试本文提出的方法。二是本文的计算方法适用于主族元素以及主族元素与零族元素形成的单中心共价分子或离子、主族元素含氧酸分子或含氧酸根离子,而对于其他含有多个中心原子的分子或离子、含有过渡金属元素的分子或离子,还有待进一步探讨。
参考文献:
[1][5][9][11]北京师范大学, 华中师范大学, 南京师范大学编. 无机化学(第4版)[M]. 北京:高等教育出版社, 2016:71~80.
[2][6][12]周公度, 段连运. 结构化学基础(第4版)[M]. 北京:北京大学出版社, 2008:151~155.
[3][7][13]曹锡章, 宋天佑, 王杏乔. 无机化学(第3版)[M]. 北京:高等教育出版社, 2009:151~165.
[4][8][14][16]张祖德. 无机化学(第2版)[M]. 合肥:中国科学技术大学出版社, 2016:213~219.
[10][15]鄭木炎. 价层电子对互斥理论的改进——计算中心原子价层电子对数的新方法[J]. 化学教育(中英文), 2019, 40(19):93~95.
[17][18]吴集贵, 曾正志, 姚卡玲. 介绍一种判断小分子(或离子)中心原子杂化轨道类型的方法[J]. 大学化学, 1991, 6(6):9~13.
