消化系统肿瘤患者的导管相关性血栓发生率及高危因素探讨
2020-10-26高峰李红刘斌亮谢俊英孙晓莹王延风马飞
高峰,李红,刘斌亮,谢俊英,孙晓莹,王延风,马飞
(1.中共中央办公厅警卫局保健处,北京 100017;2.首都医科大学附属北京安贞医院心内科;3.中国医学科学院肿瘤医院;4.北京市朝阳区桓兴肿瘤医院)
消化系统肿瘤占据全球肿瘤发病率第二位,2018年全球新发病例约470万,占比26.1%;死亡病例约336万,占比35.2%[1]。自2010年以来,肿瘤已成为我国首位死亡原因[2]。庞大的肿瘤人群有着长期且多种多样的静脉治疗需求,建立稳定且便捷的静脉通路是十分必要的。中心静脉置管(CVCs)以其方便、舒适,可以满足化疗、长期肠外营养、抗感染、血液制品输注等多种治疗需要等优势得到了广泛的应用[3-5]。根据穿刺的部位,将中心静脉导管分为经中心静脉置入中心静脉导管(CICC)和经外周静脉置入中心静脉导管(PICC)两种[6]。两种方式各有优劣,在临床中均得到了广泛应用[7]。
CVCs在方便临床工作的同时,导管相关的多种并发症也给临床工作带来很多的困扰。最常见的并发症便是导管相关性血栓(CRT)[6]。血管彩色多普勒超声检查因其无创、安全、快捷、费用低的特点而被作为确诊CRT的首选[7]。
CRT不仅导致住院时间延长、增加额外的护理费用,严重者甚至危及生命[3]。因此,筛选和识别CRT的高危人群一直是人们关注的焦点。目前,只能依靠预测静脉血栓栓塞症(VTE)风险度的Khorana风险评分系统[8]和Caprini评分系统[9]来评估CRT的风险。本组对消化系统肿瘤患者CVCs过程中CRT的发生率以及其危险因素进行分析,为制定个体化CRT防治策略提供依据。
1 对象与方法
1.1 研究对象 选择2015年1月1日至2019年8月31日在中国医学科学院肿瘤医院收治的接受中心静脉置管的消化系统肿瘤患者。所有患者随访至2020年1月1日。本研究经中国医学科学院肿瘤医院医学伦理委员会的审核批准(No.:NCT03537339)。基于CICC和PICC两种导管的最大使用期限,本研究主要终点是CICC患者3个月内和PICC患者12个月内出现导管相关性血栓。
1.2 纳入与排除标准 纳入标准:①成人非卧床患者,同意参加本研究并提供研究所需信息;②经病理诊断为消化系统恶性肿瘤(食管癌、胃癌、十二指肠癌、肝癌、胆管癌、胰腺癌、小肠癌、结直肠癌);③CICC或PICC置管成功。排除标准:①患者基本信息不全;②病理诊断提示原发灶不明;③置管期间或拔管前无血管超声检查;④随访结束时尚未拔管。
1.3 资料采集 资料的搜集采用电子病历系统和现场记录两种方式。采集的内容包括:一般信息(年龄、性别、身高、体质量、吸烟和饮酒史);既往或合并疾病(高血压、糖尿病、冠心病、脑梗死、心律失常);肿瘤相关信息(病理诊断、病期、Karnofsky评分);基线治疗信息(抗凝治疗、抗血小板治疗);导管相关信息(置管目的、既往置管史、导管类型、置管位置、导管尖端位置、是否二次调整导管);基线检查(血常规、D-二聚体检测)。
1.4 中心静脉置管及护理 中心静脉置管由专业置管团队通过超声引导结合改良赛丁格尔技术(MST)置入。置管后进行胸部X线检查(范围包括置管侧上肢和颈部)以确定置管位置。导管尖端的位置在正常情况下应位于上腔静脉靠近右心房处,若以脊柱作为参照,则应位于胸椎段6-8(T6-8)处。
患者接受每周1~2次专业团队的导管护理,并在医生的监督下记录导管的使用信息和相关并发症,直到正常拔管或出现血栓(以先发生者为准)。
1.5 血栓诊断 拔管前或在带管期间出现任何提示CRT的临床症状均需进行血管超声多普勒和彩色成像检查(型号:美国通用公司 LOGIQTME9)。CRT的诊断是依据血管超声发现导管附近的血管出现血栓,伴血管的部分或完全闭塞,并考虑与导管相关。
1.6 统计学处理 CRT的发生率用百分比及每1 000个中心静脉导管日的CRT的发生数来描述。采用SPSS 23.0统计数据。建立非条件logistic回归模型,采用单变量和多变量logistic回归确定独立危险因素。以状况为应变量,赋值1=有/是,0=无/否。单因素分析中P<0.25的变量将纳入多因素分析[10],回归过程采用逐步后退法,以进行自变量的选择和剔除。统计检验为双向,P<0.05为差异有统计学意义。logistic回归的结果以比值比和95%可信区间表示。
2 结果
2.1 患者基线资料 2015年1月1日至2019年8月31日间,有可观察消化道恶性肿瘤病例1 235例,排除15例信息不全、12例病理诊断示肿瘤原发灶不明、660例置管期间或拔管前无血管超声检查、19例随访结束时尚未拔管,最终529例纳入研究。总置管天数达33 559 d,带管时长2~344 d(中位49 d),置管天数(66.0±50.7)d。年龄范围18~90岁,中位年龄59岁。基线资料见表1。
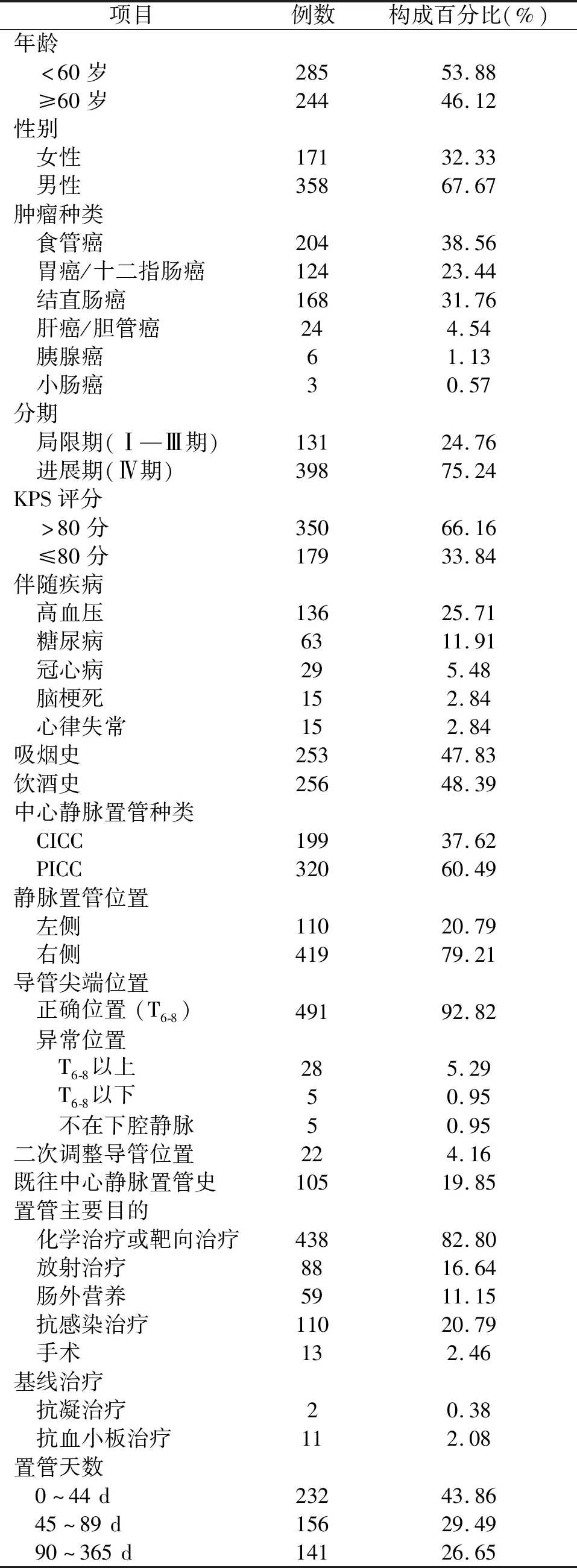
表1 529例静脉置管患者基本情况
2.2 导管相关性血栓 共发生CRT事件共114例,发生率21.6%,即3.40例/1 000置管日。其中,CICC病例CRT的发生率为12.1%(24/199),即2.30例/1 000置管日;PICC病例CRT发生率为27.3%(90/330),即3.89例/1 000置管日。PICC的CRT发生率高于CICC,差异有统计学意义(χ2=16.993,P<0.001)。此外,33例CRT为多部位受累,占CRT人群的29.0%。PICC置管的患者出现多部位血栓的概率更高,P=0.001。见表2。
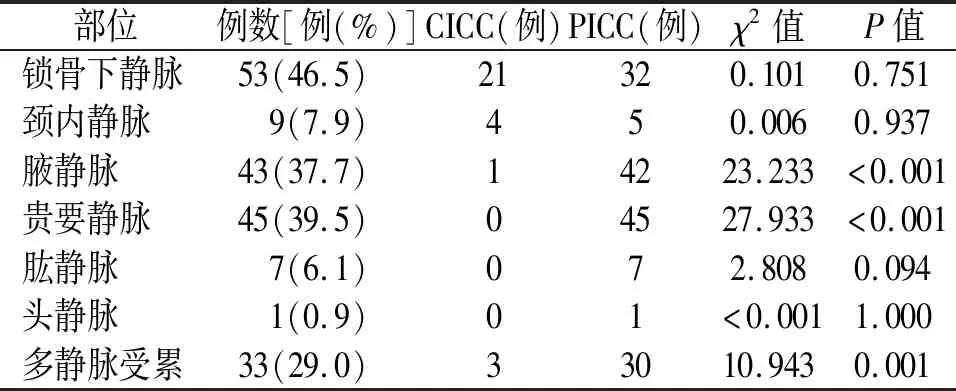
表2 114例静脉置管患者导管相关性血栓发生部位
2.3 CRT危险因素分析 单因素分析结果显示:食管癌(对比胃癌)、使用PICC置管(对比CICC)、左侧置管、既往置管史、白细胞计数(连续)、淋巴细胞计数(连续)、血红蛋白计数(连续)、置管目的为营养支持均与CRT的发生相关,P<0.05。单因素分析结果见表3。
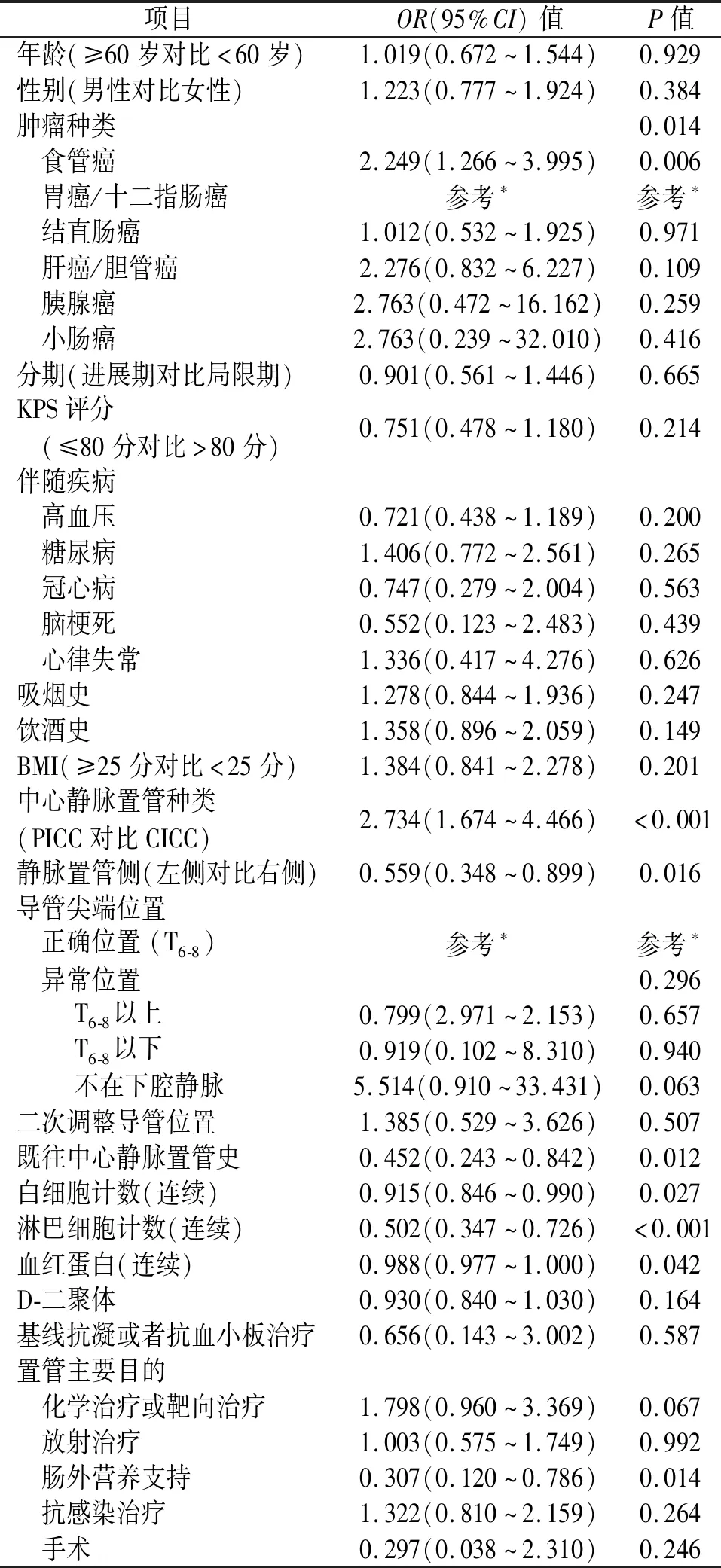
表3 CRT危险因素的单因素logistic回归分析
此外,另有KPS评分、高血压、吸烟、饮酒、BMI指数、导管尖端位置、D-二聚体计数、置管目的为化疗、置管目的为手术的P<0.25,以前述单因素分析(表3)中P<0.25的指标/因素为自变量,本研究将17个变量一并放入多因素分析,最终结果显示:食管癌(对比胃癌:OR=2.087,95%CI:1.146~3.088,P=0.016)、使用PICC置管(OR=2.379,95%CI:1.422~3.980,P=0.001)以及置管目的为化疗(OR=2.258,95%CI:1.165~4.375,P=0.016)为CRT发生的独立危险因素(表4)。
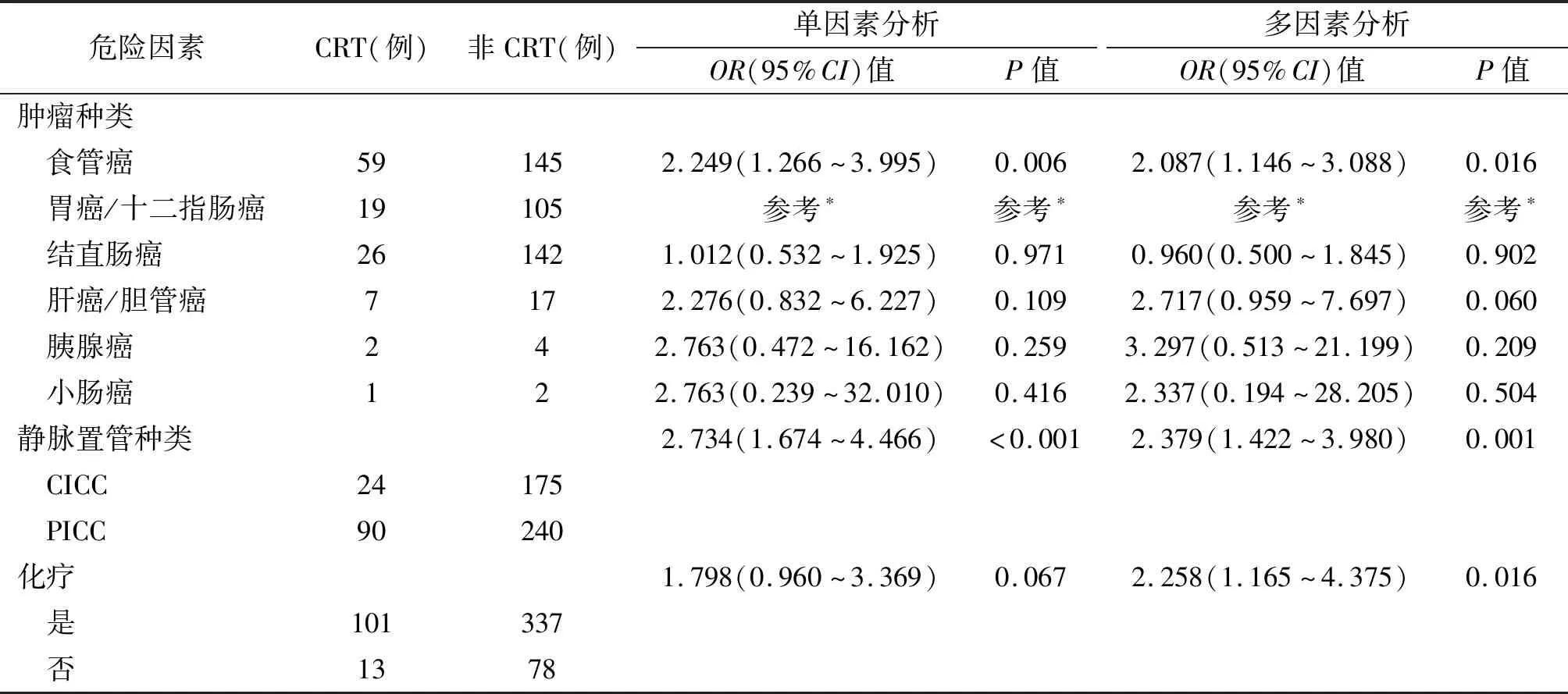
表4 CRT危险因素多因素logistic回归分析
3 讨论
肿瘤患者静脉栓塞症已经成为了仅次于肿瘤进展的第二大死因[11]。无论血栓有无症状,消化系统肿瘤患者VTE的发生都会降低总生存[12]。VTE包括深静脉血栓(DVT)、肺栓塞和CRT。2019年中国临床肿瘤协会更新的《肿瘤相关静脉血栓栓塞症预防与治疗指南》[13]增加了导管相关性血栓的诊治流程,不仅体现了临床实践中对CRT的预防、诊断和治疗指导的迫切需求,也为广大肿瘤医生提供了重要的规范指导和参考。
根据目前已有的研究来看,针对消化系统肿瘤患者的CRT危险因素的分析非常少。肿瘤患者CRT的发生率由于置管方式、静脉导管型号、CRT诊断方式的差异而在不同研究中结果有所不同,范围在1.5%至66%之间[6,14-19]。有文章[20]指出使用超声引导穿刺可以提高穿刺的成功率,并减少CRT的发生。本研究所有患者采用超声引导结合改良赛丁格尔技术完成静脉置管,相比于盲穿PICC更加安全。但是由于本研究所有患者均接受血管超声检查,筛查超声可以检测极易被忽略的无症状CRT,使得CRT发病率更高[21]。本研究发现的CRT发生率为21.6%,即3.40例/1 000置管日。
CRT的危险因素一直存在争论。有系统综述指出,其纳入的25篇研究CRT危险因素的文章得出的结论无一相同[22],CRT独立危险因素难以获得共识。本研究发现,肿瘤种类、使用PICC置管以及置管目的为化疗是消化系统恶性肿瘤患者CRT发生的独立危险因素。
Khorana血栓风险评分中认为胃恶性肿瘤和胰腺恶性肿瘤出现VTE的风险极高[11],这与本研究得出的CRT高危因素结论不一致。本研究发现在消化系统肿瘤中,胃癌和结直肠癌的CRT发生风险相对较低,而食管癌CRT的发生率显著升高,差异有统计学意义。本研究的这一发现与Ellis等[5]的研究一致。这也印证了基于VTE的风险预测模型并不适用于CRT的预测。由于目前尚无消化系统肿瘤各癌种间CRT发生率横向对比的研究,因此本研究的实验结果无法与其他研究对比。
中心静脉置管是公认的VTE的高危因素[9],但在CICC和PICC选择上,目前指南认为缺乏足够的证据限制使用中心静脉置管[6]。在CRT的发生率上,多数研究认为PICC相较于CICC有更高的血栓风险[4,23-24],这与本研究的发现一致。其可能的原因在于PICC的管路相对较长,易对血管内皮造成损伤[4],而且PICC相对容易出现导管相关性感染,因而加大CRT的风险[4,25]。
有研究指出,化疗将增加肿瘤患者血栓的风险[24,26];吉西他滨、顺铂[27]以及抗血管生成类药物[11]与VTE的关联最为紧密。目前化疗与CRT是否存在直接的关系尚存在争议。Leung等[22]通过荟萃分析肯定了化疗是CRT的独立危险因素。本研究结果再次验证了化疗将增加CRT的风险,值得引起临床医生的注意。其可能的机制与化疗使肿瘤破坏并释放促凝物质导致血液高凝有关[28]。
本研究存在一些不足:首先,所有的数据均来自同一个中心,但是患者来自全国各地,可以减少这部分的偏倚;其次,本研究要求最终入组的患者至少做过一次血管超声以保证CRT诊断的可靠,但是这也不可避免产生选择偏倚,容易造成CRT发生率的高估。
