GLI基因在癌症中的作用及靶向治疗研究的最新进展
2020-10-23胡泽明汪清志张建康钟佳宁
胡泽明,汪清志,张建康,钟佳宁,陈 斌
(1.赣南医学院第一附属医院;2.赣南医学院2019级硕士研究生;3.赣南医学院科研中心,江西 赣州 341000)
Hedgehog(Hh)信号通路是于1980 年首次在黑腹果蝇的节段发育中发现的一条高度保守的信号通路。这一通路在胚胎发育及组织形成过程中发挥着重要的角色,后来又研究发现在维持成人机体中的干细胞、组织稳态、造血和免疫系统也起着关键作用。已有大量的研究发现Hh 分子信号通路还涉及了多种癌症的发生与发展[1]。经典的Hh 信号通路通过三种Hh 配体的释放而促发,即:Sonic Hh配体(SHH)、Desert Hh 配体(DHH)和Indian HH 配体(IHH)。在没有以上三种Hh 配体的分泌时,PTCH1 受体(一种12 次跨膜蛋白受体)会抑制Smoothened(SMO)受体(一种G蛋白偶联受体)的活性从而使Hh 信号通路处于失活态[2]。而当有Hh 配体的分泌时,其会与PTCH1 受体结合并解除了对SMO 受体的抑制作用,从而导致该信号通路的下游效应因子GLI在细胞膜初级纤毛微管突起处的磷酸化和核易位,并诱导其靶基因包括细胞周期蛋白依赖性激酶和生长因子等的表达[3]。
GLI 转录因子是Kruppel 家族的成员,也是Hh信号通路的主要效应因子。在脊椎动物中鉴定出的GLI 转录因子家族有3 种分别是Gli1、Gli2 和Gli3,然而在果蝇中只发现一种GLI 蛋白。所有的GLI蛋白均含有高度保守的C2H2-Kruppel型锌指结构域和组氨酸-半胱氨酸连接序列,能与靶基因启动子上的一致序列GACCACCCA 结合,进而调节细胞的增殖、分化和凋亡[4]。同时,已有大量的研究表明GLI蛋白的异常表达与多种癌症的进展密切相关[5]。然而,GLI 调控恶性肿瘤的进展及其作为潜在的肿瘤治疗靶点的应用价值分析目前未见系统综述。因此,本文就GLI 基因在肿瘤进展中的作用及其抑制剂的抗肿瘤效应作一综述,旨在为治疗肿瘤患者提供一种可靠的靶标。
1 GLI基因与肿瘤发生发展
已有研究证实Gli1和Gli2的转录激活可能在多种肿瘤的发生中发挥重要作用。关于Gli1 对于肿瘤形成的作用研究已经非常深入,Gli1 的异常表达对基底细胞癌(basal cell carcinoma,BCC)[6]至关重要,而一些肿瘤包括头颈癌、肺癌、消化道肿瘤、乳腺癌、前列腺癌、髓母细胞瘤和黑色素瘤等也与Gli1过表达密切相关。如表1 所示,Gli1 在多种恶性肿瘤中都呈过表达,这足以说明Gli1 基因与肿瘤的发生关系紧密。此外,一项Meta 分析显示,除了颅内肿瘤外,在大多数实体恶性肿瘤中,Gli1过表达通常提示预后较差[7]。一项独立研究也证实了在以高复发、高转移性、预后极差为特征的三阴性乳腺癌中SMO 和Gli1 均过表达[8]。同时还有研究表明,Gli2过表达通过相反的上皮细胞周期停滞信号传导和表皮分化的方式参与Hh 配体诱导的上皮内瘤变,此项研究还显示Gli2 也参与了BCC 的侵袭与转移[9]。
GLI 参与肿瘤发生发展的机制涉及多种途径中的靶基因表达来诱导。如图1所示,GLI通过诱导细胞周期蛋白D1 和D2(Cyclin D1、Cyclin D2)、胰岛素样生长因子2(IGF2)、N-MYC、HES1 等基因的表达来提高肿瘤细胞的增殖能力[27];通过诱导B 细胞淋巴瘤2(BCL2)基因的表达来调节细胞存活;通过诱导血管内皮生长因子(VEGF)和血管生成素(angiopoietin)的表达促进血管生成[28];通过诱导p53 基因破坏遗传的稳定性[29];通过诱导SNAG1锌指蛋白的表达促进上皮间质转化(epithelial-mesenchymal transition,EMT)进而增强肿瘤细胞的侵袭与转移潜能[30];通过调控干基因NANOG 和SOX2 的表达促进干细胞的自我更新[31]。此外,肿瘤的新生血管对肿瘤细胞的营养和代谢废物的清除具有重要意义,并不断促进肿瘤向恶性进展。有报道认为,在神经胶质瘤中Hh-Gli1 信号通路是异常激活的,还可诱导基质金属蛋白酶2/9(MMP-2 和MMP-9)和VEGF 的表达来促进肿瘤血管生成[32]。
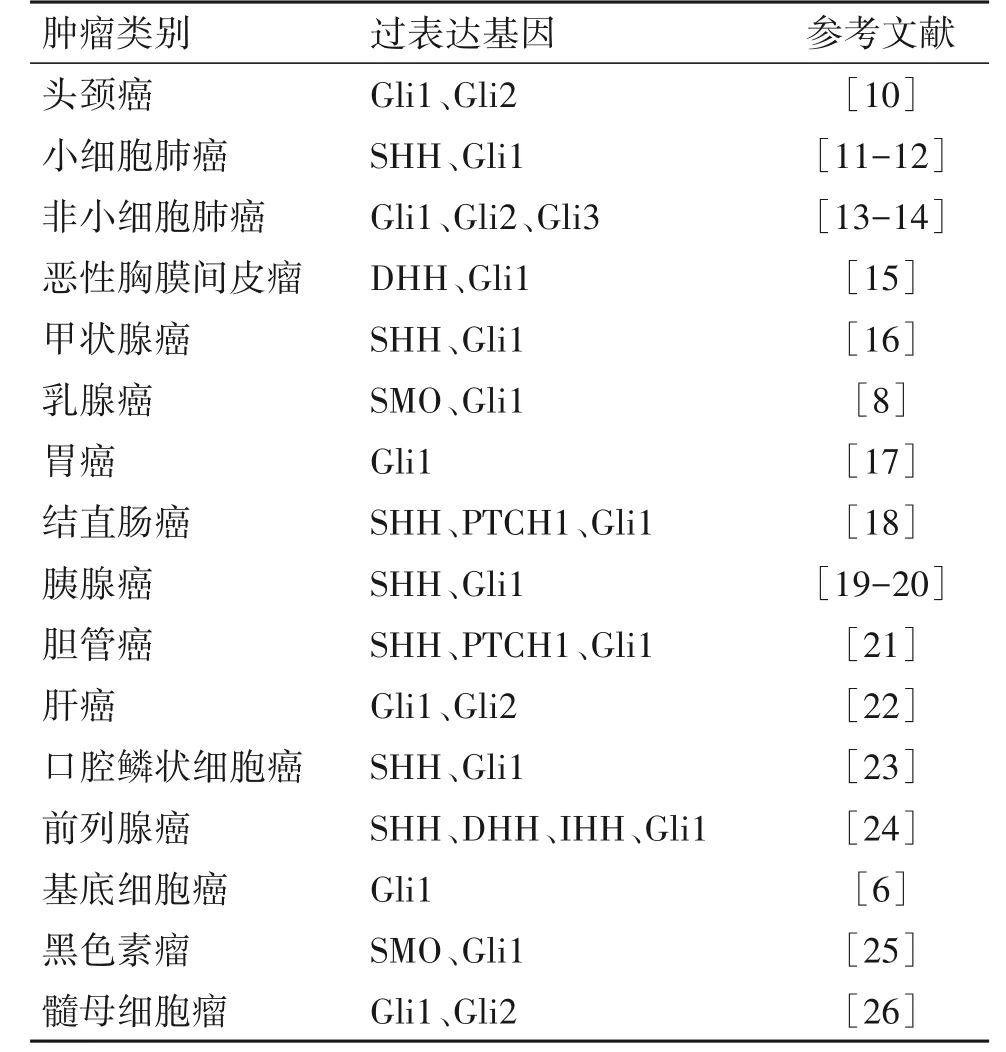
表1 GLI在多种类型的癌症中过表达

图1 GLI通过多种途径促进肿瘤发生发展
EMT 时常发生在肿瘤侵袭和转移过程中,主要受肿瘤微环境和炎症介质的调控。发生EMT 的细胞通常表现为钙粘蛋白(E-cadherin)下调,以及波形蛋白(vimentin)和纤连蛋白(fibronectin)的上调,从而导致肿瘤细胞更容易侵犯基底膜和血管,最终促发肿瘤的转移。最近的一项对胃癌中GLI 与EMT相关基因的研究表明,Gli1 过表达与Snail 的上调及E-cadherin 的下调密切相关[33]。此外,另有研究认为Gli1 和Gli2 可通过降低E-cadherin 的表达来诱导EMT并促进肺腺癌[34]的侵袭和转移。
2 GLI基因与肿瘤干细胞
原发肿瘤行手术切除后的转移和复发是当今世界治疗癌症的两大难题,一些肿瘤患者在经历较长时间的无疾病生存期后仍会出现肿瘤复发的情况。其中有一种科学假说认为在肿瘤患者中存在着一些特殊的癌细胞亚群,它们被赋予了干细胞的特征。肿瘤干细胞(cancer stem cells,CSC)具有产生大部分肿瘤中所有细胞类型的能力,因此能够引发继发性肿瘤的形成。有大量的研究表明,Hh信号通路可以驱动CSC 在胶质母细胞瘤、乳腺癌、前列腺癌、肺癌、胰腺癌、结肠癌、多发性骨髓瘤和慢性粒细胞白血病中的维持[35]。GLI 蛋白通过调节CSC中的干基因如NANOG、OCT4、SOX2、WNT-2、CD44和Kruppel 样因子4(KLF4)的表达而有助于CSC 细胞亚群的维持[36]。因此,有学者研究出阻断Hh 信号通路可以抑制髓母细胞瘤中CSC 的增殖及自我更新能力[37]。相似的是,SINGH 等[38]也证明了抑制Hh-GLI 信号通路会明显提高胰腺癌中CSC 的凋亡率。与这些结果一致的是,有研究发现特异的针对Gli1 和Gli2 的siRNA 转染降低了BMI-1 介导的乳腺癌中CSC 的自我更新能力[39]。VARNAT 等[40]分析了40 例结肠癌患者,证实了在肿瘤转移过程中,CSC 中的Gli1 水平在持续升高,这进一步支持了GLI 与CSC 的相关性。此外,还有研究发现表皮生长因子受体(EGFR)传导和Gli1 之间的共同协作影响了非小细胞肺癌(NSCLC)中CSC 的干细胞样功能,这提示了一种EGFR 突变的NSCLC 的治疗新策略[31]。
3 GLI抑制剂
靶向Hh-GLI 信号通路是近年来治疗肿瘤的新策略。最初,Hh-GLI 信号通路以SMO 水平为靶点来研究抑制剂,试图绕过常在Hh 相关的肿瘤(如髓母细胞瘤和BCC)中失活的PTCH1 基因。环巴胺(Cyclopamine),一种源自某种植物的天然甾体生物碱,是第一种被发现的SMO抑制剂。由于Cyclopamine的溶解度和药代动力学性能较差,并不适用于临床,因此就有许多Cyclopamine 的衍生物被开发出来,以提高其特异性和疗效。目前为止,两种SMO抑制剂(LDE225/sonidegib 和GDC-0449/vismodegib)已被FDA 批准用于治疗BCC 患者,而且一些临床试验正在进行评估当它们用于其他肿瘤患者后的疗效。不幸的是,使用SMO 抑制剂的一些肿瘤患者出现了耐药性,其耐药性的机制可能包括SMO 的突变、Gli2的扩增以及PI3K/AKT 等协同信号通路的表达上调。因此,有学者提出通过研究具有不同作用机制的第二代SMO 抑制剂,即SMO 下游的GLI 抑制剂,可解决SMO突变造成的耐药性问题。
3.1 GANT58 和GANT61GANT58 和GANT61是小分子GLI 拮抗剂,可干扰GLI 与高度保守的DNA 序列结合,但GANT61 对GLI的特异性更高,能更有效地阻断GLI 与DNA 的序列结合。这两种抑制剂在体外能诱导肿瘤细胞的凋亡,在体内能抑制肿瘤组织的生长。例如,GANT61 在肺癌异种移植瘤模型[41]、急性髓系白血病[42]、横纹肌肉瘤[43]、神经母细胞瘤[44]、乳腺癌[45]、胰腺癌[46]中均显示出GLI特异性的抗肿瘤作用。此外,也有研究报道了这两种抑制剂可以影响G1/S 期的细胞周期停滞。最近又发现GANT61 还有其他作用包括:诱导DNA 双链断裂、刺激线粒体产生活性氧(ROS)、减缓EMT 的发生以及诱导自噬的形成。同时有学者发现应用GANT61 处理后会影响GLI 靶基因的表达,如人类端粒酶逆转录酶(TERT),进而影响细胞的增殖潜能[47]。
通过比较SMO 抑制剂和GLI 抑制剂可以明显看出,GLI 抑制剂在肿瘤治疗中更为有效。例如,BENVENUTO 等[45]在裸鼠异种移植瘤模型中比较了两种抑制剂在乳腺癌生长中的作用,其研究数据表明GANT61 的抑制作用比GDC-0449 更为明显。相似的结果也在来源于最常见和最具侵袭性的18 种细胞系上得到证明,并一致认为GANT61 比SMO 抑制剂更有效[48]。此外,在博来霉素诱导的肺纤维化小鼠模型中也发现GLI 抑制剂比SMO 抑制剂更为敏感[49]。在横纹肌肉瘤[43]、胆道恶性肿瘤[50]、神经母细胞瘤[44]和慢性淋巴细胞白血病[51]的体内外实验中,GANT61均被证明比Cyclopamine更为有效。
3.2 ATO三氧化二砷(ATO)已被FDA 批准成为急性早幼粒细胞白血病(APL)的患者对反式维甲酸治疗无效或复发的第二种治疗方案。该药物会直接与GLI 相互作用,并抑制其活性从而下调GLI 靶基因的表达。KIM 等发现ATO 通过阻止Gli2 从初级纤毛上转运的方式而抑制其活化。HAN 等[52]认为ATO可能是通过取代GLI锌指蛋白中的锌离子并使其失活,从而成为Hh-GLI分子通路的抑制剂。关于ATO 的抗肿瘤作用在临床治疗中也有研究,YANG 等[53]研究发现,86%的APL 患者经ATO 治疗后病情得到缓解,这些患者的Gli2 和SMO 基因表达明显下调,PTCH1 和GLI1 的基因表达轻微下调。ATO 可直接靶向GLI转录因子治疗复发性和难治性的横纹肌肉瘤。更有趣的是,ATO 与伊曲康唑的协同组合治疗比单独使用这两种药物更能下调Gli1的表达[54]。
3.3 Glabrescione BGlabrescione B(GlaB)是一种天然存在于豆科植物种子中的异黄酮,它被认为是通过与Gli1 结合后并干扰其与DNA 之间的相互作用,从而减弱GLI 活性的新型小分子。GlaB 由于对Gli1 的活性有较强的抑制作用,在体内外实验中均可抑制Gli1 依赖性的肿瘤细胞生长,并抑制CSC的自我更新能力和克隆原性[55]。
3.4 Pirfenidone吡非尼酮(Pirfenidone)是PI3K/AKT 信号通路的特异性抑制剂,并通过该通路下调Gli1 的表达[56]。Pirfenidone 是一种抗纤维化药物,对特发性肺纤维化的患者治疗效果显著,因为该药具有明显的抗炎、抗氧化和抗纤维化作用。Pirfenidone 也可以选择性地破坏Gli2 的稳定性,从而阻断Hh 和TGF-β 分子信号通路的激活。由于这两种信号通路都有利于肿瘤的发生发展,因此Pirfenidone 对与GLI 相关的肿瘤具有拮抗作用。事实上,最近的一些研究表明Pirfenidone 用于治疗肺癌、乳腺癌等恶性肿瘤是一种有希望的抗肿瘤药物[57]。此外,MIURA 等[58]的一项研究表明,特发性肺纤维化的患者在接受Pirfenidone 治疗后其肺癌发病率明显降低。
3.5 HPIsHPIs(HPI-1、HPI-2、HPI-3 和HPI-4)已被认为是一种针对GLI 的Hh 信号通路抑制剂。研究表明,HPIs 在SMO 的下游起作用,影响GLI 的稳定性、降解速度以及GLI 向初级纤毛的转运[59]。经过高通量筛选,HPI-1 被认定为是一种能够拮抗SMO 激动剂(SAG)所诱导的GLI 靶基因表达的化合物。HPI-1 也可通过靶向GLI 蛋白的翻译后修饰或转录因子与辅助因子之间的相互作用从而阻断Hh信号通路的激活。有学者研究出可以将HPI-1 包裹在聚乙二醇(PEG)偶联的聚乳酸-糖基乙酸(PLGA)纳米颗粒中,并成功应用于髓母细胞瘤和胰腺癌的小鼠异种移植瘤模型中[60]。
3.6 其他GLI抑制剂针对GLI的其他Hh通路抑制剂还有咪喹莫特(Imiquimod)、纳米奎纳克林(nanoquinacrine,NQC)和扑蛲灵(Pyrvinium)等。咪喹莫特是Toll样受体7/8(TLR7/8)的激动剂,通过与腺苷受体(ADORAs)的相互作用来激活蛋白激酶A(PKA),从而促进Gli2的磷酸化和降解[61]。NQC,奎纳克林(一种抗癌药)的球状纳米颗粒,已被证明以多种方式干扰Hh-GLI 分子通路的表达。NQC 会增强GSK3β 和PTEN 负向调节基因的表达,还会干扰Gli1 与DNA 结合序列之间的结合,从而增强Gli1-DNA 复合物的不稳定性。因此,已有研究证明NQC可以影响Gli1 依赖的细胞增殖和肿瘤生长[62]。Pyrvinium 是一种已被FDA 批准的抗蠕虫药物,已被证实可降低GLI 转录因子的稳定性。Pyrvinium 作为CK1 的变构激活剂,促进了CK1 与Gli1 的结合,并导致Gli1 的磷酸化和随后的蛋白酶体降解[63]。此外,组蛋白去乙酰化酶6(HDAC6)在髓母细胞瘤中可以调节Gli2 的mRNA 和Gli3 的蛋白表达,因此HDAC6 抑制剂可能是Hh 相关肿瘤中新的潜在靶点[64]。阿司匹林(aspirin)作为一种广泛应用于临床的解热镇痛抗炎药,对Hh-GLI信号通路也有抑制作用,能够使恶性胶质瘤细胞对替莫唑胺(temozolomide)的化疗更敏感[65]。
总结以上各种GLI抑制剂及其在肿瘤中的效应见表2,其中只有ATO、Pirfenidone 和Imiquimod 已经进入了不同类型癌症的临床试验。除了白血病外,ATO 也被用于在SMO 抑制剂治疗后复发的BCC 患者[66]。Pirfenidone 的Ⅱ期临床试验显示Pirfenidone对成神经细胞瘤的患者有益,大部分患者的无疾病进展期延长,部分患者的肿瘤体积缩小了15%[67]。Imiquimod也已经在BCC、乳腺癌和宫颈癌患者中进行了临床测试[68-69]。在乳腺癌中,局部应用Imiquimod的患者具有良好的耐受性,并可诱导疾病的消退。然而在宫颈癌中的试验结果存在争议,一些患者在应用Imiquimod 后没有效果甚至病情还得到恶化,另一些患者则有效地缓解了疾病进展,因此未来需要更多的临床研究来验证Imiquimod的疗效。

表2 GLI抑制剂及其在各种肿瘤中的作用
4 总结与展望
GLI 蛋白是经典的Hh 信号通路下游的调控因子,异常激活的GLI 在诸多癌症中经常发生,同时GLI会通过调节一些靶基因促进细胞增殖、存活、血管生成、遗传不稳定性、EMT 和干细胞的自我更新等方式参与了肿瘤的发生发展。此外,GLI 在CSC的调节中也发挥了关键作用。因此,GLI 已然成为了治疗肿瘤的最具吸引力的新靶标。目前针对GLI靶点开发的抑制剂也越来越多,其各种抑制剂在体内外实验中都展现出了一种较好的前景,但只有3种GLI抑制剂进入临床试验阶段。未来的研究重点是需要开发出更多的GLI分子靶向药物并在临床试验中进一步验证,为肿瘤患者的治疗提供一种更安全有效的选择。
