病因不明青年缺血性脑卒中患者血清尿酸水平与脑动脉狭窄的相关性
2020-10-23李明浩张举孔韩星伟
李明浩 张举孔 韩星伟 孙 军
1)南阳市第二人民医院,河南 南阳 473000 2)南阳市中心医院,河南 南阳 473000
脑卒中发病率不断上升,具有高致残率和高病死率,严重威胁人类的生命健康[1]。HATHIDARA等[2]研究显示青年脑卒中患者占全部脑卒中的10%~15%。因其致残率和病死率均高,严重威胁人类的生命健康[2]。目当前关于年轻脑卒中患者的研究报告较少,主要因相对于老年患者,年轻脑卒中的病因大多不明[3]。鉴于脑动脉狭窄是缺血性脑卒中发生发展的一个关键危险因素[4],故及早发现脑动脉狭窄并采取相应措施对防治缺血性脑卒中具有重要意义。
血清尿酸(uric acid,UA) 被认为是氧化代谢受损的标志[5],也被证明是一种强大的内源性抗氧化剂,并可清除体内的一氧化氮自由基。UA的双刃剑特性使得关于其是否会增加脑血管疾病的风险存在巨大争议[6],本文探索血清UA水平与病因不明青年缺血性脑卒中患者脑动脉狭窄的相关性。
1 资料与方法
1.1研究对象选取2013-01―2016-01在南阳市第二人民医院神经内科住院的病因不明青年缺血性脑卒中患者156例(病例组),均经体格检查、DSA 血管造影和影像学检查确诊为缺血性脑卒中。纳入标准:(1)年龄15~50岁;(2)发病7 d内;(3)病因不明。排除标准:年龄(1)<15岁或>50岁;(2)大脑或蛛网膜下腔短暂性脑缺血发作;(3)伴恶性肿瘤、血液系统疾病、自身免疫性疾病等;(4)3个月内服用影响尿酸代谢的药物(如利尿药、抗痛风药);(5)其他确定病因的脑卒中。选取同期健康人81例作对照。所有研究对象均知情同意,本研究经南阳市第二人民医院伦理委员会批准。
1.2研究方法
1.2.1 资料收集:包括年龄、性别、吸烟、饮酒、糖尿病、肥胖、冠心病史及其他相关病史。
1.2.2 血清检验:所有患者均于入院次日早晨空腹抽取血样。血清总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、纤维蛋白原(Fib)和UA 的水平使用贝克曼AU680化学系统和贝克曼LH 780血液分析仪根据制造商的说明进行分析(Beckman Coulter,Brea,CA,USA)。
1.3DSA血管造影术对脑动脉狭窄的诊断和评估所有患者采用西门子公司数字平板血管造影系统(DAS)检测病变脑血管,血管图像由2位独立的高年资医师进行评估。
1.4分组将青年缺血性脑卒中患者根据DSA结果分为3个亚型组:(1)按脑动脉狭窄程度:无狭窄组、轻度狭窄组(<50%)、中度狭窄组(50%~70%)、重度狭窄组(>70%)。(2)按脑动脉狭窄支数:分为0支、1支、2支和≥3支病变组;狭窄支数评价标准:大血管及其主要分支狭窄率>50%或闭塞。(3)按脑动脉狭窄部位:①颅内脑动脉狭窄组(intracranial cerebral arterial stenosis,ICAS):狭窄位于颈动脉颅内段(I-ICA)(C4~C7)、大脑中动脉(MCA)、大脑前动脉(ACA)、大脑后动脉(PCA)、椎动脉颅内段(I-VA)(V4)、基底动脉(BA);②颅外脑动脉狭窄组(extracranial cerebral arterial stenosis,ECAS):狭窄位于颈动脉(CCA)、颈外动脉(ECA)、颈内动脉(E-ICA)、椎动脉(V1-V3)、锁骨下动脉(SCA);③合并脑动脉狭窄组(combined cerebral arterial stenosis,COAS):上述部位合并狭窄;④无脑动脉狭窄组(NCAS)。
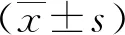
2 结果
2.1脑动脉狭窄单因素分析病因不明青年缺血性脑卒中患者血清UA和LDL-C水平显著高于对照组,血清HDL-C水平显著低于对照组。其他因素比较差异均无统计学意义(P>0.05)。见表1。
2.2脑动脉狭窄多因素Logistic回归分析选择HDL-C、LDL-C、UA、酗酒史及吸烟史5个因素进行多因素Logistic回归分析,发现UA与病因不明青年缺血性脑卒中独立相关。见表2。

表1 青年缺血性脑卒中患者脑动脉狭窄单因素分析Table 1 Single factor analysis of cerebral artery stenosisin young ischemic stroke patients
2.32组血清UA水平比较
2.3.1 各组UA水平比较:不同程度的脑动脉狭窄青年脑卒中患者分布:无狭窄27例(17.3%),轻度狭窄32例(20.5%),中度狭窄为29例(18.6%)以及重度狭窄68例(43.6%)。与对照组相比,患者组血清UA均显著升高(P<0.05);与无狭窄组相比,轻、中、重度狭窄组UA水平均有显著差异,且血管狭窄程度越重,UA水平升高越明显(P<0.05)。见表3。

表2 青年缺血性脑卒中患者脑动脉狭窄单因素分析Table 2 Multivariate Logistic regression analyses for predictorsof cerebral artery stenosis in young ischemic stroke patients

表3 对照组与不同脑动脉狭窄程度亚组UA水平比较
2.3.2 对照组与不同脑动脉狭窄支数亚组UA水平比较:0条动脉狭窄47例(30.1%),1条动脉狭窄58例(37.2%),2条动脉狭窄31例(19.9%),3条及3条以上动脉狭窄20例(12.8%)。与对照组相比,0支、1支、2支及≥3支狭窄组UA水平均明显升高(P<0.05),且随着狭窄支数的增多,UA水平升高越发显著(P<0.05)。见表4。
2.3.3 对照组与不同脑动脉狭窄部位亚组UA水平比较:不同部位脑动脉狭窄的青年脑卒中患者分布比例:NCAS组47例(30.1%),颅内动脉狭窄53例(34%),颅外动脉狭窄35例(22.4%),颅内外合并狭窄21例(13.5%)。与对照组相比,病例组血清UA水平均明显升高(P<0.05);且与NCAS 组相比,ICAS、ECAS及COAS组UA水平均显著升高(P<0.05),与ECAS、ICAS 组相比,COMS组UA水平均升高(P<0.05),但ECAS组与ICAS组相比,UA 水平无显著性差异(P>0.05)。见表5。

表4 对照组与不同脑动脉狭窄支数亚组UA水平比较

表5 对照组与不同脑动脉狭窄部位亚组UA水平比较
3 讨论
UA是嘌呤代谢的最终产物[7]。约10%的中国人有高尿酸血症[8],但UA与脑血管疾病的关系仍旧扑朔迷离[9]。UA曾被认为是一种抗氧化物质,可以预防动脉硬化[10],但前瞻性研究表明UA水平是脑心血管疾病的重要预测因子。美国学者认为高尿酸血症是心肌梗死和脑卒中的独立危险因素[11]。WANG等[13]认为UA是绝经后妇女心血管事件的预测因子[12]。此外,高尿酸血症还增加了脑卒中患者死亡和复发的风险,但目前并未发现在青年脑卒中患者中血清UA与脑动脉狭窄的相关性。
本研究发现血清UA与脑动脉狭窄具有显著相关性,且随狭窄程度和病变支数的增加而升高,这与之前的研究基本一致[14]。推测由于脑动脉狭窄发生的主要病因是脑内动脉粥样硬化,而高尿酸血症在动脉硬化的发病过程中起重要作用:(1) UA促进脂质过氧化,产生氧自由基,引起血管壁炎症,促进动脉粥样硬化[15];(2) 过量的UA会转化为晶体,引起血管壁的严重炎症[16]。研究表明在动脉粥样硬化斑块中存在大量尿酸晶体[17];(3) UA引起炎症,引起血小板活化,刺激了级联凝血,最终导致动脉粥样硬化血栓形成[18];(4) UA可激活局部氧化剂和炎性细胞因子,如白细胞介素(IL)-1b、肿瘤坏死因子-α和IL-6[19];(5) 与UA相关的肾素-血管紧张素系统的激活可能攻击大脑循环[20]。
本研究发现合并狭窄组血清UA均高于颅内和颅外动脉狭窄组,可能因颅内狭窄和颅外狭窄的病理机制差异相关。LANLLNEI等[21]认为,缺血性脑卒中患者尸检中颅内和颅外动脉粥样硬化斑块的组成并不相同。与正常人相比,颅内狭窄动脉粥样硬化患者颅内动脉中有较少的抗氧化剂,对于治疗动脉粥样硬化有一定的作用[22],且低壁切应力和高脂血症是颅外动脉粥样硬化斑块形成的主要血流动力学危险因素[23]。因此,抗氧化剂对颅内狭窄有一定的保护作用。本研究表明血清UA上调并不能预测青年缺血性脑卒中患者脑动脉狭窄位置,可能由于血清UA在颅内和颅外不同的病理机制,当然这还需要更大的样本量进行后续的探索。本研究未证明脑动脉狭窄与糖尿病、高血压、肥胖、TC、TG之间的显著相关性,与既往发现糖尿病、高血压是颅内动脉狭窄的独立危险因素不一致[24],可能与本研究选取对象为青年人有关,老年人群糖尿病和高血压的发病率较高。此外,本研究病例组血清HDL-C明显低于对照组,LDL-C显著高于对照组,可能与HDL-C对脑动脉狭窄有一定的保护作用有关,LDL-C越高脑动脉狭窄风险越大[25]。
本研究初步表明病因不明青年缺血性脑卒中患者血清UA与脑动脉狭窄呈正相关,可推测血清UA是脑动脉狭窄的危险预测因子因素,但也存在一定的局限性,主要在于血清UA与脑动脉狭窄的独立关联机制尚不清楚,需要进一步的探究。
