CT影像组学评估胰腺癌生物学行为的价值
2020-10-22顾潜彪谭显政胡小丽刘建滨刘鹏
顾潜彪,谭显政,胡小丽,刘建滨,刘鹏*
1.湖南省人民医院,湖南师范大学附属第一医院放射科,湖南长沙 410005;2.湖南中医药大学第一附属医院放射科,湖南长沙410007; *通讯作者 刘鹏 lpradiology@163.com
胰腺癌是一种高度恶性的消化系统肿瘤,预后极差,5年总体生存率仅为8%[1]。近年随着医学领域科学技术的发展,各种治疗新理念、新技术以及抗肿瘤药物的应用发展为胰腺癌的治疗带来机遇。然而,目前尚缺乏可应用于术前准确识别肿瘤生物学行为,以指导个性化治疗策略的检测方法。影像组学在肺癌、消化道肿瘤及乳腺癌等的诊断、治疗及预后方面具有良好的应用前景[2-4]。本研究拟探讨CT 影像组学用于术前评估胰腺癌肿瘤生物学行为,以期为临床治疗决策提供参考。
1 资料与方法
1.1 研究对象 回顾性收集2014年1月—2018年11月于湖南省人民医院经手术病理证实的胰腺癌患者。纳入标准:①行胰腺癌根治性外科手术和区域淋巴结清扫;②具有淋巴结转移情况和肿瘤分化程度的完整记录;③术前行CT 增强检查;④未行任何抗肿瘤治疗。排除标准:①合并其他原发恶性肿瘤者;②CT 图像无明确肿块或肿块显示不清,不符合图像后处理要求者。最终纳入94 例患者,均为导管腺癌,其中男55 例,女39 例;年龄37~80 岁,平均(59.3±9.6)岁。分别根据肿瘤的分化程度将所有患者分为中-高分化组及低分化组;根据肿瘤淋巴结转移情况分为淋巴结转移阳性组及淋巴结转移阴性组。然后按照7∶3 采用随机分层抽样方法将所有患者分为训练组65 例和验证组29 例。
1.2 CT 检查方法 采用Philips Brilliance iCT 256 螺旋CT 机行上腹部或全腹部CT 增强扫描。采用Ulrich XD 2060双筒高压注射器经右肘前静脉注射造影剂碘海醇300(300 mg/ml),用量1.2~1.5 ml/kg,速度3 ml/s。分别于注射后25~35 s、60~70 s、3 min 进行动脉期、静脉期和平衡期扫描。扫描层厚2~5 mm,重建层厚5 mm,螺距自动匹配,管电压120 kV,管电流200~380 mA。
1.3 感兴趣区分割及影像组学特征提取 将所有患者的CT 静脉期图像以BMP 格式从PACS 系统工作站中导出, 再依次导入 MaZda 4.7 软件(http://www.eletel.p.lodz.pl/mazda/)。采用人工手动分割方法沿病灶轮廓内缘逐层画感兴趣区(ROI)。分割过程中尽量避开扩张胰管及周围血管,最后完成病灶的三维立体(VOI)分割。分割过程由2 名腹部影像诊断主治及以上医师通过协商达成共识。完成肿瘤分割后,再次采用MaZda 软件基于VOI 进行影像组学特征提取。在特征提取前,进行[μ-3δ,μ+3δ](μ和δ分别是平均灰度值和标准差)灰度归一化处理,以减少对比度和亮度变化的影响[5]。最终每位患者共提取影像组学特征343 项,包括:①直方图特征(均值、方差、偏态系数、峰度以及第1、10、50、90、99 百分位);②绝对梯度(均值、方差、偏态系数、峰度、非零梯度百分比);③游程矩阵(游程长度非均匀性、灰度非均匀性、长游程补偿、短游程补偿、行程图像分数);④共生矩阵(能量、对比度、自相关、平方和、和均值、和方差、和熵、熵、差方差、差熵、逆差矩)。见图1。

图1 病灶VOI 分割及影像组学特征提取。A.沿肿块轮廓内缘手动逐层画取ROI;B.完成病灶VOI 分割;C.特征提取参数设置;D.影像组学特征提取
1.4 统计学方法 采用 SPSS 20.0 及 R 3.6.0(http://www.r-project.org)进行分析。在训练组中分别对肿瘤中-高分化组与低分化组、淋巴结转移阳性组与阴性组间基本资料及影像组学特征进行统计分析,建立影像组学模型评分(Rad-score),在验证组中对Rad-score 诊断效能进行验证。年龄等符合正态分布的计量资料以±s表示,组间比较采用独立样本t检验;性别、肿瘤部位等计数资料组间比较采用χ2检验。采用MaZda 软件提取影像组学特征后,运用R 语言中的Caret 包进行数据预处理。首先剔除近似零方差的特征,再删除相关系数>0.9 和存在多重共线的影像组学特征,采用R 语言中的Glmnet 包进行Lasso 特征选择并建立二元Logistic 回归模型,最终计算出每位患者的Rad-score。运用受试者工作特征(ROC)曲线评估模型诊断效能,P<0.05 表示有统计学意义。
2 结果
2.1 一般资料 胰腺癌中-高分化组与低分化组患者年龄、性别及肿瘤部位差异均无统计学意义(P>0.05)。胰腺癌淋巴结转移阳性组与阴性组患者年龄、性别差异均无统计学意义(P>0.05);肿瘤部位分布差异有统计学意义(P=0.04,表1)。
2.2 胰腺癌分化程度诊断模型的建立及其诊断效能共提取影像组学特征343 项。经R 软件Caret 包剔除近似零方差、相关系数>0.9 和存在多重共线的特征变量后剩余97 项影像组学特征;再通过Lasso 方法进行特征选择,最终选择出7 项系数非零的影像组学特征。根据这些特征及对应的权重系数,按公式(1)计算每位患者的Rad-score:

表1 94 例胰腺癌患者的基本资料

结果显示,影像组学模型Rad-score 在训练组及验证组中的ROC 曲线下面积分别为0.77、0.71,敏感度分别为69.2%、69.2%,特异度分别为76.9%、75.0%(图2)。中-高分化组患者Rad-score 平均值为0.1620,显著高于低分化组的-1.0418。
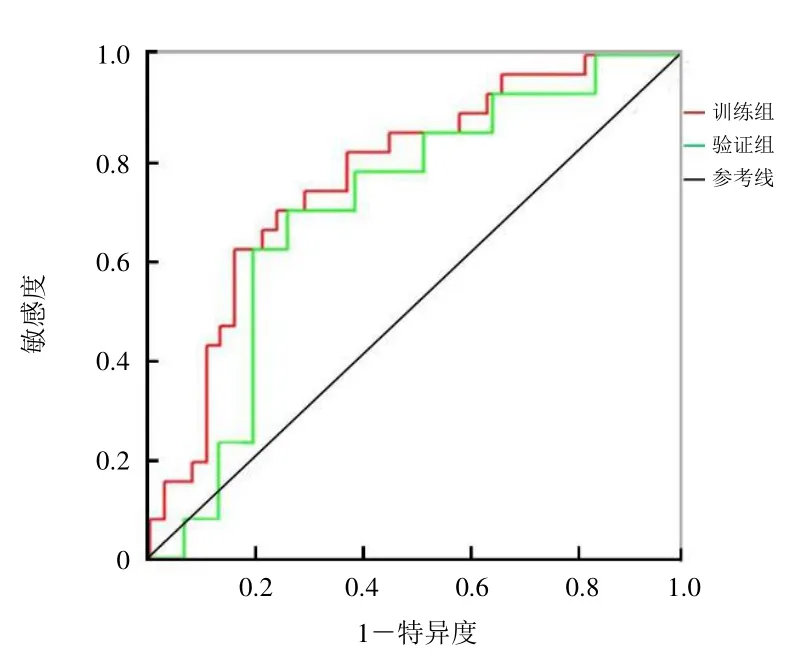
图2 胰腺癌分化程度预测模型的ROC 曲线
2.3 胰腺癌淋巴结转移诊断模型的建立及其诊断效能 共提取影像组学特征343 项。经R 软件Caret 包剔除近似零方差、相关系数>0.9 和存在多重共线的特征变量后剩余97 项影像组学特征。再通过Lasso 方法进行特征选择,最终选择出5 项系数非零的影像组学特征,根据这些影像组学特征及肿瘤部位(非胰头=0,胰头=1)对应的权重系数,按公式(2)计算每位患者的Rad-score:
Rad-score=-1.396×Skewness3D+0.099×S.1.0.0.SumVarnc-2.124×S.0.5.0.SumAverg+0.881×S.5..5.0.SumAverg-0.021×S.5..5.0.SumVarnc+1.319×肿瘤部位+44.036(2)
结果显示,影像组学模型Rad-score 在训练组及验证组中的ROC 曲线下面积分别为0.80、0.73,敏感度分别为68.2%、50.0%,特异度分别为88.4%、92.3%(图3)。淋巴结转移阳性组患者Rad-score 平均值为0.0008,显著高于淋巴结转移阴性组的-1.4622(图4~7)。

图3 胰腺癌淋巴结转移诊断模型的ROC 曲线
3 讨论
胰腺癌生物学行为恶劣,是影响患者治疗方法选择和预后的重要因素。通常分化越低的胰腺癌恶性程度越高,越容易发生转移和血管浸润[6]。无论胰腺癌位于胰头还是胰体,也无论是否行根治性手术切除治疗,淋巴结转移均是影响其预后的独立危险因素[7-8]。既往研究表明,常规影像学检查在评估胰腺癌生物学行为,尤其是肿瘤的分化程度及淋巴结转移等方面存在一定的局限性[9]。本研究探讨基于影像组学的方法预测胰腺癌的肿瘤生物学行为,并获得了较好的预测效能,为临床术前评估胰腺癌生物学行为提供了一种相对无创的评价方法。

图4 男,57 岁,胰腺导管腺癌,中度分化。分化程度影像组学模型评分1.3317,红圈表示肿瘤位置

图5 女,47 岁,胰腺导管腺癌,低分化。分化程度影像组学模型评分-2.8428,红圈表示肿瘤位置
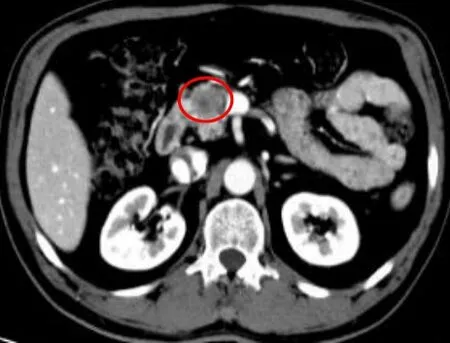
图6 男,55 岁,胰腺导管腺癌,伴淋巴结转移。淋巴结转移影像组学模型评分1.3317,红圈表示肿瘤位置
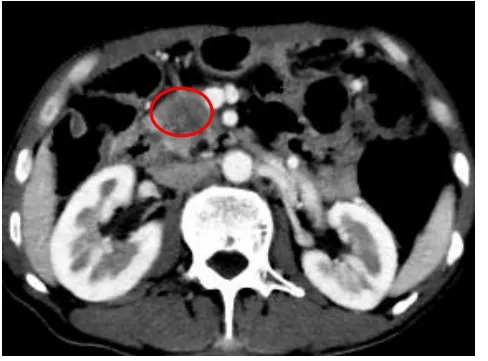
图7 男,53 岁,胰腺导管腺癌,无淋巴结转移。淋巴结转移影像组学模型评分-3.5817,红圈表示肿瘤位置
本研究发现,影像组学标签可预测胰腺癌的分化程度。胰腺癌是典型的乏血供肿瘤,癌组织由癌细胞、间质星形细胞及丰富的细胞外间质构成,间质纤维化是其主要的病理学特征[10-11],这种间质纤维化特征导致对比剂渗透性减低。因此,胰腺癌组织在影像增强图像上较胰腺正常组织呈低密度改变。此外,高、低分化胰腺癌肿瘤实质处微血管密度、肿瘤坏死程度等也存在差异。这一系列的病理改变导致不同分化程度的肿瘤在像素灰度等定量影像组学特征方面存在差异,使得采用CT 影像组学预测肿瘤分化程度成为可能。方旭等[12]对胰腺癌磁共振波谱成像研究未发现磁共振波谱成像参数与肿瘤分化程度的相关性。马婉玲等[13]报道体素内不相干运动扩散加权成像定量参数慢表观扩散系数值和灌注分数能够鉴别高-中分化胰腺癌和低分化胰腺癌,但该技术尚需大样本研究证实。本研究以常规应用于胰腺癌诊疗的CT 图像为基础,构建预测胰腺癌分化程度的影像组学模型,同样显示出较高的预测效能,且具有成像速度快、简便、经济等优势。
本研究发现,影像组学标签能预测胰腺癌淋巴结转移。胰腺癌淋巴结状态是胰腺癌的独立预后因素。MRI、PET/CT、超声内镜等多种检查对胰腺癌淋巴结转移的诊断准确度均较差[14-16]。近年影像组学的发展为定量肿瘤生物学行为提供了新方法。CT 影像组学在结直肠癌、肺癌及食管癌等肿瘤淋巴结转移预测中的应用充分显示了影像组学在预测肿瘤淋巴结转移方面的潜力[17-19]。房炜桓等[20]基于双能量CT 图像纹理分析,纳入30 项纹理特征预测胰腺癌淋巴结转移获得了理想结果;但该研究并未对其进行内部或外部验证。本研究基于5 项影像组学特征及肿瘤部位建立的影像组学标签亦显示出较高的预测效能,预测标签更简洁,且在内部独立验证组中得到验证,在一定程度上避免了过拟合的风险。
本研究存在一定的局限性:①样本量较小,且为单中心研究,需大样本、多中心研究进行验证;②仅分析了单期CT 图像。MRI 具有更高的软组织分辨率、多序列成像包含更多信息,CT、MRI 及影像新技术、多期图像的多模态数学模型联合预测,其诊断效能可能更佳。
总之,CT 影像组学可无创性地评估胰腺癌的生物学行为,对术前评估胰腺癌的恶性程度、协助临床制订胰腺癌的治疗决策具有一定的参考意义。
