双能CT影像组学在诊断不同分化程度胃癌中的应用
2020-10-22寸红丽李华秀张大福石磊王娜王关顺
寸红丽,李华秀,张大福,石磊,王娜,王关顺
昆明医科大学第三附属医院云南省肿瘤医院放射科,云南昆明 650118; *通讯作者 王关顺 wgsh602@vip.163.com
胃癌是常见的消化系统原发性恶性肿瘤,东亚属于高发区,起病较隐匿,且国内内镜筛查尚未普及,发现时常处于晚期,预后较差[1-2]。多种因素影响患者预后,其中组织学分化程度是重要因素,分化程度越低,恶性程度越高,预后更差[1-4]。Decourcy 等[5]研究发现不同分化程度的胃癌生物学行为及化疗敏感性存在差异。术前准确评估胃癌组织分化程度对合理选择治疗方案及判断预后具有重要意义。国际抗癌联盟(Union for International Cancer Control,UICC)和美国癌症联合会(American Joint Commission for Cancer,AJCC)胃癌分期系统推荐胃癌首选的检查方法为内镜和CT[6]。常规CT 用于评价分化程度存在一定的困难;而双能CT(double energy computed tomography,DECT)能够提供多种定量分析方法,包括碘值与能谱曲线等,在鉴别组织学分化程度与胃癌分型方面具有较好的应用前景[7]。近年研究表明,影像组学特征与肿瘤生物学行为存在相关性,初步证实了影像组学特征在鉴别肿瘤组织分化程度、判断疗效及预后中的价值[8-9]。目前,结合影像组学特征和DECT 碘值对胃癌组织学分化程度进行评估的相关研究鲜有报道。本研究基于DECT 定量碘值及影像组学特征评估胃癌组织的分化程度。
1 资料与方法
1.1 研究对象 回顾性分析2017年9月—2018年7月云南省肿瘤医院经术后病理证实的109 例胃癌患者的临床资料。纳入标准:①经过胃镜取材活检证实为胃癌;②首诊未进行任何治疗;③无CT 检查禁忌证;④患者均在CT 扫描后1 周内接受手术,且有病理结果;⑤患者入院2 d 内进行血清肿瘤标志物检测。排除标准:①拒绝行DECT 或造影剂过敏者;②有山莨菪碱(654-2)禁忌或肝、肾功能严重受损者;③术前未行DECT 检查者。本研究经我院伦理委员会审核批准。所有患者检查前均已签署知情同意书。
所有患者均接受平扫及动静脉期DECT 扫描,并在CT 扫描结束1 周内进行手术。根据术后病理结果,将患者分为分化良好组(高分化、中高分化、中分化)及分化不良组(中低分化、低分化)。其中分化不良组86 例,男50 例,女36 例;平均年龄(56.87±10.6)岁。分化良好组23 例,男18 例,女5 例;平均年龄(59.35±8.54)岁。两组患者性别及年龄差异无统计学意义(P>0.05)。
1.2 仪器与方法 采用 Siemens 第三代DECT(Somatom Force CT)进行扫描。患者行CT 检查前禁食6~8 h,排空胃内容物。扫描前10 min,每位患者注射10 mg 山莨菪碱以减小胃肠道张力。扫描前对患者进行呼吸屏气训练,向患者和家属解释检查前后注意事项。所有患者均行平扫及两期增强扫描,增强扫描采用高压注射器经肘静脉团注造影剂碘伏醇(320 mgI/ml),用量2 ml/kg,流速3.5~4.0 ml/s,动脉期采用Bolus tracking扫描,CT 值为100 Hu,静脉期延迟60 s 后进行扫描。静脉期A、B 球管的管电压分别为100 kV、sn150 kV,对应管电流分别为350 mAs 和233 mAs。扫描过程中同时开启实时动态曝光剂量调节(combined application reduced exposure,CARE)Dose 4D,准直器128 mm×0.6 mm,螺距0.7,融合系数0.5,高低两组数据(100 kV、sn150 kV)50%的数据比率,通过后处理计算后融合成125 kV 的混合图像。重建矩阵512×512,球管旋转时间0.25 s/圈,重建层厚、间距均为5 mm,薄层重建层厚及层间距分别为0.75 mm 和0.5 mm 的图像。
1.3 图像分析及影像组学特征参数提取 由1 名放射科住院医师在未知病理结果的情况下将所有图像数据传至西门子后处理工作站(Syngo via)。分别将静脉期1.0 mm 层厚的100 kV 和150 kV 两组双能数据导入Syngo via 工作站,启动Dual-Energy 程序,开启Liver VNC 处理模式得到碘图。通过选择肿瘤组织和同一层面腹主动脉中感兴趣区测量碘浓度(iodine concentration,IC),面积20~30 mm²,避开液化坏死、钙化以及血管等成分。每位患者IC 均为相同大小感兴趣区和相同解剖位置的静脉期重复测量3 次,取平均值;并根据公式(1)计算标准化碘浓度(normalized iodine concentration,NIC)。将CT 静脉期图像导入西门子syngo.via Frontier Radiomics 软件,半自动勾画出病灶体积,提取影像组学特征参数共1672 项。

1.4 血清肿瘤标志物检测 所有患者首次入院2 d 内检测血清肿瘤标志物CA125、CA153、CA19-9、CA242、CA724、癌胚抗原(carcinoembryonic antigen,CEA)、神经元特异性烯醇化酶(neuron-specific enolase,NSE),均采用电化学发光法检测,严格按照仪器和检测说明书操作。
1.5 统计学方法 使用SPSS 20.0、Graphpad prism 8.0 和Python v3.7 软件进行分析。符合正态分布的计量资料以±s表示,组间比较采用独立样本t检验;不符合正态分布的计量资料以M(P25,P75)表示,组间比较采用Wilcoxon 秩和检验。利用受试者工作特征(ROC)曲线下面积确定肿瘤不同分化程度的最佳阈值IC。采用西门子syngo.via Frontier Radiomics软件的特征提取算法提取影像组学特征,并利用Lasso 法进行影像组学特征的降维筛选出有意义的影像组学特征,按1︰1 随机分成训练集和验证集,利用ROC 曲线评价影像组学对不同分化程度胃癌的诊断价值。P<0.05 表示差异有统计学意义。
2 结果
2.1 不同分化程度胃癌血清肿瘤标志物比较 不同分化程度胃癌患者各血清肿瘤标志物差异均无统计学意义(P>0.05,表1)。
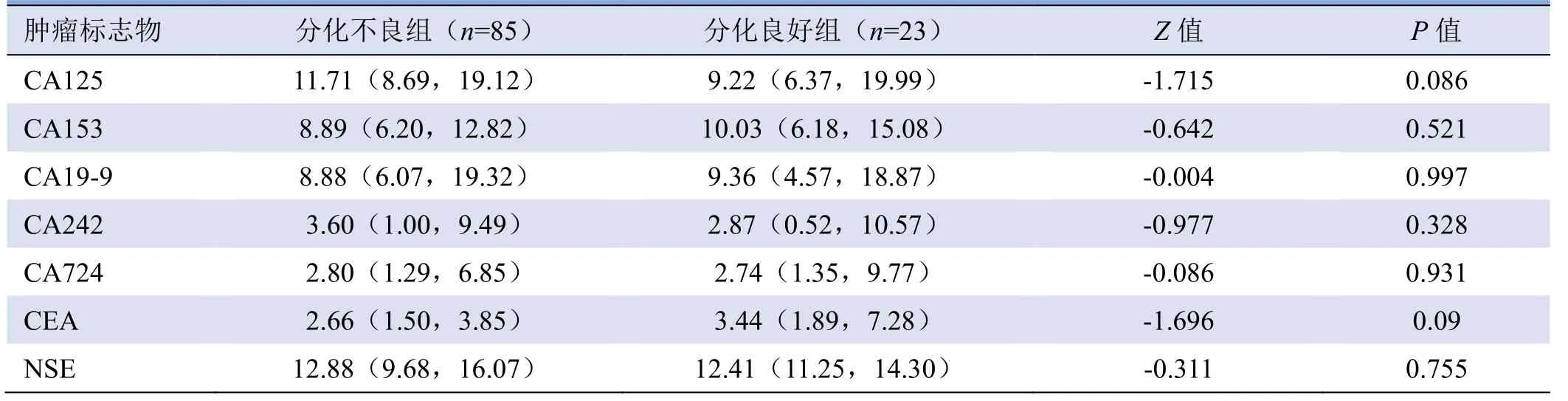
表1 两组不同分化程度胃癌患者血清肿瘤标志物比较[M(P25,P75)]
2.2 碘值对不同分化程度胃癌的诊断效能比较 分化不良组的IC 为(2.88±0.79)mg/ml,显著高于分化良好组的(1.94±0.46)mg/ml,差异有统计学意义(P<0.01);分化不良组的NIC 为(0.60±0.18)mg/ml,显著高于分化良好组的(0.41±0.10)mg/ml,差异有统计学意义(P<0.01)。IC 及NIC 诊断不同分化程度胃癌的AUC 分别为0.861、0.848,诊断阈值分别为2.35 mg/ml、0.46 mg/ml(图1)。两组不同分化程度胃癌碘值差异有统计学意义(P<0.05)。IC 及NIC 诊断不同分化程度胃癌的AUC 值、95%CI、敏感度、特异度见表2。
2.3 影像组学特征对不同分化程度胃癌诊断效能比较半自动提取1672 项特征,并最终分别选出6 项系数非零的影像组学特征(图2、3);静脉期训练集和验证集ROC 曲线显示诊断不同分化程度胃癌的AUC 分别为0.81、0.57,诊断阈值分别为0.38、4.73(图4)。
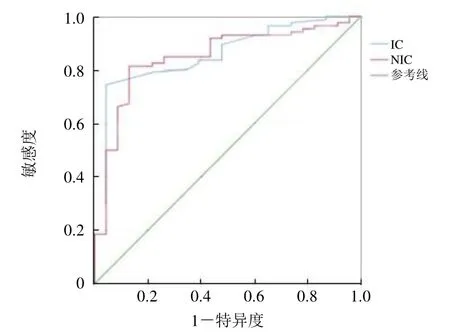
图1 静脉期IC 及NIC 对不同分化程度胃癌的ROC 曲线。IC 为胃癌病灶的碘浓度,NIC 为标准化碘浓度
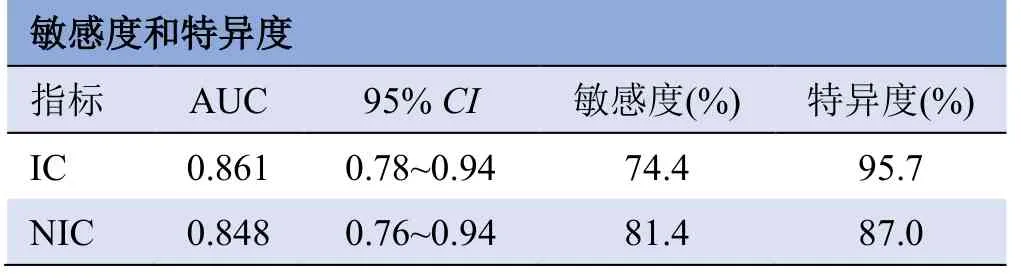
表2 不同分化程度胃癌的IC 及NIC 的AUC、95% CI、
3 讨论
我国胃癌发病率及病死率均高于世界水平[10]。目前胃癌治疗以外科手术为主,术前评估其分化程度可以为治疗方案的制订提供依据[11]。DECT 突破了传统CT 诊断模式的局限性,可提供多种定量参数。DECT根据不同能量下物质衰减方式不同的特性实现物质的分离,可用于区分肿瘤分化程度[11-13],其原因为肿瘤摄取碘的程度与肿瘤血管密切相关。CT 增强扫描的病理基础是组织微血管中碘造影剂的充盈。肿瘤的强化程度与瘤内微血管密度及结构呈正相关,进而可以反映肿瘤的血管生成情况。理论上,不同分化程度的胃癌病灶碘充盈量不同,分化程度越低,碘浓度越高。

图2 通过10 倍交叉验证调节调优参数(C)以实现模型的二项式偏差最小,从而筛选出效能最好的特征集合,左、右虚线分别为平均二项式偏差最小时的logC 及平均二项式偏差最小值1 倍标准误以内的最大logC

图3 采用LASSO 法对影像组学特征进行降维,为特征收敛图,每条曲线代表1个特征的系数变化轨迹
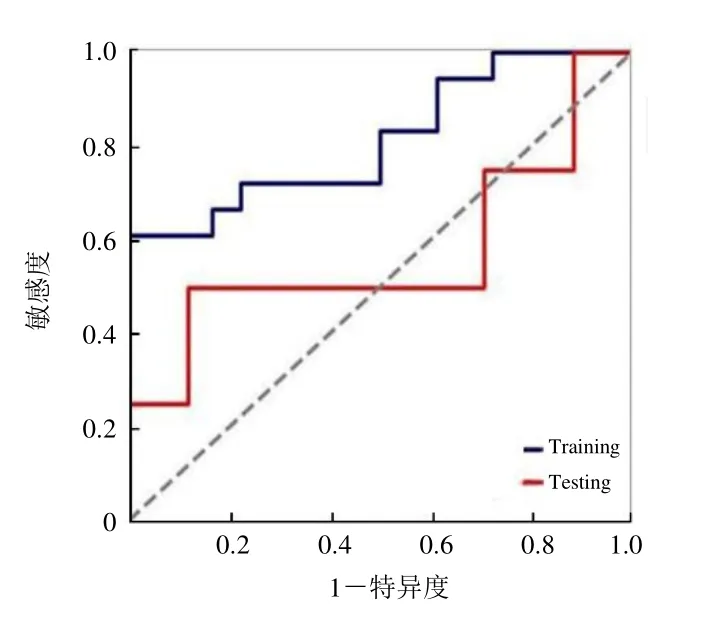
图4 训练集和验证集诊断不同分化程度胃癌的ROC 曲线
本研究结果显示,不同分化程度胃癌组织的IC及NIC 值不同。分化不良组IC 及NIC 值均高于分化良好组,与既往研究结果基本相符[2,14-15]。李佳音等[7]纳入61 例中低分化腺癌进行研究,发现中分化腺癌组双期IC 及NIC 值均低于低分化腺癌组。分化不良组碘浓度升高的原因是肿瘤组织内新生血管较多,血容量增加;其次,肿瘤的侵袭性造成血管内皮细胞不完整,血管通透性增加。前期研究显示静脉期IC 及NIC 值均高于动脉期,可能是由于增强扫描动脉期碘剂进入病灶不充分而静脉期碘剂大量进入病灶,导致静脉期强化程度较高,静脉期的诊断效能也高于动脉期。本研究针对静脉期进行分析。IC 及NIC 值可用于术前判断胃癌病灶的分化程度,其中IC 值的AUC值最大(0.861),鉴别效能最高。此外,本研究比较术前血清肿瘤标志物发现对于诊断不同分化程度胃癌差异均无统计学意义。影像组学特征对诊断不同分化程度胃癌具有一定的价值,且本研究提取及分析整个胃癌病灶的影像组学特征,能够更加全面地反映整个胃癌组织的组织学特性,训练集和验证集不同分化程度胃癌AUC 值分别为0.81、0.57。Ma 等[16]研究发现,放射组学可以准确区分Borrmann Ⅳ型胃癌和胃淋巴瘤,但仅提取了485 项影像组学特征。Jiang 等[17]研究发现,放射学特征是胃癌淋巴结转移的有力预测因子。国外鲜有利用组学特征区分胃癌组织分化程度的报道。吕悦等[18]研究发现,能谱单能量图像的影像组学特征可无创鉴别低分化与中高分化胃腺癌,且效能优于常规能谱参数;但该研究仅提取了277项特征。本研究共提取1672 项特征,从而可更全面地反映胃癌病灶的组织特征。
本研究存在一定的局限性。首先,研究纳入患者数量有限,故需要纳入更多患者进行结果验证;其次,所涉及的纹理特征的类别有待进一步扩大以进行全面和精确的鉴别诊断;此外,研究缺乏外部验证,需收集独立的外部数据集进行结果验证。
总之,DECT 所得IC、NIC 以及影像组学特征在不同分化程度胃癌组织中均存在差异,可以为术前评估其分化程度提供依据。
