大麦多酚抗氧化及抑菌活性的研究
2020-10-22胡新颖陶玉欣李兴国刘盼盼陈俊亮
胡新颖,陶玉欣,李兴国,刘盼盼,陈俊亮,费 鹏
(河南科技大学 食品与生物工程学院,河南 洛阳 471023)
多酚普遍存在于植物当中,由于其具有抗氧化、预防癌症、抑菌等方面的生理功效,备受研究者关注[1]。由于酚羟基在有氧的条件易氧化成醌,降低了环境中氧的含量,并能够清除人体中的自由基,所以大多数植物的多酚类化合物都具有抗氧化活性,这也是多酚类物质具有延缓衰老、降低高血压、降低高血脂、预防癌症和抑菌抗炎功能的原因[2-3]。目前,茶多酚[4]、黑木耳多酚[5]、洋葱多酚[6]、莲子多酚[7]、菱茎多酚[8]等植物多酚的抗氧化、抑菌活性的研究也已被报道。
大麦是世界第四大谷类作物,其营养成分丰富,除了碳水化合物、蛋白质、膳食纤维等,还含有维生素、核黄素和胚芽维。虽然大麦中营养物质丰富,但是随着人们对大麦功能性的重视,如何继续开发大麦的功能性成为目前需要解决的问题。大麦中多酚类化合物含量丰富,因此有足够的证据表明大麦多酚具有较好的抗氧化活性和抑菌能力[10]。
试验以大麦为原料,从中提取多酚类物质,通过考查大麦多酚对羟基自由基(·OH)、超氧阴离子(·) 和1,1 - 二苯基- 2 - 三硝基苯肼(DPPH)的清除能力,评估其抗氧化能力;通过测得大麦多酚对金黄色葡萄球菌、单增李斯特菌、鼠伤寒沙门氏菌、大肠杆菌和克罗诺杆菌的抑菌圈直径、MIC值和MBC 值,评估其抑菌能力,以期扩展大麦多酚的功能性。
1 材料和方法
1.1 试验材料
大麦,购自洛阳大张超市;硫酸亚铁、维C、无水乙醇、水杨酸、双氧水、DPPH、氢氧化钠、磷酸氢二钾,均为分析纯,洛阳昊华化学试剂有限公司提供;溶菌肉汤培养基(LB) 和胰酪胨大豆琼脂培养基(TSA),青岛海博生物有限公司提供。
供试菌株:大肠杆菌(Escherichia coliO157∶H7)、金黄色葡萄球菌(Staphylococcus aureusATCC 13565)、沙门氏菌(Salmonella typhimuriumATCC 14028)、克罗诺杆菌(CronobacterATCC 29544) 和单增李斯特氏菌(Listeria monocytogenesCMCC 54004),东北农业大学提供。
1.2 试验仪器
牛津杯,上海桥星贸易有限公司产品;UV-1100 型分光光度仪,上海美谱达仪器有限公司产品;HH-S2 型水浴锅,金坛市医疗仪器厂产品;CP213 型电子天平,上海奥豪斯仪器有限公司产品;YM30B 型灭菌锅,上海三申医疗器械有限公司产品;KDC-16H 型离心机,科大创新股份有限公司产品;Bcn 1360 型无菌工作台,上海佳胜仪器制造有限公司产品。
1.3 方法
1.3.1 大麦多酚的提取
将大麦碾碎成粉,过80 目筛网,在温度78 ℃,pH 值4.7,料液比1∶30 条件下浸泡提取95 min,抽滤2 次,滤液合并后旋转蒸发,40 ℃下真空浓缩得到大麦多酚浓缩液,最后使用冷冻干燥机干燥成粉末。
1.3.2 抗氧化活性的测定
将大麦多酚粉末配制成质量浓度依次是0.1,0.2,0.3,0.4,0.5 mg/mL 的样品,分别测定其对·OH,·和DPPH·的清除能力,并以维C 做阳性对照。
(1) 大麦多酚对·OH 的清除率。根据吴琳珊[11]的方法,在试管中依次添加9 mmol/L 的FeSO4溶液1 mL,9 mmol/L 的醇溶水杨酸2 mL,去离子水2 mL及8.8 mmol/L 的H2O22 mL,振荡后暗处放30 min,于波长510 nm 处检验吸光度即A0,此时以不加H2O2的体系作为空白溶液。取系列试管,依次加入FeSO4溶液1 mL,乙醇-水杨酸2 mL,样品2 mL 及H2O22 mL,在上述同样的条件下反应后测定吸光度记为A1,同上不加H2O2但加样品测得的吸光度为A2。A1,A2测定时拿蒸馏水作参比。结果测3 次取平均。按下式计算·OH 的清除率:
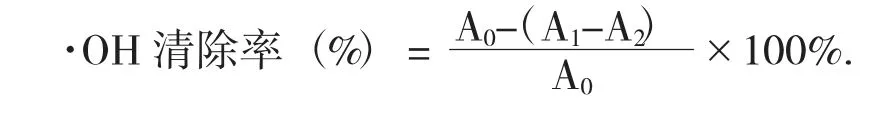
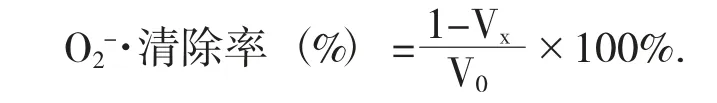
(3) 大麦多酚对DPPH·的清除率。采用DPPH·比色法测定大麦多酚对DPPH·的清除能力[13]。配制0.2 mmol/L 乙醇溶解的DPPH·备用。向样品管按顺序移入2 mL 的样品和醇溶DPPH·;在对照管中依次加入2 mL 的样品溶液和无水乙醇;向空白管按顺序移入2 mL 的醇溶DPPH·和无水乙醇。将3 个管分别振荡,在暗处放置30 min,于波长517 nm 处检验吸光度,依次记为A1,A2,A0。同时用维C 作阳性对照。结果测3 次取平均。按照下式计算DPPH·的清除率:
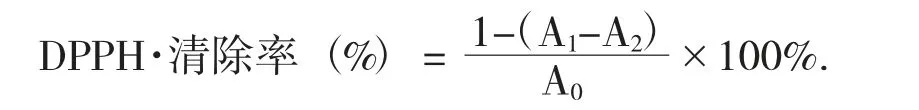
1.3.3 大麦多酚抑菌活性的测定
(1) 抑菌圈直径的测定。调整菌液浓度为107CFU/mL,取100 μL 涂布在TSA 平板上,将牛津杯水平插入TSA 平板中,每个平板放3 个。向每个牛津杯中加入10 mg/mL 的大麦多酚溶液200 μL,于37 ℃下培养24 h,测定抑菌圈的直径,重复3 次,取平均值[14]。
(2) MIC 和MBC 值的测定。将灭菌的TSA 冷却至45 ℃后,放入24 孔板中,再加入大麦多酚使其质量浓度依次为0.312 5,0.625 0,1.250 0,2.500 0,5.000 mg/mL,然后混匀。室温下冷却凝固后接种107CFU/mL的菌悬液2 μL 到每孔中央,于37 ℃条件下培养24 h 观察菌类生长情况,MIC 即为肉眼不见受试菌株生长的大麦多酚的最小浓度。取100 μL 菌悬液在质量浓度为0.625,1.25,2.5,5 mg/mL 的大麦多酚溶液中37 ℃培养24 h 后涂布在TSA 平板上,菌落无法生长的大麦多酚最小浓度即为MBC 值[14]。
2 结果与分析
2.1 大麦多酚抗氧化能力的测定
2.1.1 大麦多酚对·OH 的清除能力
不同质量浓度的大麦多酚对·OH 的清除率见图1。
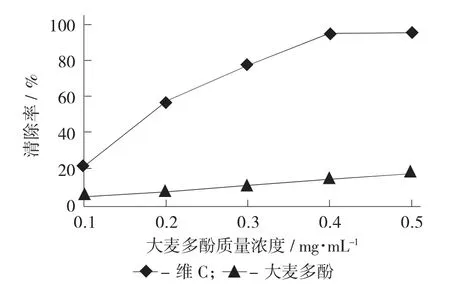
图1 不同质量浓度的大麦多酚对·OH 的清除率
以维C 为阳性对照,测定0.1,0.2,0.3,0.4,0.5 mg/mL 的大麦多酚对·OH 的清除能力,结果如图1 所示。大麦多酚对·OH 的清除能力随着其质量浓度的增加而增加,0.5 mg/mL 的大麦多酚对·OH 的清除能力为18.78%,低于同等质量浓度下维C 对·OH的清除能力,考虑到维C 是强的抗氧化剂,因此大麦多酚对·OH 的清除能力是可以接受的。

图2 不同质量浓度的大麦多酚对·的清除率
2.1.3 大麦多酚对DPPH·的清除能力
不同质量浓度的大麦多酚对DPPH·的清除率见图3。
以维C 为阳性对照,测定0.1,0.2,0.3,0.4,0.5 mg/mL 的大麦多酚对DPPH·的清除能力,结果如图3 所示。大麦多酚对·OH 的清除能力随着其质量浓度的增加而增加,0.5 mg/mL 的大麦多酚对DPPH·的清除能力为82.05,略低于同等质量浓度下维C 对DPPH·的清除能力,因此大麦多酚对DPPH·具有较好的清除能力。
2.2 大麦多酚对食源性致病菌的抑菌作用
大麦多酚对食源性致病菌的抑菌效果见表1。
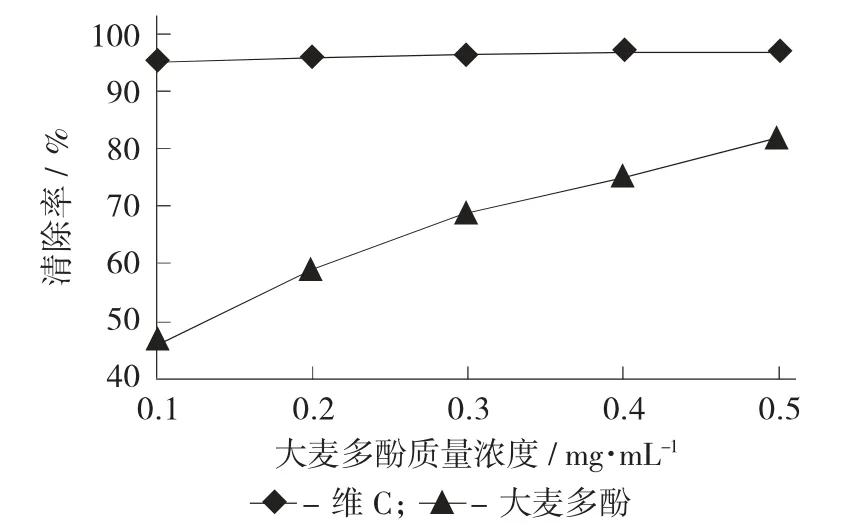
图3 不同质量浓度的大麦多酚对DPPH·的清除率
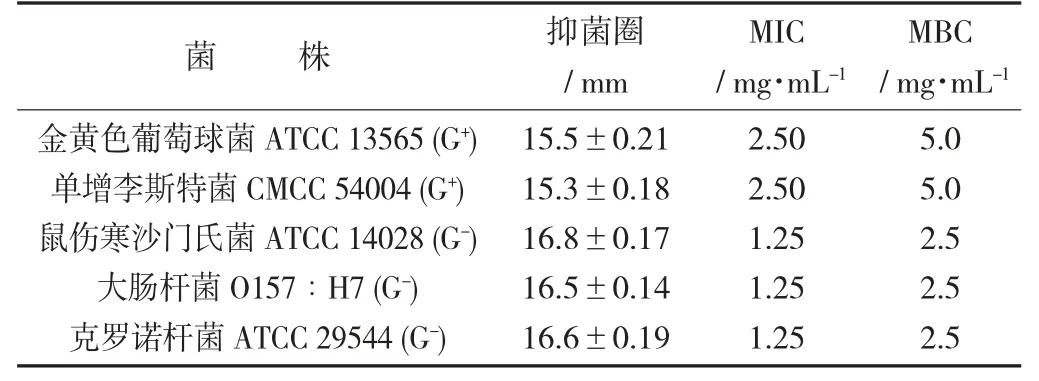
表1 大麦多酚对食源性致病菌的抑菌效果
试验以DIZ,MIC 和MBC 为评价指标,测定大麦多酚对5 种食源性致病菌的抑菌效果。结果表明,大麦多酚对金黄色葡萄球菌ATCC 13565(G+)、单增李斯特菌CMCC 54004(G+)、鼠伤寒沙门氏菌ATCC 14028(G-)、大肠杆菌O157∶H7(G-) 和克罗诺杆菌ATCC 29544(G-) 这5 种受试菌株的抑菌圈直径分别15.5±0.21,15.3±0.18,16.8±0.17,16.5±0.14,16.6±0.19 mm。大麦多酚对金黄色葡萄球菌和单增李斯特菌的MIC 是2.5 mg/mL,MBC是5.0 mg/mL;对鼠伤寒沙门氏菌、大肠杆菌和克罗诺杆菌的MIC 是1.25 mg/mL,MBC 是2.5 mg/mL。
