人脑胶质瘤MGMT和TopoⅡ基因的表达对其化疗敏感性的影响观察
2020-10-21陈颖东宋清宇
陈颖东 宋清宇
广州市第八人民医院(广州 510000)
人脑胶质细胞瘤(简称“脑胶质瘤”)是一种弥漫性中枢神经系统原发性肿瘤疾病,约占颅内肿瘤的45%和颅内恶性肿瘤的80%,此疾病于1938年由国外学者Nevin首次描述并给予命名,WHO将胶质瘤分为星形胶质细胞瘤、少枝胶质细胞瘤、室管膜瘤和胚胎性肿瘤,其中以星形胶质细胞瘤最为常见[1-2]。脑胶质瘤的发生、发展是一个多基因、多阶段、多因素作用的产物,但目前其发病机制尚未完全阐明,以现有的干预手段难以治愈。尽管化疗在临床肿瘤的治疗中占重要地位,其治疗效果却往往不尽如人意。肿瘤细胞对化疗药物耐药是困扰肿瘤治疗的关键性难题,同时也是导致肿瘤化疗失败的常见原因。脑胶质瘤的耐药机制是多种基因共同参与的复杂过程[3]。因此,探索和研究脑胶质瘤组织中相关的耐药基因的表达情况可用于判断肿瘤的恶性程度,同时鉴别临床化疗敏感性,为开展胶质瘤个体化治疗提供理论依据。O6—甲基鸟嘌呤-DNA甲基转移酶(MGMT)、DNA拓扑异构酶Ⅱ(TopoⅡ)分别属于DNA修复酶、细胞核基质酶蛋白,近年来逐渐引起临床医学的关注,已被证实与脑胶质瘤的发生、发展具有一定相关性[4-5]。本研究进一步分析MGMT、TopoⅡ基因的表达情况及其对脑胶质瘤化疗敏感性的影响,以期将为脑胶质瘤的诊断治疗、预后评估提供理论基础。
1 资料与方法
1.1 标本收集
收集医院2012年4月—2018年6月期间进行开颅手术切除的新鲜胶质瘤标本80例,因头晕、头痛、记忆力和视力下降、恶心呕吐、肢体麻木或乏力、间歇性癫痫发作等表现入院,均经细胞学或组织病理学证实,其中男40例,女40例,年龄20~70岁,中位年龄44岁,平均(48.36±9.49)岁,包括星形细胞瘤29例、室管膜瘤24例、少突胶质细胞瘤18例、胶质母细胞瘤9例;根据2007最新(第4版)WHO中枢神经系统肿瘤分级标准[6]对其进行病理分级,包括Ⅱ级27例、Ⅲ级36例、Ⅳ级17例。另外收集同期入院就诊并经颅脑手术治疗的脑外伤或脑出血内减压切除的正常脑组织30例作为对照,其中男15例,女15例,年龄20~70岁,中位年龄45岁,平均(47.22±10.55)岁。两组性别分布、年龄比较无统计学意义(P>0.05),认为可比性充分。以上所有标本均由患者或其家属签署知情同意书,并经过医院伦理委员会审查通过。
1.2 MGMT和TopoⅡ基因的表达检测
1.2.1 免疫组化检测 将胶质瘤标本、正常脑组织标本蜡块连续切片,片厚5.0 μm;将石蜡切片置于60 ℃烤片烘烤120 min,将石蜡切片100%乙醇中3 min,然后按95%、80%、70%梯度水化,来水冲洗;切片置入含抗原修复液(柠檬酸)的高压锅中,加热至沸腾,持续2 min后于室温下自然冷却,完成抗原修复。接下来灭活内源性过氧化物酶,通过室温下避光孵育15 min,PBS洗涤3次(每次30 min),加入鼠抗人MGMT抗体(一抗)50 μL 4 ℃冰箱过夜孵育;PBS液冲洗3次后,二抗室温孵育15 min,PBS洗涤3次(每次 4 min),去除PBS液。配制显色液,混匀后滴至切片,显微镜下观察1~3 min;自来水冲洗5 min,苏木素复染3 min,0.1%盐酸分化5 s,流水冲洗 5 min,PBS返蓝。最后切片经梯度酒精浸泡脱水,二甲苯浸泡透明,待切片干燥后用中性树胶封片,光学显微镜下观察。
1.2.2 结果判定 由我院2位高资历病理医师采用双盲法观察每张切片,随机选取5个高倍显微镜(400×)视野,根据阳性细胞的染色强度和阳性细胞所占百分比两者乘积进行评分。阳性细胞染色强度:0分:无着色;1分:着浅黄色:2分:着棕黄色;3分:着棕褐色。阳性细胞所占百分比:显微镜下观察10个高倍视野(400×)下每个视野计数100个细胞,取10个视野的百分比平均数,0分:阳性细胞<5%;1分:阳性细胞5%~25%;2分:阳性细胞25%~50%;3分:阳性细胞50%~75%;4分:阳性细胞>75%。染色强度评分与阳性细胞所占百分比评分相乘,0分为阴性(-),1~4分为弱阳性(+),5~8分为中度阳性(++),9~12分为强阳性(+++)。
1.3 药敏试验
1.3.1 脑胶质瘤U251、U87细胞培养 U251、U87细胞被培养在DMEM培养基中,此培养基含有10%胎牛血清,不含抗生素,生长环境为5% CO2、37 ℃的细胞培养箱中培养;当细胞生长至80%融合时进行传代。
1.3.2 体外药物干预 脑胶质瘤U251、U87细胞以 2×106/孔接种于96孔板后第2 d加替莫唑胺,先通过出MTT求出加入替莫唑胺作用72 h的IC50;接种6孔板,第2 d加入替莫唑胺至终浓度(略低于IC50浓度),每2 d更换1次加药的培养基,作为实验组,1 d后收取细胞做后续试验,不加药的作为阴性对照组。
1.3.3 Transwell体外侵袭实验 U251、U87细胞体外侵袭力的测定在Transwell小室中进行。4 ℃融解Matrigel每孔50 μL加入预冷的Transwell小室的上室中,将培养板置于37 ℃孵育1 h,少量PBS 清洗各孔。用含1% 牛血清白蛋白(BSA)的无血清培养液调整U251和U87细胞密度为1×106/mL 每孔200 μL加入各孔上室,下室加入含10% FBS的DMEM培养液作为趋化因子。37 ℃、5%CO2孵育24 h后弃去上室液体,取出聚碳酸酯膜,擦净膜上的Matrigel胶及上室未穿膜的细胞,4%多聚甲醛固定30 min,1%结晶紫染色,随机于100倍光镜下取上、下、左、右、中心5个视野,计数穿膜细胞,取其平均数。实验重复3遍。
1.4 统计学方法

2 结 果
2.1 MGMT和TopoⅡ基因表达情况
胶质瘤标本、正常脑组织MGMT和TopoⅡ基因表达程度分布比较均差异有统计学意义(P<0.05),且二者MGMT基因的阳性表达率分别为63.75%、3.33%,TopoⅡ基因的阳性表达率分别55.00%、0.00%,差异有统计学意义(P<0.05)。见表1~2。MGMT在细胞核显示为呈棕黄色颗粒(阳性染色);TopoⅡ在细胞核表现为棕黄色颗粒或弥散分布的阳性显色。见图1~2。

表1 MGMT表达情况

表2 TopoⅡ基因表达情况
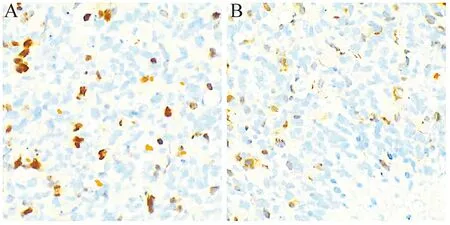
图1 MGMT基因在胶质瘤、正常脑组织中的表达(×200)注:图A、B分别为Ⅲ级胶质瘤(++)、正常脑组织(-)中MGMT基因表达情况

图2 TopoⅡ基因在胶质瘤、正常脑组织中的表达(×200)注:图A、B分别为Ⅲ级胶质瘤(++)、正常脑组织(-)中TopoⅡ基因表达情况
2.2 Transwell体外侵袭实验结果
实验组、阴性对照组替膜唑胺干预前U251、U87细胞穿膜细胞计数比较差异无统计学意义(P>0.05),但干预后实验组U251、U87细胞穿膜细胞计数高于阴性对照组(P<0.05),提示干预后实验组U251、U87细胞有更强的侵袭力。见表3。
表3 替膜唑胺干预前、后U251、U87细胞侵袭力比较
3 讨 论
随着影像学技术的不断发展和相关设备的普及应用,国内脑胶质瘤的检出率不断提高[7]。改善胶质瘤患者预后的主要治疗方法为手术切除,由于脑胶质瘤起源于神经胶质细胞,具有浸润性生长的特性,生长迅速且具有较强的侵袭能力,手术切除相对困难;尽管化疗在临床恶性肿瘤的治疗中占重要地位,但是其治疗效果却往往不尽如人意,如相关研究发现50%以上的恶性脑胶质瘤对常规化疗药卡莫司丁耐药,致使其对恶性胶质瘤的治疗有效率仅为20%左右[8]。目前,肿瘤细胞对化疗药物耐药是困扰脑胶质瘤治疗的关键性难题,而脑胶质瘤的耐药机制是多种基因共同参与的复杂过程。近年来,实验研究已证实脑胶质瘤各种治疗效果及预后的差异是由于肿瘤的异质性造成的,即组织病理学相同的胶质瘤类型其基因水平的改变可能不同,而分子病理学一般通过运用分子生物学技术检测基因水平的差异[9]。
MGMT是一种普遍存在的DNA修复酶,可降低多种化学药物的细胞毒作用。He[10]等的研究表明,MGMT启动子甲基化将获益于替莫唑胺化疗,当无甲基化时替莫唑胺可诱导MGMT修复DNA损伤,从而促成化疗耐药。国内近期报道证实,MGMT是胶质瘤组织耐受烷化剂类抗癌药的主要原因之一,MGMT表达阴性的胶质瘤患者化疗效果明显优于MGMT阳性者[11]。Topo属于细胞核基质酶蛋白,主要包括同工酶TopoI、TopoII,二者在DNA的复制、转录、重组及染色体分离中扮演重要角色[12]。研究发现,TopoII在细胞周期的S 期和G2/M期内表达最高,故其表达水平可能与细胞增殖性存在关联[13]。多数研究认为TopoII在多种肿瘤中存在高表达,且TopoⅡ基因的表达情况与脑胶质瘤的恶性程度具有一定关系[14-15]。本研究采用免疫组织化学法测定MGMT、TopoⅡ基因在脑胶质瘤标本、正常脑组织标本中的表达情况,发现胶质瘤标本、正常脑组织MGMT和TopoⅡ基因表达程度分布差异比较均有显著性,且胶质瘤标本中MGMT、TopoⅡ基因的阳性表达率均显著高于正常脑组织,MGMT、TopoⅡ基因均在细胞核显示为阳性染色。提示MGMT和TopoⅡ基因在人脑胶质瘤标本中阳性表达率高,与刘平[16]等的结果一致,均证实MGMT和TopoⅡ基因与脑胶质瘤的发生发展密切相关。
本研究通过Transwell体外侵袭实验检测加药(替莫唑胺)前后脑胶质瘤细胞系U251和U87细胞的侵袭能力,发现体外药物干预的实验组、未进行药物干预的阴性对照组干预前U251、U87细胞穿膜细胞计数比较无显著性,但干预后实验组U251、U87细胞穿膜细胞计数高于阴性对照组,提示干预后实验组U251、U87细胞有更强的侵袭力,表明MGMT和TopoⅡ基因可能参与促进脑胶质瘤细胞侵袭,进而影响肿瘤化疗敏感性。Holmes[17]等的研究指出,MGMT表达阳性的肿瘤细胞对烷化剂抗癌药耐药性比MGMT表达阴性更强,故在MGMT表达阳性的恶性胶质瘤中下调MGMT表达能够改善替莫唑胺的治疗效果。吕雨虹[18]等的研究则证实了TopoⅡ基因对大鼠C6胶质瘤细胞顺铂化疗敏感性有一定的影响。上述研究分别说明MGMT、TopoⅡ基因与脑胶质瘤治疗过程中的耐药性有关,故推测二者对指导脑胶质瘤的临床意义重大,且国内外已陆续有学者展开研究,如亓旭晨[19]等的研究认为TopoⅡ基因能够催化DNA链的断裂和结合,参与脑胶质瘤耐药性的形成,同时,该研究将针对TopoⅡ设计的siRNA转染进入多药耐药细胞株中,证实其可逆转脑胶质瘤的多药耐药性。蔡晓君[20]等、Stechishin[21]等的研究均发现通过降低MGMT的表达,可增强恶性脑胶质瘤对替莫唑胺的化疗敏感性。因此,我们认为MGMT、TopoⅡ基因可为脑胶质瘤的诊断和预后评估提供新的途径,进而有望成为脑胶质瘤治疗的新靶点。
