大型海藻对石油烃的降解技术研究
2020-10-21郭远明李铁军张玉荣
徐 丹,郭远明,李铁军,张玉荣
(1.浙江海洋大学水产学院,浙江舟山 316022;2.浙江海洋大学海洋与渔业研究所,浙江省海洋水产研究所,浙江舟山 316021)
石油类是成分十分复杂的混合物,含有烷烃、环烷烃、芳香烃等多种难以降解的有害物质[1-2]。当海水被石油污染时,会影响海洋生物的摄食、生长和繁殖,改变鱼类的洄游路线,沾污渔具和渔获物,影响水产品质量,最终危害人体健康[3-5]。随着石油及其产品在开采、炼制、贮运和使用过程中进入海洋,通过各种途径进入海洋的石油类化合物总量不断增加。据统计,从20 世纪70 年代到21 世纪初,全球大约有56.59×104t 石油排入海洋中,我国每年约10×104t 石油直接排入近海[6],大量石油入海导致海洋生物多样性指数降低,海洋生态系统结构失衡,渔业资源的质量和产量下降严重[7-8],1971-2011 年,我国50 t 以上海洋溢油事故共发生81 起,溢油总量为49 667 t,污染物种类主要为燃油、原油和柴油。“十三·五”期间我国石油需求量仍然巨大,沿海石油运输量也将日益增加,海洋溢油风险发生概率逐渐增大。海洋溢油事故发生后,其影响范围和程度往往是巨大的,通常会导致溢油事故发生地周边海域生态环境和渔业资源受到严重破坏,造成巨大的经济损失[9]。因此,开展入海石油污染物的修复治理研究对保护海洋生态环境和促进海洋经济的可持续发展具有重要的意义。
海洋生物修复技术是指利用特定的生物(植物、微生物或其他动物)吸收、转化、清除或降解环境污染物,使环境中的有害污染物通过降解或其他途径得以去除,实现环境净化、生态效应恢复的生物措施。与传统的物理、化学处理方法相比,具有现场修复、不产生二次污染、时间短、经费低、对人体健康和环境影响小等优点[10],在重金属污染、有机物污染、石油污染等几种主要海洋污染中得到广泛的研究和应用。近年来,国内外在微生物和微藻对海洋石油污染的生物修复研究方面取得了较多成果[11-14],但未见大型海藻对石油烃的降解技术研究,本文初步探讨了海带Laminaria japonica、裙带菜Undaria pinnatifida、带形蜈蚣藻Grateloupia turuturu 和孔石莼Ulva lactuca 等4 种大型海藻对石油烃的降解效果及石油烃对大型海藻超氧化物歧化酶(superoxide dismutase,SOD)活性的影响,筛选出对石油污染具有较好去除效果的大型藻类,为利用大型海藻治理海洋石油污染提供技术依据,拓展海洋石油污染治理的思路和方法。
1 材料与方法
1.1 实验材料
带形蜈蚣藻购买于普陀区东河市场,孔石莼采集于舟山海域,海带和裙带菜采集于嵊泗枸杞岛,运回实验室经海水反复清洗去除泥沙及杂质后,置于温度12±1 ℃、盐度27、pH 7.8 水箱中培养,实验室暂养5 d后,选取生长健壮、形态较一致的藻体用于实验。
1.2 石油烃母液
在避光条件下,室温下按照1:9 的体积比将经过过滤灭菌的海水与加油站购买的0#柴油混合,之后经超声震荡器处理6 h,然后将混合液倒入分液漏斗中静置5 h,最后将分离出的石油烃母液于4 ℃避光保存,石油烃母液浓度的测定按照海洋监测规范(GB17378.4-2007)中石油醚萃取荧光分光光度法进行,实验时按设置浓度对母液进行稀释。
1.3 实验方法
实验设置0.8、1.7、2.6、3.6、4.5 mg·L-15 个浓度,以饱和石油烃作为对照组。实验在容积为2 L 的烧杯中进行,每个烧杯实验用水体积为1.6 L,每个烧杯中放入大型海藻10.0 g 左右。每个实验处理组设置3 个重复,实验周期5 d,于实验的第1、2、3、4、5 d 取3 个平行样测定超氧化物歧化酶(SOD),实验结束后取培养水测量石油烃含量和大型藻湿重。
1.4 SOD 的测定
选择新鲜藻体取样0.3 g,经液氮研磨成匀浆状,然后加入提取液5 mL (pH 7.0、50 mmol·L-1H3PO4缓冲液;1% PVP 0.1%;Triton X-100)[15],离心取上清液作为待测溶液。SOD 的测定使用南京建成生物工程研究所试剂盒,采用羟胺法测定SOD 活性。
1.5 数据分析
SOD 测定结果以平均值±标准偏差(Mean±SD)表示,采用SPSS17.0 数据处理软件分析实验数据,石油烃胁迫引起的显著差异用单因素方差分析法(ANOVA) 分析,当显著性水平P<0.05 时为显著性差异,P<0.01 时为极显著差异。
2 结果与分析
2.1 大型海藻湿重变化
大型海藻在不同浓度石油烃中生长湿重变化结果如表1。可以看出,和对照相比,在1.7 mg·L-1浓度以下,海带和裙带菜湿重都有一定程度的增长,叶片健康无腐烂,1.7 mg·L-1以上增长率为负值且逐渐降低,叶片有腐烂现象。全部浓度石油烃中带形蜈蚣藻和孔石莼湿重均低于对照,随着石油烃浓度的升高,湿重降低程度越高,叶片损伤越严重。综上可知,海带和裙带菜在低于1.7 mg·L-1的石油烃中生长良好。
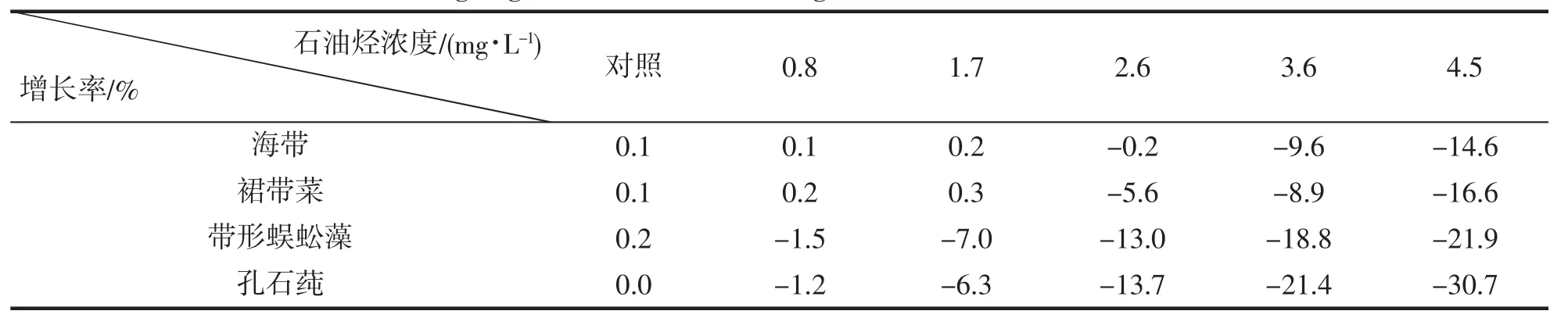
表1 大型海藻在不同浓度石油烃中湿重增长率Tab.1 The wet weight growth rate of macroalgae in WAF with different concentrations
2.2 大型海藻对不同浓度石油烃的降解率
大型海藻对不同浓度石油烃的降解率如表2。可以看出,除2.6 mg·L-1处理组的海带、裙带菜外,海带、裙带菜、带形蜈蚣藻和孔石莼等4 种大型海藻对石油烃的降解率均随浓度的增加而逐渐降低,其中海带和裙带菜对低于1.7 mg·L-1的石油烃具有较好的降解效果,海带对石油烃的降解率为76.3%~81.3%,裙带菜对石油烃的降解率为82.2%~87.5%,海带和裙带菜对石油烃的降解效果远好于带形蜈蚣藻和孔石莼。

表2 大型海藻对不同浓度石油烃的降解率Tab.2 The degradation rate of WAF with different concentrations of macroalgae
2.3 不同浓度石油烃对大型海藻SOD 活性的影响
2.3.1 不同浓度石油烃对海带SOD 活性的影响
海带SOD 的酶活性结果如图1 所示。低浓度(0.8、1.7 mg·L-1)各处理组的SOD 活性在实验前4d 内均极显著高于对照组(P<0.01),至5 d 时0.8 mg·L-1处理组基本恢复至最初水平,1.7 mg·L-1处理组仍极显著高于对照组(P<0.01);中浓度(2.6 mg·L-1)处理组的SOD 活性在实验1 d 时极显著高于对照组(P<0.01),2~5 d 时显著高于对照组(P<0.05);高浓度3.6 mg·L-1处理组的SOD 活性在实验前2 d 内显著高于对照组(P<0.05),3~5 d 时极显著低于对照组(P<0.01)。4.5mg·L-1处理组的SOD 活性在实验前2 d 时与对照差不多,3~5 d时显著低于对照组(P<0.05)。
2.3.2 不同浓度石油烃对裙带菜SOD 活性的影响
裙带菜SOD 的酶活性结果如图2 所示,与不同浓度石油烃对海带SOD 活性的影响相似。低浓度0.8 mg 处理组的SOD 活性在实验前4 d 内均显著高于对照组(P<0.05),低浓度1.7 mg·L-1处理组的SOD 活性在实验前4 d 内均极显著高于对照组(P<0.01),至5 d 时各处理组基本恢复至最初水平;中浓度2.6 mg·L-1处理组的SOD 活性在实验前3 d 时显著高于对照组(P<0.05),4~5 d 时极显著高于对照组(P<0.01);高浓度3.6 mg·L-1处理组的SOD 活性在实验前2 d 时显著高于对照组(P<0.05),3 d 时与对照差不多,4~5 d 时极显著低于对照组(P<0.01)。高浓度4.5 mg·L-1处理组的SOD 活性在实验前3 d时与对照差不多,4~5 d 时极显著低于对照组(P<0.01)。
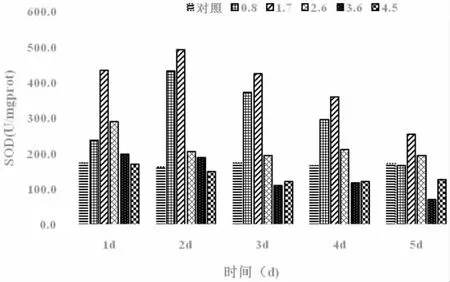
图1 海带在不同浓度石油烃中培养后的SOD(U·mg-1prot)Fig.1 SOD of L.japonica cultivated in WAF with different concentrations
3 讨论
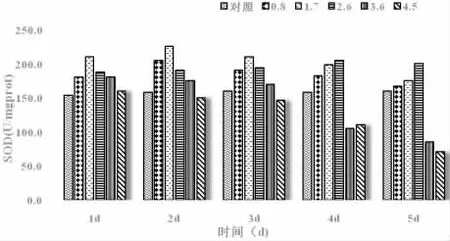
图2 裙带菜在不同浓度石油烃中培养后的SOD(U·mg-1prot)Fig.2 SOD of U.pinnatifida cultivated in WAF with different concentrations
SOD 是生物体内重要的抗氧化酶,广泛分布于微生物、植物、动物等各种生物体内,是生物体内天然存在的超氧自由基清除因子,可对抗与阻断因氧自由基对细胞造成的损害,提高生物体抗氧化能力。在外界环境胁迫下,植物体内氧自由基如超氧化合物阴离子自由基的产量会增加[16]。已有研究成果表明,当藻类受到外界污染胁迫时,会破坏细胞内自由基产生和清除的平衡,导致自由基累积,加剧细胞膜脂过氧化[17]。本文研究结果表明,不同浓度的石油烃胁迫对藻类SOD 活性的影响不同,低浓度(≤1.7 mg·L-1)胁迫下前4 d 对海带、裙带菜的SOD 活性均有明显的促进作用,而随着处理时间的延长,至5d 时SOD 活性基本恢复到对照组水平;中浓度(2.6 mg·L-1)胁迫下对海带、裙带菜的SOD 活性均有明显的促进作用,5 d 时仍显著高于对照组;高浓度(≥3.6 mg·L-1)胁迫下4~5 d 时SOD 活性处于较低水平,显著低于对照组。原因可能是:在低浓度石油烃胁迫下,海带、裙带菜对外来干扰做出应急防御,提高了藻细胞活性氧(ROS)的产生速率,从而快速激发更多的SOD 来清除活性氧,将超氧化物歧化为过氧化氢,随着胁迫时间的增加,细胞内活性氧的产生和清除达到平衡,SOD 活性基本恢复至最初水平。在中浓度石油烃胁迫下,藻细胞内活性氧代谢机制的平衡被打破,导致活性氧在藻细胞内大量累积,显著提高了SOD 活性,对藻体起到一定的保护作用。在高浓度石油烃胁迫下,4~5 d 时海带、裙带菜体内的SOD 活性反而下降,可能因石油烃降解率较低,藻体的SOD 活性下降来避免自身损伤或者生物体已经受到胁迫损伤导致SOD 下降,具体原因还需要进一步研究。
3 结论
(1)海带和裙带菜在低浓度(≤1.7 mg·L-1)的石油烃中生长良好,并且对石油烃具有较好的降解效果,海带对石油烃的降解率为76.3%~81.3%,裙带菜对石油烃的降解率为82.2%~87.5%。
(2)在低浓度(≤1.7 mg·L-1)时石油烃虽然会导致海带和裙带菜体内的SOD 活性升高,但最终会恢复到正常范围,是一种可逆的损伤,高浓度的石油烃会对海带和裙带菜造成不可逆的生物损伤。
(3)海带和裙带菜可作为低浓度(≤1.7 mg·L-1)石油污染的降解生物,具有一定的应用价值。
