土槿乙酸诱导的卵巢癌细胞HO-8910自噬及其机制
2020-10-21王佳贺苑莉莉
王佳贺,王 楠,苑莉莉
0 引言
卵巢癌是妇科常见的恶性肿瘤之一,其发病率仅次于宫颈癌和子宫内膜癌,对女性的生命健康构成了严重的危害[1-3]。近年研究发现,许多中药的有效成分通过调控肿瘤细胞自噬相关蛋白诱导肿瘤细胞自噬[4-7]。因此,探讨中药有效成分诱导肿瘤细胞自噬的分子机制对于卵巢癌的治疗具有重要的临床意义。土槿乙酸 (Pseudolaric acid-B,PAB)是由松科植物金钱松的根皮(土槿皮,又称土荆皮)及近根皮提取的二萜类化合物。PAB通过抑制肿瘤细胞黏附和迁移、促进肿瘤细胞凋亡以及抑制肿瘤血管生成等发挥抗肿瘤作用[8-9]。但关于土槿乙酸能否诱导卵巢癌细胞自噬及相关机制的研究鲜有报道。
因此,本研究在前期实验的基础上,通过体外实验观察土槿乙酸是否能够诱导卵巢癌HO-8910细胞自噬和PI3K/Akt通路相关蛋白的变化,以及自噬特异性抑制剂3-甲基腺嘌呤(3-MA)及自噬激动剂雷帕霉素(RAPA)是否能够影响土槿乙酸所致的卵巢癌HO-8910细胞自噬蛋白的表达,初步探讨土槿乙酸诱导HO-8910细胞自噬及其可能的机制。
1 材料和方法
1.1 主要试剂及仪器 RPMI 1640 培养基、胎牛血清购自Gibco 公司,3-MA 和RAPA为Sigma 公司产品,自噬相关抗体LC3-Ⅱ/LC3-Ⅰ、Beclin-1、β-actin及其他试剂均购于武汉博士德生物工程公司;流式细胞仪购自美国Backman公司;HO-8910 细胞购于中国科学院上海细胞库。
1.2 细胞培养 将HO-8910 细胞置于含10%胎牛血清的RPMI 1640培养基中,在培养箱中孵育(37 ℃,5%CO2),当贴壁细胞生长到90%时,应用0.25%胰酶进行消化,再用0.02%EDTA处理细胞,以备进行细胞实验。
1.3 细胞处理 将细胞置于培养皿中,当贴壁细胞增长到70%~90%时,移除培养液,应用PBS清洗2次,将不同浓度的土槿乙酸(0、2、4、8 μmol/L)加入HO-8910细胞培养液中分别培养0、6、12、24 h。
1.4 台盼蓝染色法测定人卵巢癌细胞株HO-8910的活性 取对数生长期的HO-8910细胞(2×105/孔)接种于6孔板上,加入不同浓度的土槿乙酸(0、2、4、8 μmol/L)继续培养0、6、12、24 h。贴壁细胞经胰酶处理后制成细胞悬液,然后加入0.4%台盼蓝溶液以9∶1混合均匀,3 min内在电子显微镜下计数活细胞和死细胞。
1.5 Western blot检测HO-8910细胞自噬调节蛋白、PI3K/Akt通路相关蛋白及3-MA和RAPA作用后细胞自噬调节蛋白表达的变化 不同浓度土槿乙酸(0、2、4、8 μmol/L)处理HO-8910细胞0、6、12、24 h后分别检测LC3-Ⅱ/LC3-Ⅰ、Beclin-1、Akt、p-Akt、mTOR、p-mTOR等蛋白的表达。将HO-8910细胞分为空白对照组、土槿乙酸组(4 μmol/L)、土槿乙酸(4 μmol/L)联合3-MA(10 mmol/L)组、土槿乙酸(4 μmol/L)联合RAPA(10 μmol/L)组,分别培养24 h后检测LC3-Ⅱ/LC3-Ⅰ、Beclin-1。常规收集各组细胞,洗涤、离心后加入细胞裂解液RIPA 和PMSF,提取细胞总蛋白。BCA 法检测蛋白浓度,逐步进行上样、电泳、转膜、洗膜、封闭,按操作说明加入一抗,4 ℃摇床过夜;洗膜3次;加入二抗溶液,室温摇床2 h;TBST室温洗膜3次。ECL成像系统发光显影。
1.6 统计学分析 采用SPSS 22.0统计学软件对数据进行统计分析,计量资料比较采用t检验。多组间数据比较采用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 土槿乙酸抑制人卵巢癌细胞株HO-8910的活性 应用台盼蓝染色法测定土槿乙酸对人卵巢癌细胞株HO-8910的活性影响。用不同浓度的土槿乙酸(0、2、4、8 μmol/L)作用HO-8910细胞株,作用时间为0、6、12、24 h。结果显示,在作用时间相同时,随着药物浓度的增加,HO-8910细胞的活力下降;相同的药物浓度下,随药物作用时间的延长,HO-8910细胞的活力亦随之下降,且作用24 h后HO-8910细胞的活力下降,差异具有统计学意义(P<0.05)。以上结果提示,土槿乙酸抑制人卵巢癌细胞株HO-8910的活性作用有时间依赖性及浓度依赖性。
2.2 土槿乙酸促进人卵巢癌细胞株HO-8910的自噬 应用Western blot方法检测自噬相关蛋白LC3-Ⅱ/LC3-Ⅰ、Beclin-1等的表达情况。用不同浓度的土槿乙酸分别处理HO-8910细胞不同时间后,用Western blot法检测LC3-Ⅱ/LC3-Ⅰ和Beclin-1。结果显示,随着土槿乙酸药物浓度的增加或时间的延长,细胞中LC3-Ⅱ蛋白的表达水平逐渐增强,LC3-Ⅱ/LC3-Ⅰ比例也逐渐增加,Beclin-1蛋白的表达逐渐升高(图1);应用自噬特异性抑制剂3-MA后,自噬相关蛋白的表达减低,应用自噬激动剂RAPA后,LC3Ⅱ、Beclin-1等蛋白表达增加(图2)。p-Akt、p-mTOR的表达随时间的延长及浓度的增加均逐渐降低(图3)。
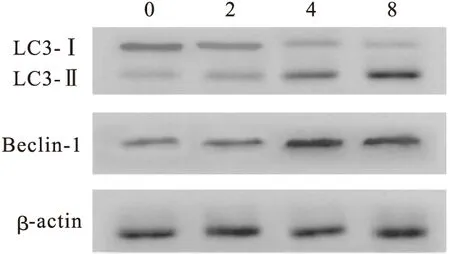
图1 用不同浓度的土槿乙酸(0、2、4、8 mol/L)作用HO-8910细胞24 h后Western blot法检测LC3-Ⅰ、LC3-Ⅱ和Beclin-1的表达
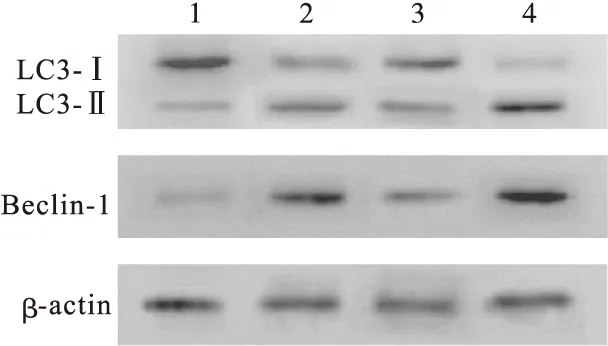
图2 Western blot法检测不同组HO-8910细胞培养24 h后LC3-Ⅰ、LC3-Ⅱ和Beclin-1的表达。

图3 用不同浓度的土槿乙酸(0、2、4、8 mol/L)作用HO-8910细胞24 h后Western blot法检测Akt、p-Akt、mTOR、p-mTOR的表达
3 讨论
卵巢癌为女性生殖系统常见的恶性肿瘤,其发病率逐年升高,严重威胁女性的健康。由于卵巢癌患者在早期往往没有明显的临床症状,又缺乏有效的筛查手段,就诊时多数已处于进展期或已有转移,预后较差。临床上常常采用手术、放疗、化疗、靶向治疗等多种干预手段,但一部分患者因化疗药物耐药而导致治疗效果不佳,影响预后[10-12]。因此,寻找调节和对抗耐药的方法,增加肿瘤细胞对化疗药物的敏感性,是目前卵巢癌治疗研究的热点。
自噬是溶酶体中细胞器和未折叠蛋白分解代谢的生物学过程[13]。在细胞增殖中,自噬是一把双刃剑,它不仅可以通过为细胞提供能量和营养,如细胞内蛋白质或组织的降解来促进细胞增殖,也可诱导自噬细胞死亡或与细胞增殖抑制程序交联[14-15]。自噬是细胞死亡的重要机制,许多抗肿瘤药物均通过提高自噬活性甚至诱导自噬来发挥抗肿瘤作用[16]。细胞自噬可通过多种途径被激活,其调控点包括内质网应激、低氧诱导因子、PI3K、P53、caspase家族、Bcl-2家族等。细胞自噬亦参与肿瘤对化疗药物的反应[17-18]。LC3 是自噬重要的标志物之一。LC3包括LC3-Ⅰ和LC3-Ⅱ 2种存在形式。LC3-Ⅱ通常存在于自噬体的外膜中。联合应用自噬抑制剂3-MA和PAB后,自噬相关蛋白LC3Ⅱ、Beclin-1的表达降低,而自噬的激动剂RAPA与PAB联用后,LC3Ⅱ/LC3Ⅰ及Beclin-1蛋白表达增加。
PI3K/Akt信号通路是一种重要的细胞信号转导通路,在细胞增殖、凋亡和细胞周期中均起着关键的调控作用[19]。PI3K/Akt通路也是自噬调节经典途径,抑制该通路可起到活化自噬的作用。激活的PI3K启动下游激酶Akt的激活[20]。此外,磷酸化Akt还能促进细胞的存活和增殖,调节各种信号传导。研究表明,在胃癌、子宫内膜癌和前列腺癌等各种恶性肿瘤中,Akt的表达和激活过多。Yuan等[21]证实,Akt激酶的过度表达和激活与卵巢癌的恶性生物学行为有密切关系。本研究中,应用不同浓度的土槿乙酸处理HO-8910细胞后,p-Akt、p-mTOR的表达均有所下降,且存在浓度依赖性。这表明土槿乙酸可能通过抑制PI3K/Akt通路来促进HO-8910细胞的自噬。
总之,土槿乙酸可降低HO-8910细胞的存活率,诱导HO-8910细胞自噬,使自噬增加的程度存在药物浓度及作用时间的依赖性。土槿乙酸可抑制PI3K/Akt通路,其抑制作用亦存在药物浓度依赖性。因此,土槿乙酸可通过调节PI3K/Akt通路促进HO-8910细胞的自噬,土槿乙酸有望成为卵巢癌治疗的新型药物,也为中药单体抗肿瘤的研究提供了新的实验依据。
