以头晕起病的迷走锁骨下动脉大动脉炎1例
2020-10-21刘影李东洋宋纺邢英琦
刘影,李东洋,宋纺,邢英琦
1 病例介绍
患者女性,32岁,因“间断头晕、乏力6个月”于2018年10月10日至吉林大学第一医院就诊。于6个月前无明显诱因出现头晕及全身乏力,伴有右上肢隐痛、麻木感及发冷感,右侧无脉搏。2个月前就诊于当地医院,查颈部血管超声示:右侧锁骨下动脉起始处闭塞,右侧椎动脉先天起源异常。病程中出现间断发热,最高达38 ℃,以下午及夜间为著,可自行退热。无头痛、关节疼痛,无脱发、光过敏、雷诺现象。饮食睡眠尚可,二便正常,无明显体重变化。为求进一步诊治于本院就诊,门诊予影像学检查(2018-10-10):①TCD:未见明显异常;②颈部动脉超声:右侧锁骨下动脉起始处闭塞,右侧椎动脉先天起源异常(图1);③颈段CTA:右侧迷走锁骨下动脉,右侧锁骨下动脉近段重度狭窄或闭塞(图2)。门诊医师考虑大动脉炎可能性大,收入风湿免疫科住院。
既往史:既往体健,无药物、食物过敏史,无手术史,预防接种史不详。
入院查体:体温36.6 ℃,脉搏84次/分,呼吸20次/分,左上肢血压140/73 mm Hg,右上肢血压未测到,右侧桡动脉搏动消失,神志清楚,言语流利,无贫血貌,周身无皮疹,双肺呼吸音清,心率84次/分,节律规整,心脏瓣膜听诊未闻及杂音,腹软,无压痛及反跳痛,肝脾肋下未触及。神经系统查体未见异常。
实验室检查:红细胞沉降率76 mm/L;超敏CRP 65.40 mg/L;抗链球菌溶血素O为331.00 IU/mL;血小板379×109/L,血小板比容0.340%,血小板分布宽度8.8%;结核感染T细胞斑点法:阴性;甲功五项、抗核抗体(ANA)、抗中性粒细胞胞浆抗体(ANCA)均未见异常;肿瘤标志物、乙肝两对半、丙型肝炎抗体、抗HIV抗体1+2型、梅毒螺旋体抗体等检测均正常;血钙1.96 mmol/L;国产乙肝DNA定量检测:乙肝病毒定量<50 IU/mL。
腹部大血管彩色多普勒(2018-10-14):腹主动脉、双侧髂动脉、肠系膜上动脉、双侧肾动脉均未见异常。
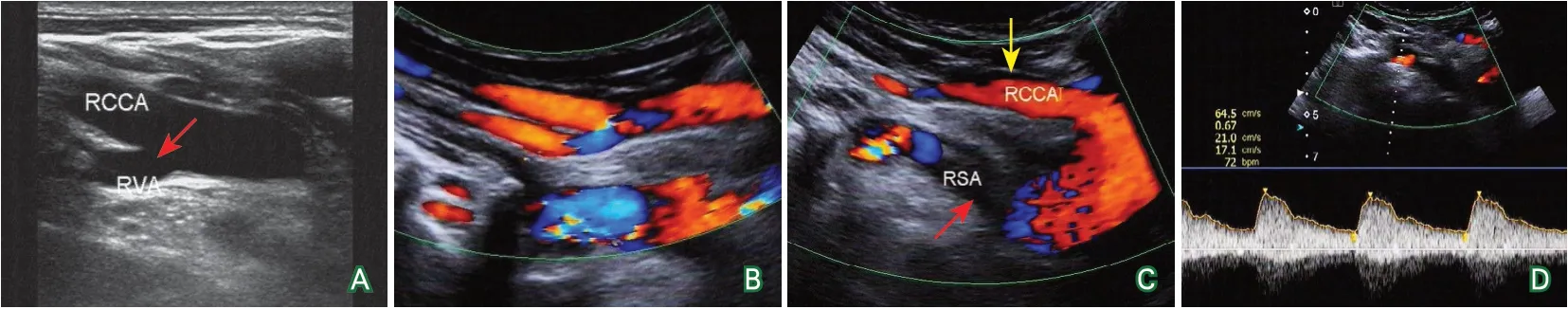
图1 颈动脉超声图像

图3 胸主动脉CTA图像
肺部多排CT平扫(2018-10-15):支气管炎;纵隔淋巴结钙化。
胸主动脉CTA(2018-10-15):主动脉弓及胸主动脉管壁增厚,管壁内缘欠光滑(图3)。
入院诊断:
大动脉炎
诊疗经过:根据其病史、实验室检查结果以及颈段、胸主动脉CTA,符合大动脉炎诊断,且为疾病活动期。住院期间给予改善循环及对症治疗,在肺CT及结核感染T细胞斑点检测回报排除结核后,加用氢化泼尼松30 mg静脉滴注,应用激素3 d后要求出院,出院时患者头晕及右上肢隐痛症状缓解。出院后继续口服用药:①激素联合免疫抑制剂治疗大动脉炎:甲泼尼龙片24 mg,1次/日;吗替麦考酚酯片0.75 g;2次/日;②同时应用其他辅助用药,用于保护肝脏、胃肠道以及避免感染和骨质疏松等不良反应:水飞蓟宾胶囊105 mg,3次/日;泮托拉唑肠溶片40 mg,1次/日;门冬氨酸钾镁0.28 g,2次/日;碳酸钙D3片0.6 g,1次/日;阿法骨化醇软胶囊1 μg,1次/日;制霉菌素片10片+500 mL清水漱口,每次10 mL,3次/日。
随访:用药期间,每周复查血常规、尿常规、肝功、肾功、电解质、空腹血糖、红细胞沉降率、超敏CRP。根据检查结果在本院风湿免疫科门诊调整药物用量,激素逐渐减量。2019年3月22日门诊复查颈动脉彩色多普勒超声较入院时无明显改变,红细胞沉降率18 mm/L,超敏CRP 3.25 mg/L,均恢复正常,患者头晕、乏力消失,右上肢隐痛、麻木感明显缓解。
2 讨论
大动脉炎(Takayasu arteritis)是指主动脉及其主要分支的慢性进行性、非特异性炎性疾病,也可累及肺动脉及其分支。本病多发于年轻女性,30岁以前发病约占90%,40岁以后较少发病,国外资料患病率为2.6/百万人,主要发生在亚洲和中东国家。受累血管的分布,在美国、阿拉伯、非洲和一些亚洲国家,如中国和日本,主动脉弓分支更易累及[1-2],而在印度腹主动脉则易累及[3];且女性多累及弓上分支血管,男性多累及腹部血管[4]。
大动脉炎的发病机制尚不清楚,现有研究表明大动脉炎的发病可能涉及免疫、遗传、感染、性激素等多种因素。大动脉炎临床表现一般分两个阶段:早期和晚期。早期为活跃的炎症反应期,表现如低热、身体不适、体重降低、易疲劳等,晚期以缺血和继发动脉阻塞的症状为特征。临床上根据病变部位将大动脉炎分4型:头臂动脉型、胸-腹主动脉型、广泛型和肺动脉型。血管受累以头臂动脉型和广泛型多见,约80%的患者有两个部位以上的动脉受累。
目前临床诊断大动脉炎主要采用1990年美国风湿病学会(American College of Rheumatology,ACR)的分类诊断标准[5]:①发病年龄≤40岁;②肢体间歇性活动疲劳;③分支动脉搏动减弱;④双上肢收缩压差超过10 mm Hg;⑤锁骨下动脉或主动脉杂音;⑥动脉造影异常,此标准中至少有三个标准的敏感性为90.5%,特异性为97.8%。大动脉炎的鉴别诊断包括先天性疾病(如主动脉缩窄、马方综合征和肌纤维发育不良)、其他原发性血管炎和继发性血管炎(包括感染性和自身免疫性)。对于大动脉炎疾病活动性的评估是临床医师面临的挑战之一,目前仍没有检验的金标准[6],而红细胞沉降率、超敏CRP是反映本疾病活动的两项重要的临床常用的血清学指标。另外,一些学者提出大动脉炎患者中存在结核分枝杆菌感染,认为二者之间有相关性[7],我国的资料显示20%~40%的大动脉炎患者有结核感染史。2011年Giordana等[8]首次报道将超声造影应用于大动脉炎的评估,之后有学者提出大动脉炎受累动脉管壁增厚部分造影剂增强可作为评价大动脉炎活动性的标志[9]。
大动脉炎诊断的金标准曾经是DSA,现在临床上几乎被CTA或MRA取代[10]。CTA可清楚地显示出主动脉、主动脉分支受累位置、范围,以及管壁和管腔变化,区分大动脉炎与动脉粥样硬化,能准确评估迷走锁骨下动脉。18F-脱氧葡萄糖(FDG)PET/CT是一种新型诊断工具,可以在发生结构改变之前显示血管炎症[11]。彩色多普勒超声检查可探查主动脉弓及其主要分支狭窄或闭塞,大动脉炎早期超声表现为受累节段动脉内中膜弥漫性、均匀增厚,中-晚期则表现为内中膜增厚明显,长轴切面呈“被褥”征改变,横切面呈均匀环状增厚(“靶环”征)[12],出现多血管狭窄或闭塞。超声检测中见以上典型图像,不难诊断大动脉炎。
本例患者根据其病史、实验室及影像学检查结果临床确诊大动脉炎并且处于活动期。患者主动脉弓、胸主动脉管壁增厚,右侧锁骨下动脉近段闭塞,属于大动脉炎临床分型中的广泛型,而且闭塞的右侧锁骨下动脉,为迷走右侧锁骨下动脉,即发出于主动脉弓与降主动脉移行处,是少见的先天性主动脉弓变异类型,其发病率为0.5%~2.0%[13]。超声检测中,由于患者受累的是主动脉弓上单支血管,单从闭塞的锁骨下动脉超声图像很难诊断为大动脉炎;另外,锁骨下动脉闭塞侧的椎动脉因其起源于同侧颈总动脉而不存在盗血,这给诊断锁骨下动脉近段闭塞带来了困难,这就要求超声扫查时,要尽可能探测到锁骨下动脉近段全程,并注意椎动脉是否存在走行变异、起源异常,以及其血流速度和频谱形态;而且对于锁骨下动脉迷走,超声扫查要特别注意同侧颈总动脉的走行和起源,其颈总动脉往往是起源于主动脉弓。大动脉炎临床中只累及主动脉弓上单支血管病变较少见,而合并有迷走右侧锁骨下动脉的大动脉炎病例更是罕见,患者先存在右侧锁骨下动脉发育变异,之后罹患大动脉炎,二者并无明确的因果关系。另外,患者右侧椎动脉起源于同侧颈总动脉,右侧迷走锁骨下动脉近段闭塞对同侧椎动脉供血无影响,经过药物治疗头晕症状消失,考虑其间断头晕症状与全身炎症反应相关。
本病约20%为自限性,在发现时疾病已稳定,这类患者如无并发症可随访观察。大动脉炎的合理治疗是通过适当的全身免疫抑制剂抑制血管炎症和全身炎症,包括皮质类固醇和常规免疫抑制药物。在难治性大动脉炎活动的情况下,可应用生物制剂,如肿瘤坏死因子抑制剂和托珠单抗[14]。大动脉炎治疗耐药和疾病复发往往出现在低剂量激素治疗晚期,他汀类药物有助于降低病情缓解后的复发率[15]。本例患者自诊断经过药物治疗5个月余,病情控制良好未复发。
大动脉炎早期诊断比较困难,血管超声是首选筛查手段,但对于不典型超声表现的患者,要结合其病史,实验室检查及其他影像学信息综合判断,及早明确诊断,有助于确定个体化的治疗方案,及早将大动脉炎可能引起损伤的风险降到最低。

点评专家:刘禧 副主任医师
E-mail:liuxi916@126.com
工作单位:空军军医大学空军特色医学中心
主要研究方向:心脑血管疾病、肌骨、重症超声诊断
出诊时间:周一至周五上午
专家点评:
大动脉炎是中国及其他亚洲国家青年女性好发于大中血管的慢性肉芽肿性炎症性疾病,病变多见于主动脉弓及其分支,临床超声检查中见到受累动脉内中膜广泛均匀增厚的“通心粉”征等特征性图像时不难诊断,病变常呈节段性。本例独特之处在于所累及的是单支迷走锁骨下动脉,且近段管腔闭塞,给探查和诊断带来难度,单从超声图像很难诊断大动脉炎,需通过结合其他实验室指标最终确诊。对于锁骨下动脉迷走,扫查过程中要重点关注椎动脉的起源和走行,本例中右侧椎动脉即起源于同侧颈总动脉,因起源的变异,不出现锁骨下动脉盗血,也在一定程度上掩盖了右侧锁骨下动脉起始段病变。此外,锁骨下动脉迷走时还需关注颈总动脉的走行和位置、血管与气管的相对位置。该病例还提示,对于不典型超声表现的患者,要结合性别、年龄、病史、实验室检查等多方面因素综合考虑,避免漏诊、误诊。
