肾叶打碗花抗氧化活性及抑制酪氨酸酶研究
2020-10-21尚金燕李桂荣邵明辉邹小丽李庆亮
尚金燕,李桂荣,邵明辉,邹小丽,李庆亮
(山东药品食品职业学院·山东威海·264210)
肾叶打碗花Calystegia soldanella(Linn.)R.Br.又称为扶子苗、孝扇草、滨旋花、肾叶天剑。分布在山东、辽宁、河北、浙江、江苏、台湾等沿海地区[1],是一种多年生的匍匐性草本植物,生长在海滨沙地上,或者海岸的岩石缝中。
肾叶打碗花作为药用已有悠久的历史,《本草纲目》记载该植物,花:甘;根:辛、温、无毒;全草:甘滑微苦、能利雄黄;“花能去面皮干黑色,媚好益气;根可去腹中寒热邪气,利小便”[2]。
已有的研究表明,肾叶打碗花中总黄酮含量较高[3],而黄酮类化合物与抗氧化活性密切相关[4]。当然,是否还有其他具有抗氧化活性的天然产物,还需要进行下一步的研究。为了充分开发利用该植物资源,本研究以乙醇作为有机溶剂,研究了其乙醇提取物的抗氧化活性和抑制酪氨酸酶的活性。
1 材料与设备
1.1 材料
本研究所用肾叶打碗花,采自山东威海荣成成山林场,用烘箱50℃烘干,用粉碎机将全草粉碎,过60目筛得粉末。
1.2 试剂
DPPH、L-酪氨酸、酪氨酸酶,Sigma公司;三羟甲基氨基甲烷(Tris)、邻苯三酚、水杨酸、HCl、H2O2、乙醇、均为分析纯。
1.3 仪器与设备
紫外分光光度计T6型 (北京普析通用仪器有限责任公司);酶标仪ER-504(山东博科科学仪器有限公司);十万分之一电子天平ME55(梅特勒);IKA RV10 Basic旋转蒸发仪RE-301(上海科兴仪器有限公司)。
2 实验方法与结果
2.1 有效成分提取
准确称量5.010g肾叶打碗花粉末,加入50%的乙醇100mL,室温浸泡24h,然后80℃回流提取浸泡液3h,冷却过滤,收取滤液;残渣中再次加入500mL体积分数50%的乙醇,在80℃下继续回流提取3h,冷却过滤,收取滤液,将两次滤液合并,置于旋转蒸发仪上,50℃温度下浓缩,得到肾叶打碗花膏状提取物。
2.2 抗氧化活性实验
2.2.1 DPPH·清除能力实验
参照文献方法[5~7]测定肾叶打碗花提取物DPPH·清除能力。准确称取避光冷藏保存的DPPH 30.90 mg,加入无水乙醇溶解于250 mL棕色容量瓶中,避光保存,备用。
用乙醇稀释肾叶打碗花提取物,分别稀释成质量浓度为 0.5、1.0、3.0、5.0、10.0mg.mL-1, 分别取不同质量浓度的提取物1mL、0.2mmol.L-1DPPH乙醇溶液1.5mL于试管中,混合摇匀后,立刻放置于暗室中,反应1h。使用无水乙醇调零,测定波长517nm处的吸光值为Abs样本。重复操作,将样本用无水乙醇替换,测定吸光值为Abs空白。测定不同浓度提取物对DPPH·的清除率,绘制清除率对提取液浓度曲线,根据线性方程计算清除率为50%时的浓度值,即得到IC50。
DPPH·清除率计算如下:
DPPH·清除率(%)=(1-Abs样本/Abs空白)×100
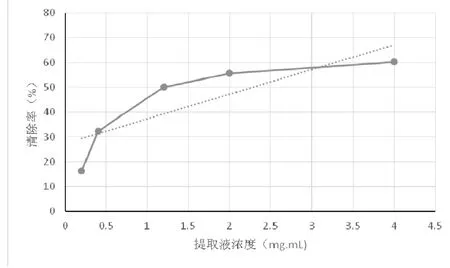
图1 肾叶打碗花提取物对DPPH·的清除效果
由图1可以看出,随着提取液浓度的增加,DPPH·清除率逐渐升高,在最大样品浓度下,清除率达到60.24%,肾叶打碗花乙醇提取物清除DPPH·的IC50约为2.885mg.mL-1。结果表明,肾叶打碗花乙醇提取物对DPPH·有一定的清除效果,乙醇提取物具有一定的抗氧化性。
2.1.2 ·OH清除能力实验[8]
H2O2与Fe2+反应产生·OH,在反应体系中加入水杨酸后,·OH与水杨酸反应,生成有色物质,在波长510nm处该物质有最大吸收。如果向反应体系中加入具有清除羟自由基功能的被测物,就会减少生成的自由基,从而使有色物质的生成量减少。体系中先加入FeSO4(9mmol.L-1) 1mL、水杨酸-乙醇溶液(9mmol.L-1)1mL,不同提取浓度样品溶液1mL。 最后加H2O2(8.8mmol.L-1)1 mL 启动反应,37℃下反应 0.5h。以蒸馏水作为对照,测定510nm处各样品溶液的吸光值。考虑样品本身存在的吸光值,以FeSO4(9 mmol.L-1)1mL、水杨酸-乙醇溶液(9mmol.L-1)1mL、不同浓度样品溶液1mL和1mL蒸馏水作为样品的本底吸收值。按以下公式计算样品·OH清除率。
·OH 清除率(%)=[A0-(Ax-Ax0)]/A0×100
其中:A0—空白对照溶液的吸光值;Ax—样品溶液的吸光值;Ax0—不加H2O2样品溶液的吸光值。
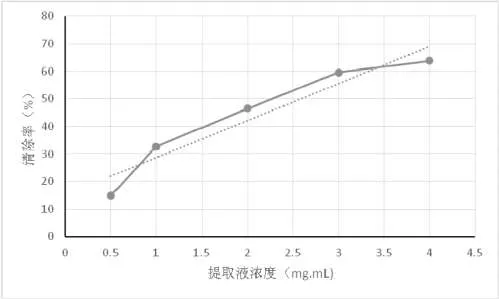
图2 肾叶打碗花提取物对·OH的清除效果
由图2可以看出,肾叶打碗花提取物对·OH的清除作用随着浓度的增加而增强,表明肾叶打碗花乙醇提取物具有较好的清除·OH的作用。
2.1.3 O2-·清除能力实验
清除O2-·的实验参照文献进行[9],实验利用邻苯三酚来测定。取4.5 mL 50 mmol.L-1Tris-HCl(pH8.2)缓冲液,放置于25℃的水浴中,保温作用20min,加入1mL样品溶液、0.4mL 25mmol.L-1邻苯三酚溶液,混合均匀,然后放置于25℃水浴中,反应5min,最后加入1mL 8mmoll.L-1HCl终止反应,测定299nm处吸光度(Ax)。空白对照组(A0)以同样体积的蒸馏水来替换样品。每个样品重复3次,测量后取平均值,根据以下公式来计算O2-·的清除率。
O2-·清除率(%)=(A0-Ax)/A0×100

图3 肾叶打碗花提取物对O2-·的清除效果
如图3所示,在邻苯三酚自氧化体系中,随着提取液浓度的增加,抑制自氧化的能力也增强,很好的起到了清除超氧阴离子的作用。
2.2 抑制酪氨酸酶活性实验[10]
精确称取肾叶打碗花乙醇提取物,以PBS缓冲溶液作为溶剂, 配制成浓度依次为 2、6、10、12、20mg.mL-1的样品溶液。在96孔板中分别添加以下物质:不同稀释浓度样品溶液50μL、PBS缓冲液80μL、酪氨酸酶溶液 50μL,分别设置 3个复孔,37℃下作用10min,然后向每个加样孔中加入20μL底物,孵育30min,最后用酶标仪来测定475nm处的吸光值,每个样品重复测量3次。记录吸光值。酪氨酸酶抑制率的计算公式如下:
抑制率 =[(A-B)-(C-D)]/(A-B)×100%,
公式中,A是空白对照组(PBS 130μL+酶 50μL+底物 20μL);B 是空白背景组 (PBS 180μL+底物20μL);C 是不同浓度样品组(PBS 80μL+酶 50μL+样品溶液 50μL+底物 20μL);D 是实验背景组(PBS 130μL+供试品溶液 50μL+底物 20μL)。

表1 不同浓度提取物对酪氨酸酶的抑制率
如表1所示,肾叶打碗花乙醇提取物对酪氨酸酶催化活性具有明显的抑制作用,而且随着浓度的升高而增强,IC50值为2.95 mg/mL。
3 结论
为了分析肾叶打碗花的抗氧化活性,本研究用乙醇作为溶剂,提取了肾叶打碗花提取物,对其清除DPPH·、·OH、O2-·的能力和抑制酪氨酸酶活性进行了测定。实验结果表明,肾叶打碗花乙醇提取物对各种自由基均具有一定的清除能力,并能抑制酪氨酸酶的活性。
肾叶打碗花可以入药,已有研究者提取了该药材的有效成分进行了分析探讨。Motoo Tori从孝扇草的茎中分离出反式-4-羟基桂皮酸酯、反式-4-羟基桂皮酸和反式-3,4-二羟基桂皮酸[11]。黄真等发现该药材的水提液具有较强的抗炎镇痛作用[12]。但目前关于肾叶打碗花抗氧化活性方面尚未有研究。本研究以乙醇作为有机溶剂,提取了其有效成分,研究其抗氧化活性,后期将进一步研究该植物的抗氧化活性,研究其他不同溶剂提取物的抗氧化作用,并通过实验研究,跟踪分离提取活性有效成分,为开发该药材抗氧化药物和抗氧化制剂奠定基础。
