南、北五味子药材的HPLC指纹图谱建立及化学模式识别分析
2020-10-20郭丽杨忠杰于晓涛贾陆金少举王瑞
郭丽 杨忠杰 于晓涛 贾陆 金少举 王瑞


摘 要 目的:建立南、北五味子藥材的高效液相色谱(HPLC)指纹图谱,并进行化学模式识别分析。方法:采用HPLC法,以五味子甲素为参照,绘制南、北五味子各10批样品(编号分别为N1~ N10、S1~ S10)的HPLC指纹图谱;采用《中药色谱指纹图谱相似度评价系统(2012版)》进行相似度评价,确定共有峰;采用SPSS 20.0和SIMCA 14.1软件进行聚类分析(HCA)、无监督模式主成分分析(PCA)、有监督模式正交偏最小二乘法-判别分析(OPLS-DA);以变量重要性投影值(VIP)大于1为标准,筛选影响南、北五味子质量的差异标志物。结果:南、北五味子分别指认出32、33个共有峰;10批南五味子和10批北五味子的相似度均大于0.9,南、北五味子的相似度为0.50;南、北五味子共有19个共有特征峰,共指认出其中的5个,即五味子醇甲、五味子醇乙、五味子酯甲、五味子甲素、五味子乙素。HCA结果显示,N1~N10聚为一类,S1~S10聚为一类,其中N1、N3、N8、N9聚为一类,其余聚为一类;S1、S3、S6、S9聚为一类,其余聚为一类。无监督模式PCA结果显示,前2个主成分因子的累积方差贡献率为87.19%。有监督模式OPLS-DA结果显示,五味子甲素、五味子醇甲、五味子酯甲、五味子乙素为影响南、北五味子药材质量的差异标志物(VIP值分别为2.29、2.24、1.73、1.48)。结论:本研究所建立南、北五味子HPLC指纹图谱准确、科学、简便易行,结合多元统计分析可用于评价南、北五味子药材的质量。南、北五味子成分有所不同,五味子甲素等为差异标志物。
关键词 南五味子;北五味子;高效液相色谱法;指纹图谱;聚类分析;主成分分析;正交偏最小二乘法-判别分析;差异标志物
中图分类号 R284.1 文献标志码 A 文章编号 1001-0408(2020)18-2224-06
DOI 10.6039/j.issn.1001-0408.2020.18.09
ABSTRACT OBJECTIVE: To establish HPLC fingerprint of Schisandra sphenanthera and S. chinensis, and to analyze chemical pattern recognition. METHODS: HPLC method was adopted. Using schizandrin A as reference, HPLC fingerprints of 10 batches of S. sphenanthera and S. chinensis (N1-N10, S1-S10) were drawn. Similarity Evaluation System of TCM Chromatographic Fingerprint (2012 edition) was adopted for similarity evaluation to determine the common peaks. SPSS 20.0 and SIMCA 14.1 software were used for HCA, unsupervised madel of PCA, supervised model of OPLS-DA. Using variable importance projection (VIP) value greater than 1 as the standard, the differential markers that affected the quality of S. sphenanthera and S. chinensis were screened. RESULTS: S. sphenanthera and S. chinensis were identified 32 and 33 common peaks, respectively. The similarity of 10 batches of S. sphenanthera and 10 batches of S. chinensis were all higher than 0.9, and the similarity of S. sphenanthera and S. chinensis was 0.05. A total of 19 characteristics peaks were identified, among which five common peaks were identified as schisandraol A, schisandraol B, schisantherin A, schizandrin A and schisandrin B by reference. HCA results showed that N1-N10 were clustered into one category, and S1-S10 were clustered into one category, of which N1, N3, N8, and N9 were clustered into one category, and the rest were clustered into one category; S1, S3, S6, and S9 were grouped together, and the rest were grouped together. The results unsupervised model of PCA showed that the cumulative variance contribution rate of the first two principal component factors was 87.20%. Supervised model of OPLS-DA showed that schizandrin A, schisandraol A, schisantherin A and schisandrin B were the differential markers that affected the quality of S. sphenanthera and S. chinensis(VIPs were 2.29, 2.24,1.73,1.48, respectively). CONCLUSIONS: The established fingerprint is accurate, scientific, simple and easy to use, combined with multivariate statistical analysis can be used to evaluate the quality of S. sphenantherae and S. chinensis. The components of S. sphenanthera and S. chinensis were different, schisanolrin A is differential marker.
KEYWORDS Schisandra sphenanthera; Schisandra chinensis; HPLC; Fingerprint; HCA; PCA; OPLS-DA; Differential markers
五味子为木兰科植物五味子[Schisandra chinesis (Turcz.) Baill.]的干燥成熟果实,习称“北五味子”;南五味子为木兰科植物华中五味子(S. sphenanthera Rehd. et Wils.)的干燥成熟果实。两者在2015年版《中国药典》(一部)中均有记载,其质量标准虽有不同,但性味、归经、功能主治的表述却完全相同[1]。历代本草典籍中,有关两种五味子的产地、名称、功效等记载不一,如《本草图经》中记载,“五味子,生齐山山谷及代郡,今河东、陕西州郡尤多,而杭越间亦有”[2]。根据其产地查阅《中药材产销》[3]可推断,此处“齐山山谷及代郡”为北五味子产区,“河东、陕西州郡、杭越”为南五味子产区,由此可见两种五味子在产区分布上存在差异。《本草蒙筌》中记载,“南北各有所长,藏留切勿相混,风寒咳嗽南五味为奇,虚损劳伤北五味最妙”[4];《本草纲目》中记载,“五味,今有南北之分,南产者,色红;北产者,色黑,入滋补药必用北产者乃良”[5]。由此可知,南、北五味子在功效、名称、性状等方面的记载也不尽相同,其中北五味子质量较优。
随着现代研究的深入,南、北五味子药材间的鉴别技术不断优化,除常见的性状、显微、薄层色谱鉴别等外[6-8],还有DNA条形码技术等鉴定手段[9]。由于南、北五味子药材产地较多,在现代临床应用中普遍存在混用的现象[10];加之学者对两者的认知存在一些偏差,故常将南五味子视为五味子的伪品[11]。因此,如何正确区分南、北五味子,并对其进行准确鉴别并发掘不同功效的物质基础对确保临床疗效具有重要的意义。
南、北五味子的化学成分有所不同,李昕等[12]采用气质联用法(GC-MS)对南、北五味子挥发油化学成分进行鉴定,结果发现北五味子中的依兰烯含量高于南五味子;李晓亮等[13]建立了南、北五味子醇提物的高效液相色谱(HPLC)指纹图谱,并发现南五味子中五味子酯甲、五味子甲素的含量相对较高,而北五味子中五味子醇甲的含量相对较高,但未深入挖掘两种五味子指纹图谱中涵盖的化学信息,也未筛选出导致南、北五味子差异的标志性成分。
中药化学成分的复杂性和多样性是其发挥疗效的基础,亦是评价药材质量的难点和重点[14]。指纹图谱可完整、系统地表征药材样品中主要化学成分的相似性特征[15];化学模式识别可鉴别药材样品间的差异,以综合评估中药质量[16-17]。基于此,本研究分别建立了南、北五味子药材的HPLC指纹图谱,并结合相似度评价、聚类分析(HCA)、无监督模式主成分分析(PCA)、有监督模式正交偏最小二乘法-判别分析(OPLS-DA)筛选影响南、北五味子药材质量的差异标志物,以期为其质量控制及药效研究提供参考。
1 材料
1.1 仪器
LC 20AD型HPLC仪(包括二元泵、可制冷自动进样器、二极管阵列检测器、柱温箱、Labsulotions Version 5.87色谱工作站)、AUW-120D型十万分之一电子天平均购自日本Shimadzu公司;1260型HPLC仪(包括四元泵、紫外检测器、柱温箱、自动进样器、Open LABA.01.05色谱工作站)购自美国Agilent公司;DHG-9070 型电热鼓风干燥箱(上海一恒科学仪器有限公司);SB25-12D型超声波清洗机(宁波新芝生物科技股份有限公司);5810R型高速离心机(德国Eppendorf公司);Milli-Q超纯水机(美国Millipore公司);FW-80型微型高速万能试样粉碎机(天津市静海县工兴电器厂)。
1.2 药品与试剂
五味子醇甲对照品(批号:MUST-19031905,纯度:99.46%)、五味子醇乙对照品(批号:MUST-19042307,纯度:99.88%)、五味子酯甲对照品(批号:MUST- 19062302,纯度:99.38%)、五味子甲素对照品(批号:MUST-19092908,纯度:99.35%)均购自成都曼斯特生物科技有限公司;五味子乙素对照品(中国食品药品检定研究院,批号:110765-201512,纯度:99.00%);乙腈为色谱纯,甲醇为分析纯,水为超纯水。
南、北五味子药材各10批(编号分别为N1~N10、S1~ S10),分别购自全国部分连锁药店、医药公司及药材市场,经郑州大学药学院贾陆教授鉴定为木兰科植物五味子[S. chinensis (Turcz.) Baill.]的干燥成熟果实、木兰科植物华中五味子(S. sphenanthera Rehd. et Wils.)的干燥成熟果实。药材样品信息来源见表1。
2 方法与结果
2.1 南、北五味子HPLC指纹图谱的建立
2.1.1 色谱条件 色谱柱:Aglient Zobax SB C18(250 mm×4.6 mm,5 ?m);流動相:乙腈(A)-水(B),梯度洗脱(0~5 min,51%A;5~20 min,51%A→60%A;20~35 min,60%A;35~40 min,60%A→85%A;40~45 min,85%A;45~48 min,85%A→51%A);流速:0.8 mL/min;检测波长:220 nm;柱温:30 ℃;进样量:5 ?L。
2.1.2 供试品溶液的制备 称取南、北五味子药材,粉碎,过三号筛。精密称定上述粉末各1.00 g,分别置于50 mL具塞锥形瓶中,精密加入甲醇20 mL,称定质量,超声(功率:250 W,频率:20 kHz)提取20 min,放冷,再次称定质量,用甲醇补足减失的质量,摇匀,以12 000 r/min离心10 min,取上清液[14],即得。
2.1.3 混合对照品溶液的制备 精密称取五味子醇甲、五味子醇乙、五味子酯甲、五味子甲素、五味子乙素对照品4.06、4.02、4.52、4.48、3.74 mg,分别置于2 mL量瓶中,加甲醇定容,摇匀,依次取880、248、40、1 152、336 ?L,置于2 mL量瓶中,混匀,作为混合对照品母液;精密吸取上述混合对照品母液适量,加甲醇稀释,制成上述各成分质量浓度分别为133.79、3.75、6.76、193.05、21.79 ?g/mL的混合对照品溶液。
2.1.4 精密度试验 取“2.1.2”项下供试品溶液(编号:S2)适量,按“2.1.1”项下色谱条件连续进样测定6次。以五味子甲素为参照(S),记录各共有峰的相对保留时间和相对峰面积。结果,33个共有峰相对保留时间的RSD均不低于0.30%(n=6),相对峰面积的RSD均不低于1.33%(n=6),表明方法精密度良好。
2.1.5 重复性试验 取同一批药材样品粉末(编号:S2)1.00 g,共6份,按“2.1.2”项下方法制备供试品溶液,再按“2.1.1”项下色谱条件进样测定,以五味子甲素为参照(S),记录各共有峰的相对保留时间和相对峰面积。结果,33个共有峰相对保留时间的RSD均不低于0.37%(n=6),相对峰面积的RSD均不低于2.10%(n=6),表明方法重复性良好。
2.1.6 稳定性试验 取“2.1.2”项下供试品溶液(编号:S2)适量,分别于室温下放置0、2、4、8、16、24 h时按“2.1.1”项下色谱条件进样测定,以五味子甲素为参照(S),记录各共有峰的相对保留时间和相对峰面积。结果,33个共有峰相对保留时间的RSD均不低于0.10%(n=6),相对峰面积的RSD均不低于2.10%(n=6),表明供试品溶液在室温下放置24 h内稳定性良好。
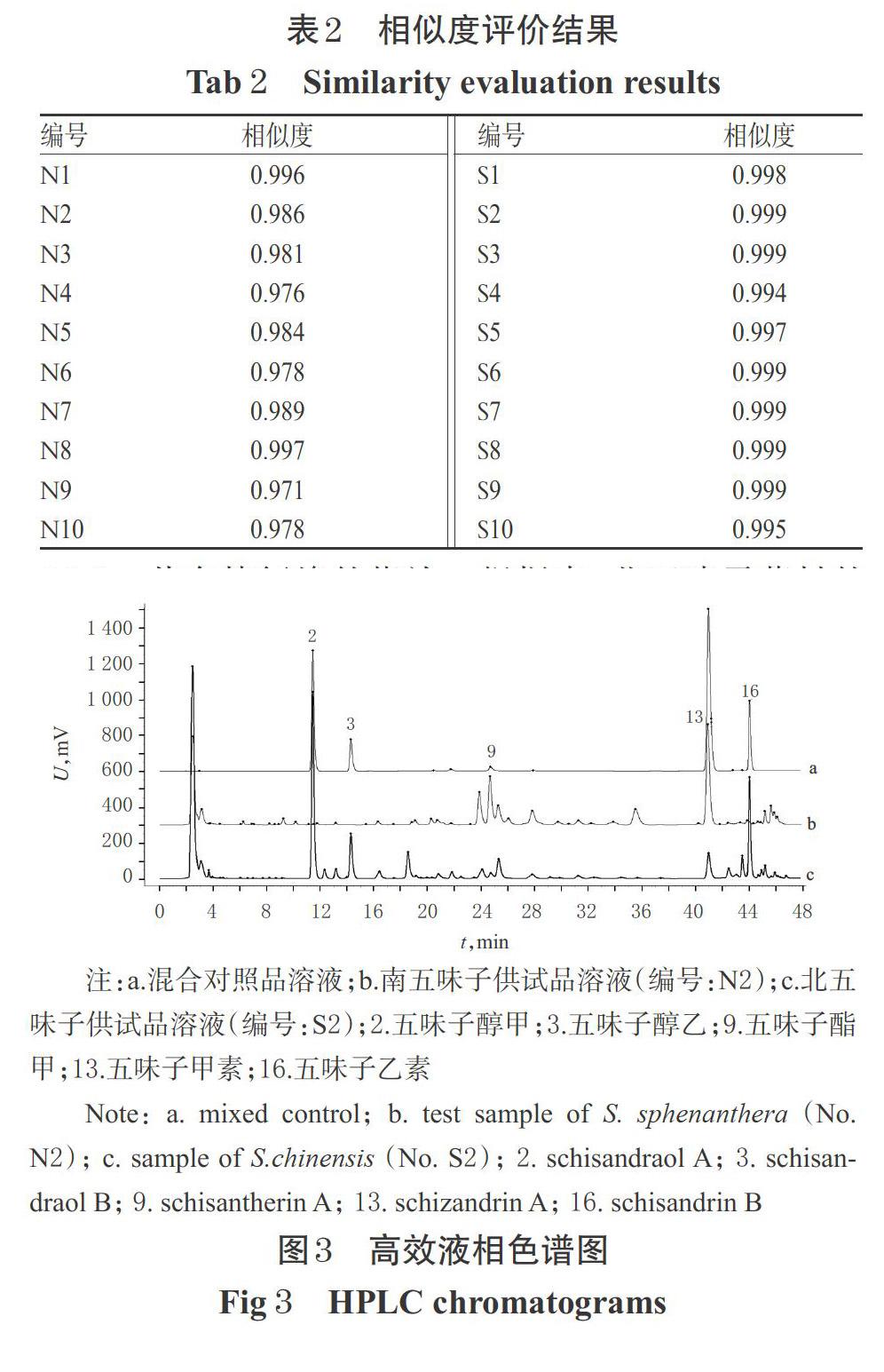
2.1.7 HPLC指纹图谱的建立 取南、北五味子药材样品各10批,按“2.1.2”项下方法制备供试品溶液,再按“2.1.1”项下色谱条件进样测定,记录色谱图。将所得色谱数据(“AIA”格式)导入《中药色谱指纹图谱相似度评价系统(2012版)》,采用中位数法,设定时间窗为0.10 min,经多点校正完成匹配后,生成指纹图谱共有模式,并以此作为对照指纹图谱(R)。结果,北五味子有33个共有峰,南五味子有32个共有峰,详见图1、图2。
2.1.8 相似度评价 采用《中药色谱指纹图谱相似度评价系统(2012版)》,对南、北五味子药材样品的指纹图谱及其对照指纹图谱进行相似度评价。结果,N1~N10药材样品的相似度均大于0.97,相似度良好,表明不同批次南五味子药材的质量较稳定;S1~S10药材样品的相似度均大于0.99,相似度良好,表明不同批次北五味子药材的质量均一稳定,详见表2。南、北五味子对照指纹图谱的相似度为0.50,表明南、北五味子的质量存在明显差异。
2.1.9 共有特征峰的指認 根据南、北五味子药材的HPLC指纹图谱生成结果,选择图谱中含量较高且分离度较好的色谱峰作为共有特征峰。结果,南、北五味子共有19个共有特征峰,通过与混合对照品的保留时间和HPLC色谱图(见图3)进行对比,共指认出其中的5个,分别为五味子醇甲(2号峰)、五味子醇乙(3号峰)、五味子酯甲(9号峰)、五味子甲素(13号峰)、五味子乙素(16号峰)。因五味子甲素含量相对较高,分离度较好,且出峰稳定,故以其为参照(S)计算其他共有特征峰的相对保留时间和相对峰面积。结果,20批样品各共有特征峰相对保留时间的RSD均不低于0.22%,表明南、北五味子的主要有效成分相似;其相对峰面积的RSD相差较大(1.26%~140.21%),表明南、北五味子主要有效成分的含量存在差异。
2.2 HCA
采用相似度评价虽然能够很好地反映南、北五味子药材指纹图谱的相似程度,但不能体现成分含量的高低,而化学模式识别可对量的差别进行分析[18]。HCA是一种通过数据建模简化多维数据,将具有指标性的数据进行聚类并划分为相对同质的群组的统计分析技术[19]。以20批南、北五味子的19个共有特征峰峰面积为变量,借助SPSS 20.0软件,采用组间联接法以欧氏平方距离为区间进行HCA,结果见图4。
由图4可知,南、北五味子20批样品可聚为两大类,N1~N10聚为一类,S1~S10聚为一类。其中,N1、N3、N8、N9聚为一类,N2、N4~N7、N10聚为一类;S2、S4、S5、S7、S8、S10聚为一类,S1、S3、S6、S9聚为一类。这提示不同批次五味子药材样品质量存在差异。
2.3 PCA
PCA可快速表征样本的差异信息[20]。以19个共有特征峰的相对峰面积为变量,采用SPSS 20.0软件进行PCA,结果见表3。
2.4 OPLS-DA
以19个共有特征峰相对峰面积为多元变量,采用SIMCA 14.1软件进行有监督模式的OPLS-DA[22]。结果,累积解释能力参数(R2X)为0.917,累积解释能力参数(R2Y)为0.985,预测能力参数(Q2)为0.952,均大于0.5,表明该模型预测能力好,可用于区别南、北五味子药材,详见图6。
为了进一步检验样本分类是否有效或样本间是否有差异,提取OPLS-DA模型中的19个变量,采用SIMCA 14.1软件对所建OPLS-DA模型进行200次的置换检验,得到OPLS-DA/S-plot图,详见图7(该图中,S型曲线上的每个点各代表1个化合物,差异性化合物分布在S型曲线的上下端[23])。
由图7可知,右上端表示南五味子药材中峰面积较大的化合物,包括9号峰(五味子酯甲)和13号峰(五味子甲素);左下端表示北五味子药材中峰面积较大的化合物,分别为2号峰(五味子醇甲)和16号峰(五味子乙素)。
变量重要性投影(VIP)可衡量各共有特征峰的表达模式对样本分类判别的影响强度和解释能力,从而辅助筛选质量差异标志物[24]。当VIP值>1.0时,表明该变量对所建模型的贡献度高于平均水平[25-26],因此本研究以VIP值>1.0为标准筛选质量差异标志物。结果,共得到4个VIP值大于1的共有特征峰,分别为13号峰(五味子甲素,VIP值为2.29)、2号峰(五味子醇甲,VIP值为2.24)、9号峰(五味子酯甲,VIP值为1.73)和16号峰(五味子乙素,VIP值为1.48)。这提示上述4个成分为影响南、北五味子药材质量的差异标志性成分,详见图8。
3 讨论
本研究试验前期采用二极管阵列检测器进行了190~800 nm全波长扫描。结果发现,在220 nm波长处所得指纹图谱的色谱峰信息较为全面,可识别的化合物种类也较丰富,故选择220 nm作为检测波长。随后,对乙腈-0.1%甲酸水溶液、乙腈-0.1%磷酸水溶液、乙腈-水等不同流动相体系的分离效果进行了比较。结果发現,以乙腈-水为流动相进行梯度洗脱时,各色谱峰的峰形佳且流动相配制简单,故选择乙腈-水为流动相。同时,又考察了不同流速(0.8、1.0、1.2 mL/min)的分离效果。结果发现,当流速为0.8 mL/min时,色谱峰峰形和分离度均较好,故选择流速为0.8 mL/min。
本研究采用HPLC法分别建立了南、北五味子药材的指纹图谱。结果显示,南、北五味子指纹图谱中分别有32、33个共有峰。选择指纹图谱中含量较高且分离度较好的色谱峰作为共有特征峰,共标定出19个共有特征峰;通过与混合对照品指认,共鉴别出其中的5个,分别为五味子醇甲、五味子醇乙、五味子酯甲、五味子甲素、五味子乙素。
本研究采用HCA、PCA法对南、北五味子药材进行分类。结果显示,20批样品可聚为两类,N1~N10聚为一类,S1~S10聚为一类。其中,N1、N3、N8、N9聚为一类,N2、N4~N7、N10聚为一类;S2、S4、S5、S7、S8、S10聚为一类,S1、S3、S6、S9聚为一类。PCA结果与HCA结果一致。为进一步表征两者的差异,本研究采用OPLS-DA法共筛选出了4个影响南、北五味子药材质量的差异标志物,分别为五味子甲素、五味子醇甲、五味子酯甲、五味子乙素。
综上所述,所建HPLC指纹图谱准确、科学、简便易行,结合多元统计分析可用于评价南、北五味子药材的质量。两种药材质量的差异标志物为五味子甲素等4种成分。
参考文献
[ 1 ] 国家药典委员会.中华人民共和国药典:一部[S].2015年版.北京:中国医药科技出版社,2015:67、244.
[ 2 ] 苏颂.本草图经[M].合肥:安徽科学技术出版社,1994:147.
[ 3 ] 王蕙清.中药材产销[M].成都:四川科学技术出版社,2007:351-355.
[ 4 ] 陈嘉谟.本草蒙筌[M].北京:人民卫生出版社,1988:44-45.
[ 5 ] 李时珍.本草纲目:图文珍藏本[M].北京:中国医药科技出版社,2016:946-949.
[ 6 ] 王卫明,刘亮,彭慧,等.南五味子和五味子的基原考证和现代研究[J].中华中医药杂志,2019,34(7):3220-3223.
[ 7 ] 张辉,颉维民.南、北五味子的鉴别研究综述[J].中国药师,2008,11(11):1375-1376.
[ 8 ] 刘宇灵,付赛,樊丽姣,等.南北五味子化学成分、药理作用等方面差异的研究进展[J].中国实验方剂学杂志,2017,23(12):228-234.
[ 9 ] 陈靓,吴亚男,单会娇,等.五味子与南五味子药材的DNA条形码鉴定[J].中国实验方剂学杂志,2016,22(1):66-71.
[10] 刘薇,李明华,程显隆,等.中药五味子的质量和临床应用有关问题分析[J].中国药事,2018,32(12):1648-1652.
[11] 干建伟,胡敏,钱广生,等.五味子中山葡萄HPLC指纹图谱的建立及其伪品鉴别[J].中成药,2019,41(2):363- 368.
[12] 李昕,聂晶,高正德,等.超声微波协同水蒸气蒸馏-GC-MS分析南、北五味子挥发油化学成分[J].食品科学,2014,35(8):269-274.
[13] 李晓亮,易进海,刘云华,等.南五味子、五味子HPLC指纹图谱研究和木脂素成分测定[J].中成药,2011,33(6):920-924.
[14] 姚令文,刘燕,郑笑为,等.指纹图谱、特征图谱技术在中药材和中成药中的应用[J].中国新药杂志,2018,27(8):934-939.
[15] 孙志,周霖,左莉华,等.血必净注射液超高效液相数字化指纹图谱及4种酚酸类化合物含量测定[J].中国医院药学杂志,2017,37(11):1060-1064.
[16] 孙启慧,高燕,吕凌,等.基于HPLC指纹图谱及化学模式识别分析不同剂型双黄连口服制剂的质量差异[J].中华中医药杂志,2019,34(8):3426-3430.
[17] WEI H,SUN L,TAI Z,et al. A simple and sensitive HPLC method for the simultaneous determination of eight bioactive components and fingerprint analysis of Schisandra sphenanthera[J]. Analytica Chimica Acta,2010,662(1):97-104.
[18] 张志鹏,梁丽金,徐杰,等.巴戟天及根皮与木心UPLC特征指纹图谱与化学模式识别方法研究[J].中草药,2020,51(13):3554-3560.
[19] 李卓伦,周霖,王肖辉,等.基于UPLC指纹图谱结合化学模式识别的芪参益气滴丸质量控制研究[J].中国现代应用药学,2019,36(14):1754-1760.
[20] 阿基业,何骏,孙润彬.代谢组学数据处理:主成分分析10个要点问题[J].药学学报,2018,53(6):929-937.
[21] 张文彤. SPSS统计分析高级教程[M].2版.北京:高等教育出版社,2013:214.
[22] 李伟,刘亚丽,宋永贵,等. UPLC-Q-TOF-MS结合OPLS- DA模式快速鉴定南、北五味子化学成分与识别差异标志物[J].中草药,2015,46(15):2212-2218.
[23] 郭威,孙蓉,王亮,等.基于指纹图谱和OPLS-DA的越南和国产土茯苓差异性化合物探索[J].中国实验方剂学杂志,2017,23(14):62-67.
[24] 周霖,梁淑红,孙志,等.基于UPLC指纹图谱结合化学模式识别的复方血栓通胶囊质量控制研究[J].中国医院药学杂志,2019,39(1):34-38.
[25] 刘杰,刘广学,尚明英,等.华细辛和北细辛HPLC特征图谱识别与抗炎靶点及抗炎成分分析[J].中国中药杂志,2020,45(6):1374-1383.
[26] 崔月莉,吴鹏,张丹捷,等.远志与炆远志HPLC指纹图谱比较[J].中药材,2020,43(3):575-581.
(收稿日期:2020-05-11 修回日期:2020-07-06)
(编辑:陈 宏)
