海马区微循环障碍在蛛网膜下腔出血后认知障碍中的作用及其机制研究
2020-10-20周永志张小兵王建莉俞学斌
周永志 张小兵 王建莉 俞学斌
动脉瘤性蛛网膜下腔出血(subarachnoid hemorrhage,SAH)是由颅内动脉瘤破裂引起的,约占自发性SAH的80%;经过积极治疗后,相当比例的患者神经功能完全康复,达到临床上的所谓“治愈”,但近年来研究发现,半数以上的幸存者中存在不同程度及多个认知领域的功能障碍[1-3],严重影响其功能预后及生活质量[4-5]。众所周知,海马组织在实现长期记忆、概念形成、空间导航等多种认知功能中起着至关重要的作用,海马区损伤可导致明显的认知障碍[6-7]。近年来研究发现,SAH患者在发病早期即存在不同程度的海马区微循环障碍,而海马区持续微循环障碍可导致海马神经元凋亡坏死和海马萎缩,进而导致相应的功能障碍[2]。但临床上对患者发生动脉瘤性SAH后海马区早期微循环及局部神经元损伤情况、认知障碍发生情况知之甚少。本研究首先利用CT灌注成像(CT perfusion image,CTP)对动脉瘤性SAH患者海马区局部微循环状况进行了测定,比较有、无认知障碍患者发病后10 d双侧海马区微循环灌注参数;同时建立小鼠SAH模型,采用水迷宫法评估小鼠认知障碍情况并分析其与神经元凋亡的关系,现将结果报道如下。
1 对象和方法
1.1 对象 选取2017年1月至2019年1月绍兴市人民医院收治的138例动脉瘤性SAH患者为研究对象,均经CT或腰椎穿刺检查证实存在自发性SAH,经CT血管成像和(或)脑血管造影检查确定为颅内动脉瘤破裂;经开颅动脉瘤夹闭或介入栓塞治.疗后预后良好,格拉斯哥结局评分4~5分。排除标准:(1)HUNT-HESS分级5级;(2)改良FISHER分级0级;(3)有神经内外科疾病史;(4)精神障碍或智力低下;(5)不能配合评估者。根据发病后6个月蒙特利尔认知评估量表(MoCA)评分,存在认知障碍(≤26分)63例,无认知障碍(>26分)75例;两组患者在性别、年龄、受教育年限以及动脉瘤大小、部位、治疗方式等方面比较,差异均无统计学意义(均P>0.05),见表1。本研究经医院伦理委员会审查通过,所有患者签署知情同意书。
1.2 CTP检查 患者发病后10 d,采用佳能320层螺旋CT扫描仪进行常规横断面扫描,层厚和层间距均为2 mm;然后选取重点层面(经基底核区域为底标准层面)进行CTP扫描检查。利用Perfusion CT随机软件对重组动态图像进行后续处理,去除所有动态图像上的颅骨轮廓;用定义CT值的方法排除脑脊液的影响,并对图像进行平滑处理以减小噪声,最后分析所有动态图像并得到一系列脑灌注参数图,包括脑血流量(CBF)、脑血容量(CBV)、对比剂平均通过时间(MTT)和达峰时间(TTP)4种图像。由2位经验丰富的神经影像学诊断医生对这些图像进行分析,选择双侧海马区为感兴趣区,取灌注图像中标准层面图或包含感兴趣区最完整的层面进行CBF、CBV、TTP、MTT等参数测量,见图1(插页)。感兴趣区在2或3个层面都包含时,取其平均值,代表相应区域的局部脑血流灌注状况。
1.3 动物实验
1.3.1 动物分组与处理 将30只小鼠(购自浙江大学动物实验中心)按随机数字表法随机分为两组:模型组20只,假手术组10只。(1)模型组采用线栓法血管内穿刺建立SAH模型。小鼠腹腔注射戊巴比妥(40 mg/kg)麻醉后,暴露右侧颈动脉及其分支。将钝化的4-0单丝尼龙缝合线推入颈外动脉,然后通过颈内动脉,直到出现阻力。缝合线再插入约3 mm,在颈内动脉分叉处附近穿刺血管制作SAH模型。(2)假手术组在缝合线通过小鼠颈内动脉遇到阻力时,将其取出,其余步骤与模型组相同。
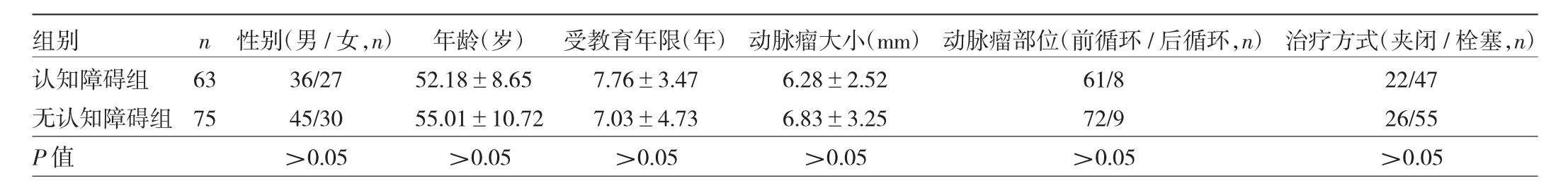
表1 有、无认知障碍患者一般资料比较
1.3.2 认知功能评估 采用水迷宫实验法。建模前4 d训练小鼠寻找水中平台,小鼠寻到平台后停留60 s强化记忆,建模前及建模成功后第10天利用自动摄像系统记录小鼠寻找到平台的时间,即潜伏时间。根据平均潜伏时间评估小鼠认知功能,<120 s为无存在认知障碍,≥120 s为认知障碍。
1.3.3 海马区细胞凋亡情况检测 采用原位末端转移酶标记技术(TUNEL)法。建模后第10天评估认知功能后,采用脊椎脱臼法处死小鼠,断头取脑,切取双侧海马组织,4%多聚甲醛固定过夜,置于10%、20%和30%的蔗糖溶液进行梯度脱水,制成5 μm厚的冠状冰冻切片。参照试剂盒说明书(C1088,北京碧云天生物技术有限公司)进行TUNEL免疫荧光染色,在荧光显微镜下观察;每张切片随机抽取5个不同的视野,使用Image J图像分析法测定每个视野的光密度值并取平均值,即凋亡细胞数。
1.4 统计学处理 采用SPSS 23.0统计软件。计量资料用表示,多组间比较采用单因素方差分析,两两比较采用SNK-q检验;两组比较采用两独立样本t检验。计数资料组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 有、无认知障碍患者发病后10 d双侧海马区微循环灌注参数比较 与无认知障碍组比较,认知障碍组患者双侧海马区CBF下降,MTT、TTP均明显延长,差异均有统计学意义(均P<0.05);两组患者双侧海马区CBV比较,差异均无统计学意义(均P>0.05),见表2。
2.2 小鼠认知功能评估结果 经水迷宫实验评估,模型组20只小鼠存在认知障碍8只,无认知障碍12只。认知障碍组、无认知障碍组、假手术组潜伏时间分别为(160.9±38.4)、(70.9±28.2)、(63.5±35.6)s,认知障碍组较无认知障碍组明显延长(P<0.05),假手术组与无认知障碍组比较差异无统计学意义(P>0.05)。
2.3 小鼠海马区细胞凋亡数比较 荧光显微镜下可见模型组小鼠海马CA3区存在较多细胞凋亡,而假手术组仅见少量凋亡细胞,见图2(插页)。与无认知障碍组相比,认知障碍组小鼠凋亡细胞数明显增多,差异有统计学意义(P<0.05),见表 3。

图1 双侧海马区CT灌注成像(CTP)图像上脑血流量(CBF)、脑血容量(CBV)、对比剂平均通过时间(MTT)及达峰时间(TTP)参数测量

图2 小鼠海马区细胞凋亡情况(a:假手术组;b:无认知障碍组;c:认知障碍组;免疫荧光染色,×400)
3 讨论
有临床研究表明,海马体与记忆、空间导航及执行力关系密切,海马损伤可引起注意力缺陷,海马区微循环障碍进而导致的海马萎缩被认为是诊断阿尔茨海默病的可靠生物学标志[3]。对于SAH,近年来临床研究和动物实验均发现海马区存在明显血流灌注下降和局部脑微循环障碍[4]。Yamamoto等[5]在动物实验中发现异氟醚诱导的小鼠持续低血压,可导致明显认知障碍,进一步研究发现这些小鼠海马区存在明显的血流灌注降低和微循环障碍,同时免疫组化染色结果显示海马CA1区存在明显的神经元损伤,这表明海马区低灌注和微循环障碍与认知障碍存在明显相关性。Takata等[6]建立小鼠模型探讨SAH后长期认知障碍的发病机制,发现与假手术组相比,SAH组小鼠水迷宫逃逸潜伏时间、游泳距离均明显增加,病理学切片检查显示SAH组小鼠海马CA1区神经元数量明显减少,同时免疫组化染色结果也显示海马区存在明显的微血管及神经元DNA氧化损伤,碳-14放射自显影技术检查显示海马区脑动脉直径改变不明显,但在出血早期(3~7 d)局部脑血流量明显减少,即使14 d后局部微循环灌注仍不完全,这提示局部存在明显的微循环障碍。以上研究结果均表明,海马区持续微循环灌注不足以及由此导致的局部神经元数量减少在SAH后长期认知障碍中起重要作用。

表2 有、无认知障碍患者发病后10 d双侧海马区微循环灌注参数比较
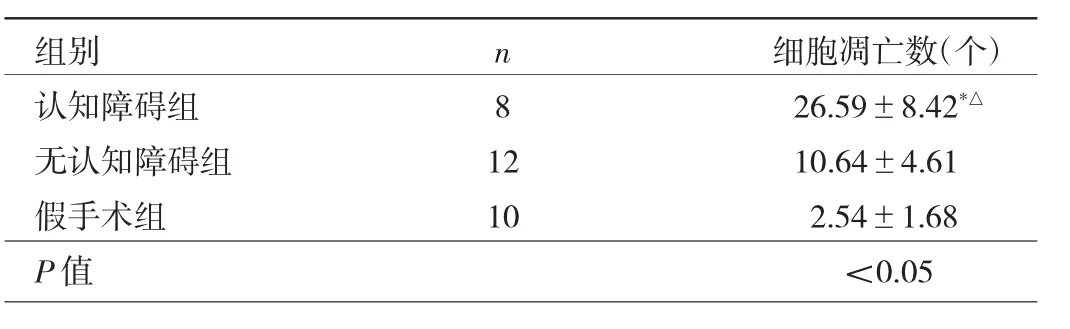
表3 3组小鼠海马区细胞凋亡数比较
CTP是一种新的血流动力学评价技术,相关参数可以从不同角度来反映脑血流灌注情况,可以在患者出现临床症状前就敏感地发现SAH导致的局部脑血流动力学异常和微循环障碍[7]。SAH患者发病后脑血管痉挛及其引发的微循环障碍一般发生在出血后4~14 d,其中第8~10天为脑血管痉挛高峰期。因此,本研究评估了动脉瘤性SAH患者发病后10 d的CTP灌注参数,结果显示与无认知障碍组相比,认知障碍组患者海马区多项灌注参数明显改变,表现为CBF明显减少,MTT和TTP明显延长,提示局部灌注明显不足,存在明显的微循环灌注障碍。结合发病后6个月MoCA量表评分进一步分析,结果显示灌注参数变化越明显,越容易出现认知障碍。由此推断双侧海马区微循环功能灌注障碍与动脉瘤性SAH后认知障碍存在明显的相关性。
但是,目前关于海马持续微循环障碍如何导致认知障碍的发病机制尚不清楚。Lee等[8]随访了动脉瘤性SAH患者出血6个月后海马区灰质体积(MRI检查),结果发现与未破裂组相比,动脉瘤性SAH患者海马区灰质体积明显减少,且海马容量减少与预后评分下降有关,提示动脉瘤性SAH可导致远期海马体积减少,但海马体积减少的机制并不明确。Luo等[9]研究发现,缺牙可导致小鼠出现空间认知障碍;进一步探究发病机制发现,实验小鼠双侧海马区CBF降低,海马组织中Bax/Bcl-2、Caspase-3 mRNA表达升高,CA1区锥体细胞数量减少。Bax、Bcl-2是细胞凋亡的关键调控因子,Caspase-3是凋亡级联反应中导致神经元凋亡的主要效应因子。该研究还认为牙齿脱落引起小鼠空间认知障碍的潜在机制与海马CBF降低引起的局部持续微循环障碍进而导致细胞凋亡增加有关。本研究建立了小鼠SAH模型,并采用水迷宫法评价其认知功能,结果发现假手术组与无认知障碍组潜伏时间比较差异无统计学意义,而认知障碍组较无认知障碍组潜伏时间明显延长;同时TUNEL染色结果显示认知障碍组小鼠双侧海马区细胞凋亡增多,提示认知障碍与海马区神经元凋亡增加具有明显的相关性。
结合临床研究发现的有认知障碍的SAH患者双侧海马区存在明显微循环障碍,以及动物实验发现的有认知障碍的小鼠海马区细胞凋亡增多的结果,笔者推断海马区持续微循环障碍导致的局部神经元凋亡增加在SAH后认知障碍发病机制中起重要作用,理由如下:(1)海马是对缺血最敏感的脑区之一,海马CA1区锥体细胞数量减少和萎缩与记忆力下降有关,是阿尔茨海默病最具特征性的神经病理学损伤区域。(2)对于SAH后认知障碍,近年来临床研究和动物实验均发现海马区存在血流灌注下降,低灌注是所有脑缺血病因的最后通路,当CBF低于正常水平的30%时,神经元电活动停止,在细胞器水平,线粒体氧化磷酸化停止,从而进一步引起缺血、缺氧级联放大效应,而持续灌注不足可导致缺血敏感区神经元不可逆死亡,以后即使恢复血流,细胞也无法复活[10]。本研究发现有认知障碍的动脉瘤性SAH患者双侧海马区CBF下降和MTT延长尤其明显,因此认为双侧海马区CBF和MTT的持续异常改变预示着该区域存在着持续微循环障碍,由此引起神经元凋亡增加和功能障碍最终导致了认知障碍的发生。
