植物PHD蛋白的研究进展
2020-10-20姚依秀李玉林何艳军高杰范敏
姚依秀,李玉林,何艳军,高杰,范敏
(1.浙江省农业科学院蔬菜研究所,浙江 杭州 310021;2.新疆农业大学林学与园艺学院,新疆 乌鲁木齐 830052)
PHD(plant homeodomain)蛋白包含一个高度保守的PHD结构域,在基因的转录调控方面发挥重要作用。虽然关于动物中PHD蛋白的结构和功能研究已十分地广泛和深入,但直到1993年,Schinder才首次在植物中发现并鉴定到PHD蛋白[1]。与动物相比,PHD基因的功能仅在少数模式植物中被研究。PHD蛋白与植物的各种生理生化过程有关,许多研究也表明了PHD基因在调节植物生长发育、病原体防御和对各种胁迫反应中具有重要作用[2]。先前的研究侧重于PHD蛋白参与植物生长发育的调控,而关于其参与植物非生物胁迫及生物胁迫调控的报道较少。因此,对这一类重要的植物蛋白进行深入研究具有十分重要的意义。本文对植物PHD基因和蛋白的基本特征、在植物生长发育和逆境调控中的生物学功能及其相关的分子调控机制等进行综述,并对今后的研究方向进行展望,以期为植物PHD基因家族在非生物(干旱、高盐等)和生物(病原菌、害虫等)胁迫等研究方面提供参考。
1 植物PHD蛋白的基本特征
PHD蛋白是一类真核生物中较为常见的具有一个或几个PHD结构域的锌指蛋白。PHD结构域由约60个氨基酸组成,具有Cys4-His-Cys3锌结合基序特征[3],半胱氨酸残基之间以及半胱氨酸与组氨酸之间的氨基酸数相对保守[4],且最后一对半胱氨酸前的第2个氨基酸残基通常为色氨酸等芳香族氨基酸[5]。PHD结构域的三维结构通常为球状[6]。进一步研究发现,PHD结构域是14种已知的锌指结构域中的一种,存在于400多种真核生物蛋白质中,在进化过程中高度保守[3,7]。
不同植物中PHD家族的基因数目各不相同。如表1所示,大豆有45条[8]、水稻有59条[9]、毛果杨有73条[10]、拟南芥有70条[11]、胡萝卜有106条[12]。大豆中PHD家族的基因数目最少,胡萝卜中最多。蛋白长度范围比较大,在74~2 336 aa之间。不同物种中PHD基因的内含子数各不相同,内含子数量在10个以内居多,也有个别物种基因中无内含子。等电点变化范围为4.46~9.87,其中水稻(54%)和毛果杨(53%)中大部分为酸性蛋白。对PHD基因在拟南芥、水稻、大豆和毛果杨染色体上的分布进行分析(表2)发现,PHD基因都是不均匀地分布在各自物种的染色体上。植物PHD基因的重复事件共分为两种,即串联重复和大片段复制。其中拟南芥、水稻、毛果杨中基因的扩增主要依赖于大片段复制,在拟南芥和毛果杨中串联重复基因只有两对(表3)。

表1 拟南芥、水稻、大豆、胡萝卜和毛果杨PHD家族基本信息
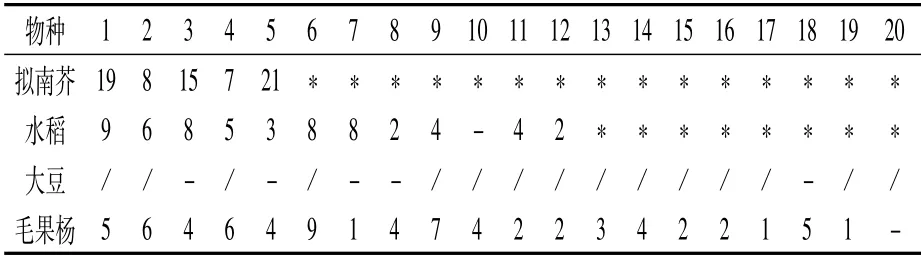
表2 拟南芥、水稻、大豆和毛果杨PHD基因在染色体上的分布

表3 大豆、水稻、拟南芥、毛果杨和胡萝卜中PHD基因扩增情况
植物PHD蛋白结构比较复杂,除了共同拥有的PHD结构域外,同一物种中还包含其他多种结构域。如表4所示,拟南芥中有8种,水稻中10种,大豆中4种,胡萝卜中3种,毛果杨中有6种。不同物种中PHD蛋白结构域类型也不同,但也有少数共有的结构域类型,如这5种物种中都具有PHD、BAH、DDT结构域。PHD蛋白中丰富且多样的结构域很可能是导致其功能多样性的决定因素。
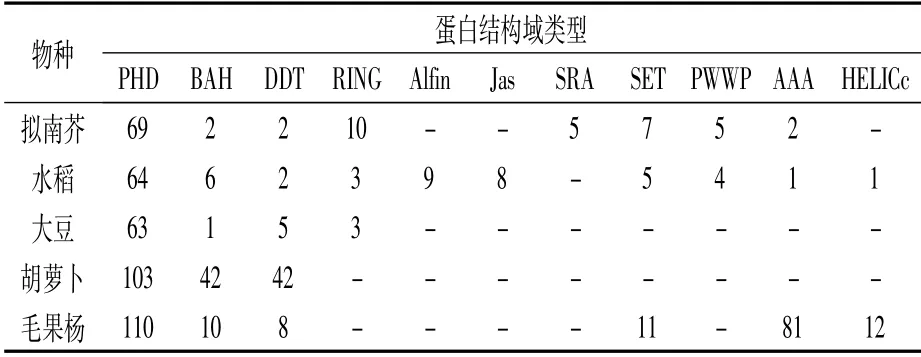
表4 拟南芥、水稻、大豆、胡萝卜和毛果杨中 不同蛋白结构域的PHD蛋白数目
2 植物PHD蛋白的分子调控机制
2.1 植物PHD蛋白具有DNA结合能力
研究发现,植物PHD蛋白具有DNA结合能力,能够在转录调控方面发挥作用。定位在细胞核上的雄性不育蛋白(MALE STERILITY 1,MS1)具有转录激活功能,在花粉绒毡层发育以及花粉壁生物合成中有重要作用,具有一个亮氨酸锌指结构域和PHD 结构域。拟南芥MMD1、大麦MS1、玉米MS7和木薯MePHD1都是PHD结构域的转录因子。水稻PHD结构域锌指蛋白OsTITANIA可以调控多种金属离子转运器基因的表达,在维持水稻正常生长发育中起重要作用[13]。木薯PHD结构域蛋白MePHD1对ADP-葡萄糖磷酸化酶亚基1(ADP-glucose pyrophosphorylase,AGPase)基因进行负调控,在淀粉代谢中发挥重要作用[14]。
2.2 植物PHD蛋白具有RNA结合能力
基因的转录后调控是真核生物适应生物和非生物胁迫的一种强有力的策略,该过程受到多种RNA结合蛋白(RNA-binding protein,RBPs)的调控,这些蛋白通过与靶mRNA的直接或间接相互作用,调控RNA代谢的多个方面,如RNA剪接、聚腺苷酸化、帽化、修饰、转运、定位、翻译和稳定性等。例如:PUF蛋白能与任何效应结构域结合,并且能够选择性结合一种特定的RNA目标,从而控制某一方面的新陈代谢作用。最早在果蝇和线虫中分别发现的PUMILIO和FBF,并以此来命名的PUF蛋白就是这样一类蛋白质[15,16]。它具有保守PHD基序,能够识别高度保守的8~10个核苷酸核心基序,包括位于mRNA 3′UTR的UGUA核苷酸基序,以确保调控靶mRNA翻译的稳定性和准确性。大多数已鉴定的PUF蛋白在哺乳动物、真菌、原生动物和植物的整个进化过程中都是保守的。在调控生长发育、逆境应答等多个方面发挥作用[17,18]。干旱胁迫诱导反义转录基因NFYA5,在拟南芥中被miR169靶向调控。NFYA5的反义转录基因蛋白NERF(NFYA 5 enhancing RING finger)具有PHD结构域的锌指蛋白,可以通过重叠区域产生siRNA,并与miR169共同作用影响NFYA5转录。NERF蛋白作为泛素化的E3连接酶发挥作用,它的表达可以增强NFYA5的表达,并提高植物抗旱性[18]。
2.3 植物PHD蛋白具有组蛋白密码解读功能
各种组蛋白修饰(包括甲基化、乙酰化、磷酸化、泛素化等)的模式和组合的多样化被称为组蛋白密码,与调节染色质状态和基因转录活性有关。不同的组蛋白修饰状态导致基因转录状态的差异;PHD锌指结构域能特异性识别组蛋白密码,是组蛋白密码的一种重要解读器,具有招募下游被调控的效应物结合的能力,在调节染色质状态和调控基因转录活性方面发挥作用[19]。
GmPHD5是大豆在盐胁迫下组蛋白H3K4二甲基化与H3K14乙酰化互作的重要调控因子,在大豆抵抗非生物胁迫中发挥作用[20]。HBO1是组蛋白乙酰转移酶(HAT)复合物的一部分,含有PHD结构域,支架式蛋白JADE1将HBO1与组蛋白H3-H4底物连接起来,在调节DNA复制、细胞增殖和发育方面发挥重要作用[21]。PHD结构域的泛素连接酶(E3s)与泛素偶联酶(E2s)共同作用介导蛋白质泛素化,参与许多细胞过程[22]。
3 植物PHD蛋白的生物学功能
植物中的PHD基因家族成员众多,蛋白结构各异,基因的表达特性也多种多样,PHD蛋白已被证实在植物不同的生长发育和抗逆抗病等过程中发挥极其重要的作用。
3.1 PHD蛋白在植物生长发育中的生物学功能
研究表明,大量的PHD蛋白调控植物的生殖发育过程。GSR1编码一个串联的PHD蛋白,该基因可以通过生长素信号途径调节种子萌发和休眠[23]。在拟南芥中,对PHD蛋白在春化作用途径中功能的研究表明,FLOWERING LOCUS C(FLC)是开花网络核心基因,VERNALIZATION INSENSITIVE 3(VIN3)是春化作用途径上游的关键基因,长时间(大于20 d)的低温处理会诱导VIN3的表达,并使FLC表达量降低[24]。PHD结构域可以结合2个锌离子,以pygoupus蛋白为例,分别在C1、C2、H1和C5上结合第一个锌离子以及在C3、C4、C6和C7上结合第2个锌离子,使得在PHD结构域内形成2个环的稳定结构[19]。VIN3也具有与pygoupus蛋白类似的锌蛋白交叉支架结构,该结构使得VIN3具有很多生理功能,例如参与蛋白与蛋白之间的相互作用、核小体组蛋白的修饰等。甲基化胞嘧啶结合蛋白VIM1编码包含PHD、RING和SRA结构域的蛋白质,这些结构域共同存在于哺乳动物蛋白中,涉及染色质修饰、转录和细胞周期的调控,能与组蛋白结合,参与染色质状态的调节[25]。小孢子母细胞减数分裂相关基因MMD1中存在一个PHD结构域,并且优先在雄性减数分裂细胞中表达,MMD1的突变表型和分子特征表明,它可能参与了染色质重构和/或通过减数分裂继续进行转录,进一步说明了该蛋白可能调控减数分裂过程中相关基因的转录[26]。大麦PHD转录因子MS1在花粉发育中起关键作用[27]。此外,PHD基因家族还通过调节SOC1/FT染色质构象在调控开花过程中发挥作用[28]。
3.2 PHD蛋白在植物逆境胁迫中的功能
3.2.1 PHD蛋白在植物非生物逆境胁迫中的功能 qRT-PCR结果表明水稻PHD基因家族可能参与植物对不同环境胁迫的响应[29]。对水稻Os-PHD基因在脱落酸(abscisic acid,ABA)、高镉和缺水下的表达模式进行检测,结果表明,59个Os-PHD基因中有47个对高镉胁迫有响应,只有5个基因响应低温处理。大多数OsPHDs在高浓度的镉、ABA和水分亏缺条件下表达水平上调。在玉米中,67个PHD基因中有15个响应干旱和高盐胁迫[30];毛果杨中有9个PHD基因家族在盐、干旱和冷胁迫下表现出差异表达[10]。
紫花苜蓿中的Alfin1蛋白是植物特异性PHD蛋白亚家族成员。研究表明,Alfin1是一种盐诱导转录因子,可以调控MsPRP2基因的表达,从而提高植物耐盐性[31,32],ALs(Alfin1-like PHD finger proteins)是拟南芥中的类Alfin1锌指蛋白。ALs基因对盐、低温和氧化胁迫有不同程度的响应。拟南芥植株中过量表达AL5基因具有更强的盐、干旱和低温耐受能力,而AL5突变植株对这些胁迫的耐受能力降低[2]。大豆中GmPHD2基因在拟南芥中的异源表达提高了转基因植株的耐盐性[33]。也有研究表明PHD基因通过改变转录和阅读表观组蛋白修饰,在调控植物对非生物胁迫的反应中发挥重要作用[34,35]。逆境(干旱、高盐和低温)处理下,水稻内源基因OsPHD1的表达量明显升高[35]。研究表明,OsMsr16作为PHD转录因子在植物响应盐胁迫过程中发挥重要作用[36]。拟南芥中的PHD 蛋白可以与组蛋白H3K4me3/2结合[37],在盐胁迫下诱导紫花苜蓿Aflin1和AL基因的表达[38,39]。大豆GmPHD5蛋白,作为甲基化H3K4的“编码阅读器”,调控乙酰化H3K14,从而控制盐胁迫下靶基因的表达[20]。将来源于水稻的与耐逆性相关的PHDfinger家族转录因子基因KT496转化水稻,可以显著提高水稻对低温、高盐和干旱胁迫的耐受性[40]。
3.2.2 PHD蛋白在植物免疫反应调控中的作用
植物在生长发育过程中会面临多种病原菌的侵染,在长期的进化中,植物演化出了两道免疫防线来抑制病原菌的破坏。第一道防线是病原相关分子模式(pathogen-associated molecular patterns,PAMPs)所触发的免疫反应(PAMP-triggered immunity,PTI)。植物使用模式识别受体(patternrecognition receptors,PRR)感知病原微生物的入侵并激发相应的抗病反应。植物PRR是表面定位的受体类蛋白(receptor-like proteins,RLPs)或受体激酶(receptor kinases,RKs)。植物受体激酶常富含亮氨酸的重复(leucine rich repeat,LRR),为LRR受体激酶(LRR receptor-like kinase,LRRRLK)。第二道防线是效应因子触发的免疫反应(effector-triggered-immunity,ETI)。在ETI过程中,植物抗病基因编码的抗病蛋白具有保守的核苷酸结合位点(nucleotide binding site,NBS)以及富含亮氨酸重复序列,它能够直接或者间接的识别病原菌释放的效应因子,引起效应因子触发的免疫反应,使植物细胞主动死亡,即超敏反应(hypersensitive response,HR),进而抑制病原菌的侵染。植物NB-LRR R蛋白根据其N末端结构可以分为两类,一类具有卷曲螺旋(CC)域CC-NBLRR,另一类具有Toll样受体(TIR)域TIR-NBLRR[41]。PHD 蛋 白 既 可 与LRR 受 体 激 酶 如SERK3/BAK1、SnRK1类抗病蛋白互作,也可与TIR-NB-LRR、CC-NB-LRR类抗病蛋白互作,在植物免疫反应调控中发挥重要作用。
(1)PHD蛋白参与PTI反应:PHD蛋白与受体类激酶或受体类蛋白互作在植物免疫调控中发挥作用。PAMP触发的防御反应需要受体蛋白、蛋白激酶(MAPK)、SUMO蛋白形成转录复合体,共同调节植物抗病免疫反应。具体通过三种方式来调节。
第一,PHD蛋白可以与SOBIR 1和SERK3/BAK1激酶互作。如模式植物拟南芥中富含亮氨酸重复的受体激酶 FLAGELLIN SENSING 2(FLS2)是模式识别受体(PRRs),FLS2受体感知细菌鞭毛蛋白并募集另一种共受体BAK1(brassinosteroid insensitive 1-associated kinase 1),BAK1和胞质激酶(BOTRYTIS-INDUCED KINASE-1,BIK1)形成有活性的共受体复合物,从而启动拟南芥中的抗菌免疫。鞭毛蛋白可诱导SUMO蛋白与FLS2结合以触发激酶BIK1释放,也诱导脱SUMO化(deSUMOylating)酶Desi3a降解并增强FLS2 SUMO化修饰从而促进BIK1分解并触发细胞内免疫信号。FLS2 SUMO化的破坏可以消除免疫反应,从而导致拟南芥对细菌性病原体的易感性[42]。
第二,PHD蛋白可以与活化的激酶C受体1(receptor for activated kinase C-1,RACK1)互作,活化的RACK1的SUMO化修饰导致RACK1B与AP2/ERF家族转录因子RAP2.6之间的相互作用增强[43]。OsRap2.6与RACK1A相互作用来促进水稻对稻瘟病的先天免疫[44]。
第三,PHD蛋白可以与AMP类蛋白激酶SnRK1(sucrose-non-fermenting 1)互作,SnRK1是AMP激活的蛋白激酶(AMP activated protein kinase,AMPK)。SnRK1蛋白激酶根据细胞外条件平衡细胞能量水平,是植物耐逆性的关键。SnRK1复合物在多个亚基上被SIZ1作为E3连接酶(含PHD结构域)SUMO化,SnRK1可以触发其自身的SUMO化和降解,建立一个负反馈回路,该回路减弱了SnRK1信号传导并防止了应激反应的有害过度激活[45]。
在感知病原体后植物固有的免疫受体激活各种信号传导途径,从而触发宿主防御。PAMP触发的防御信号传导需要丝裂原激活的蛋白激酶途径,该途径可通过磷酸化调节转录因子的活性。这些转录因子也是SUMO结合的目标。SUMO偶联决定了染色质修饰酶的募集和活性,从而控制基因表达。抗性蛋白信号传导和SUMO结合都在转录复合体汇聚。例如,TIR-NB-LRR 蛋白SNC 1与组蛋白脱乙酰基酶HAD 19和转录共阻遏物Topless-related 1相互作用共同调控拟南芥对丁香假单胞菌抗病性,后两者都是SUMO的靶标。SUMO偶联可以将转录激活因子转化为阻遏物,从而在没有病原体的情况下阻止防御诱导[46,47]。
(2)PHD蛋白参与ETI反应:PHD蛋白与TIR-NBS-LRR、CC-NBS-LRR型等抗病蛋白互作在植物免疫调控中发挥作用。根据相关文献报道,具体有以下三种互作方式参与调控。
第一,以蛋白与蛋白互作方式参与调控。拟南芥的SIZ1编码一个SUMO E3连接酶,调控生物和非生物胁迫响应,SIZ1蛋白中PHD结构域对于其发挥功能至关重要,PHD能够识别三甲基化组蛋白H3K4me3,对于组蛋白的识别以及转录抑制都很重要[48]。拟南芥防御调节者EDM2(enhanced downymildew 2)的PHD结构域可以识别三重修饰的组蛋白H3肽,通过影响免疫受体基因RPP7(resistance to peronospora parasitica)(RPP7编码CC-NB-LRR蛋白)中另一个聚腺苷酸化位点处组蛋白H3(H3K9me2)的二甲基赖氨酸9的水平来动态调节RPP7表达水平,从而影响植株抗病能力[49]。拟南芥抗霜霉病基因RPP7编码CC-NB-LRR蛋白,其抗性调节途径与NDR1和SA 无关,但是RPP7转录水平控制需要EDM2。EDM2蛋白在结构上具有转录调节因子的典型特征,包括PHD结构域[50]。拟南芥EDM2除了与RPP7基因互作在抗霜霉病免疫调节中起作用外,还具有促进花型转化的作用。EDM2在细胞核中可以与蛋白激酶WNK8相互作用调控植物叶和花发育[51]。在抗病过程中,EDM2是否与WNK8相互作用还不清楚。PHD 蛋白13(PHF13)是个与染色质有关的蛋白,PHF13是H3K4me2-3分子阅读器和转录共调节子,可调节染色质结构和有丝分裂染色体浓缩,对于正确的细胞分裂很重要[52]。植物PHD结构域蛋白与病毒运动蛋白直接互作在抗病反应中发挥重要作用[53]。
第二,以蛋白-DNA互作方式(作为转录因子)参与调控。编码致病相关蛋白2(pathogen defense-related,PR2)的欧芹pr2基因的转录可被真菌或细菌激发子激发调控。Pr2启动子内有一个125 bp的区域,该区域包含真菌诱导子介导的表达所需的重要顺式调控元件,而且包含的11 bp DNA基序(CTAATTGTTTA)可与欧芹和拟南芥核蛋白提取物中均存在的因子特异性结合。该11 bp DNA基序是PHD蛋白体内潜在的靶位点。研究表明,PHD-DNA相互作用在调节pr2基因表达中发挥了重要作用[54]。
第三,以蛋白-RNA互作的方式参与调控。模式植物拟南芥中APUM 5通过CMV RNA的直接结合特异性调节CMV侵染[55]。水稻稻瘟病抗性基因簇Pigm编码多个CC(coiled-coil)类型的NLRs,具有广谱抗病功能。与PigmR互作的蛋白PIBPs(PigmR-interacting and blast resistance proteins,PIBPs)是含有RRM(RNA-recognition motif)结构域的转录因子,能与PigmR基因特异性互作。PIBP 1正调控PigmR,激活下游免疫基因的表达[56]。
4 展望
近年来,人们对植物中PHD蛋白的结构、生物学功能、作用机制等进行了研究,结果发现其不仅参与调控植物的多种生命过程,还参与植物对干旱、盐、温度和各种病害等非生物和生物胁迫应答。这些研究为提高作物产量以及适应各种胁迫提供了崭新的思路,具有良好的应用前景。但是关于PHD蛋白的研究仍存在一定的不足。第一,PHD蛋白的结构多种多样,除含有保守的PHD结构域外,还有其它多种不同类型的结构域,这些是其功能多样性的基础。但除了对PHD结构域有所研究外,对于其他各个结构域的功能有待进一步深入研究。第二,PHD蛋白被证实能够与DNA和RNA结合,在组蛋白密码解读等水平发挥调控作用,这也暗示了PHD基因调控机制的多样性。PHD蛋白作用机制的研究多集中在蛋白-蛋白调控水平,对其在DNA、RNA结合以及组蛋白密码解读等水平介导的调控网络的研究较少,对相关作用机理需要进一步试验验证,对这些方面展开深入的研究具有十分重要的意义。第三,对PHD蛋白的功能研究大多集中在植物在应对一些非生物胁迫如干旱、盐碱等逆境,而对于病害等生物胁迫相关的研究还很少。在今后的研究中,进一步探索PHD蛋白的调控机制可为作物抗病抗逆性状的改良提供更为详细的理论指导。
