镉存在条件下湖泊表层沉积物对菲的吸附
2020-10-19李兴国张克峰闫帅成
李兴国,张克峰,*,刘 雷,闫帅成
(1.山东建筑大学市政与环境工程学院,山东济南 250101;2.济南市市政工程设计研究院,山东济南 250101)
湖泊是地表水水系的重要组成部分,湖泊在调蓄水源、稳定生态、通航运输和防洪抗灾等方面发挥了重大的积极作用。报道显示,中国960余万km2的领土内拥有成规模的淡水湖泊3 000余个,这些湖泊的占地面积约8万km2,然而众多的湖泊和江河水系远远满足不了生产生活对淡水资源的需求。由于水体的水域范围内存在工业产业和结构布局不合理等问题,大量的工业污废水、农药化肥残留和城市生活污水等污染物以直接或间接的方式排入水体中的现象时有发生,加上船舶航道的污染,湖泊表层沉积物中重金属和多环芳烃有机物的复合污染加剧[1-2]。
进入水体污染物源和汇的湖泊表层沉积物是一个复杂的影响水体中污染物转化迁移的多介质体系[3],水体污染物在水-沉积物界面存在复杂的物理化学作用。虽然已有研究表层沉积物对重金属或有机物的吸附解吸规律,但是少有研究重金属存在条件下湖泊表层沉积物对有机物的吸附解吸规律。吸附过程影响多环芳烃的归趋和转变,这对环境污染的有效修复作用显著[4]。重金属对湖泊表层沉积物吸附有机物的作用较为复杂,根据重金属和有机物与沉积物结合方式的不同,重金属和有机物之间可能存在的作用有互不影响(重金属-非极性有机物)、竞争吸附(重金属-极性有机物)、共沉淀(重金属-有机络合物)等。湖泊表层沉积物外界环境的变化易引起表层沉积物吸附的重金属和有机物重新释放到水体中,引发水体的二次污染。
试验的湖泊表层沉积物样品取自山东省重要渔业基地南四湖流域,多环芳烃类有机物以菲为代表,重金属类物质以镉为代表。本文采用控制变量法和对照法研究重金属镉存在对湖泊表层沉积物吸附有机物的影响,以期为控制湖泊流域的有机物污染提供参考。
1 材料与方法
1.1 主要试剂与仪器
硝酸镉(AR),菲(纯度95%),乙腈(GR),硝酸钾(AR),叠氮化钠(AR),自制采样器,冷冻干燥机(宁波新芝生物科技股份有限公司,新芝-10 N),电子天平(CP114,奥豪斯仪器〈上海〉有限公司),污泥破碎机(永康市凯元工贸有限公司,KC-100),恒温振荡箱(常州恒睿仪器设备制造有限公司,SHA-CA LKTC-C2),高速离心机(TDL-5-A,上海安亭科学仪器厂),高效液相色谱(Waters USA,Waters 1525/2996),菲标准品(Phenanthrene 100 μg/mL in Acetonitrile)
1.2 试验药剂及沉积物样品
1.2.1 菲储备液的制备
称取1.00 g的菲,溶解于乙腈溶液后转置于1 000 mL容量瓶中定容,为储备液A。储备液A中菲的浓度为1 mg/mL,冷藏、避光保存。
1.2.2 镉离子(Cd2+)储备液的制备
称取3.08 g的四水合硝酸镉晶体,溶解于水后转置于1 000 mL容量瓶中定容,为储备液B。试验时,溶液中再加入电解质溶液硝酸钾和抑菌剂叠氮化钠。
1.2.3 表层沉积物样品采集及预处理
研究的湖泊表层沉积物样品取自南水北调东线工程重要调蓄枢纽的南四湖流域[5-6],自4个取样点位取出湖泊表层沉积物样品后立即进行沉积物样品的预处理。样品的预处理工作如下:首先,将4个点位取出的湖泊表层沉积物样品分别装入可封口的聚乙烯塑料袋内冷藏保存;其次,及时将沉积物样品带回实验室进行冷冻干燥处理,待冷冻干燥处理完成后去除4份湖泊表层沉积物样品内的碎石、动植物渣滓和毛发等大颗粒物质;然后,将4个取样点的沉积物样品等量均匀混合,用污泥破碎机研磨破碎沉积物样品并用筛子过滤,放置于干燥罐内保存取用。
1.3 试验方法
1.3.1 吸附动力学试验
M组锥型瓶中加入定量的储备液A和储备液B;N组锥形瓶中只加入定量的储备液A。M组锥形瓶中菲的浓度为10.0 mg/L,镉离子的浓度为20.0 mg/L;N组锥形瓶中菲的浓度为10.0 mg/L,镉离子的浓度为0.0 mg/L。试验时,将M组和N组锥形瓶中的溶液pH值均调节至7.0;在每个锥形瓶中加入0.5 g湖泊表层沉淀物样品;在避光条件下,密封锥形瓶,并将其固定在恒温25 °C、转速为200 r/min的恒温振荡箱中反应;以等同的时间间隔取锥形瓶测样,测样时应先将样品在3 000 r/min离心,使样品中湖泊表层沉积物与溶液分离,取上清液测定溶液中剩余菲的浓度。
1.3.2 解吸试验
在湖泊表层沉积物对菲的吸附达到平衡时,将样品中的沉积物与溶液分离并添加等量的电解质溶液恒温振荡处理,待反应一段时间后进行取样,样品经3 000 r/min的离心预处理,使沉积物与溶液分离,然后测定溶液中菲的浓度。
1.3.3 吸附等温试验
在P组锥型瓶中加入梯度浓度的储备液A和定量的储备液B,Q组锥形瓶中只加入梯度浓度的储备液A,菲的浓度梯度为2.5、5.0、10.0、15.0、20.0 mg/L;P组锥形瓶中镉离子的浓度为20.0 mg/L,Q组锥形瓶中镉离子的浓度为0.0 mg/L。试验时,溶液pH值均调节至7.0,在每个锥形瓶中加入0.5 g的湖泊表层沉淀物样品。经恒温振荡处理后,定时取样,样品经离心处理后测定溶液的菲浓度。
上述试验完成后,重复1.3.1节操作,只将沉积物样品的投加量变为0.2、0.5、1.0、2.0 g,其余条件不变。
1.3.4 pH对沉积物吸附菲的影响
定量的储备液A和储备液B加入R组锥型瓶中,T组锥形瓶中只加入定量的储备液A;R组锥形瓶中菲和镉的浓度分别为10.0 mg/L和20.0 mg/L,T组锥形瓶中菲和镉的浓度分别为10.0 mg/L和0.0 mg/L。试验时,溶液的pH值从4以等间距1增加到10,共7组,每个锥形瓶中各加0.5 g湖泊表层沉积物样品。经恒温振荡处理后,定时取样,样品经离心处理后测定溶液的菲浓度。
1.4 测量方法
试验时,水样中镉浓度的测定选用原子吸收分光光度法。沉积物中的镉由于含量较低以及与其他物质结合等诸多原因,测量时对样品采取微波消解、加热赶酸和定容等预处理操作富集沉积物中的镉后,选用原子吸收分光光度法测定。水样中菲浓度由高效液相色谱法测定。对于沉积物样品中菲浓度的测定,首先将样品进行索氏抽提、氮吹、硅胶柱净化,再经氮吹、定容等预处理后,采用高效液相色谱法测定样品中的菲浓度。因直接测量湖泊表层沉积物样品的菲浓度较为困难,试验时根据差量法计算沉积物样品的菲浓度,溶液中菲浓度的减少量即为沉积物的吸附量。
2 结果与讨论
2.1 吸附动力学
湖泊表层沉积物对菲的吸附动力学曲线如图1所示。试验初期,沉积物对菲的吸附速率较快,之后对样品中菲的吸附速率减缓并逐渐达到动态平衡。由吸附动力学曲线可知:湖泊表层沉积物对菲的吸附反应在前3 h内吸附速率快,且吸附量是总吸附量的92%;吸附反应进行3 h后,湖泊表层沉积物对菲的吸附速率较慢,但沉积物对菲的吸附量逐渐增加并于反应进行24 h后,湖泊表层沉积物对菲的吸附和解吸达到动态平衡状态。因为反应进行24 h后,沉积物对菲的吸附量没有显著的改变,所以湖泊表层沉积物对菲的吸附解吸达动态平衡的时间是24 h。在有、无重金属镉存在的条件下,湖泊表层沉积物对菲的吸附解吸反应达到动态平衡时沉积物吸附菲的量分别是1.81 mg/g和1.75 mg/g。由此可知,湖泊表层沉积物中镉的存在小幅度提高了沉积物对菲的最大吸附容量。

图1 沉积物对菲的吸附动力学曲线Fig.1 Adsorption Kinetic Curve of Phenanthrene by Sediment
湖泊表层沉积物对有机物的吸附量随吸附时间的变化关系常采用吸附动力学模型表述。分子扩散动力学模型、拟一级动力学方程模型和拟二级动力学模型是现阶段3种主流的吸附动力学模型[7]。现采用拟一级动力学方程和拟二级动力学方程对试验进行拟合,如式(1)和式(2)。拟合结果如表1所示。
y=a(1-e-bx)
(1)
其中:y——拟合沉积物吸附菲的含量,mg/g;
x——吸附时间,h;
a,b——拟合参数。
(2)
其中:t——吸附反应进行的时间,h;
qt——反应时间t时,沉积物吸附菲的量,mmol/g;
qeq——沉积物对菲的平衡吸附量,mmol/g;
k——吸附速率常数,g/(mmol·h)。
由表1可知,拟一级动力学方程的拟合相关系数低于拟二级动力学方程的拟合相关系数,拟二级动力学方程可以更好地拟合湖泊表层沉积物对菲的吸附。拟二级动力学模型的假定条件是吸附速率受吸附剂和吸附质间电子共用或转移的化学吸附机理控制[8]。拟二级动力学方程很好地拟合了湖泊表层沉积物对菲的吸附,说明湖泊表层沉积物吸附菲的影响因素有吸附剂与吸附质间电子共用或转移的化学吸附。虽然拟一级动力学方程的拟合相关系数低于拟二级动力学方程,但是拟一级动力学方程的拟合相关系数R2>0.990,说明湖泊表层沉积物对菲的吸附也受到物理扩散控制。

表1 沉积物吸附菲的动力学拟合参数Tab.1 Kinetic Fitting Parameters of Phenanthrene Adsorption by Sediments
研究认为,沉积物对菲的吸附主要通过物理吸附和化学键结合产生的吸附[9-10],湖泊表层沉积物对菲的吸附动力学拟合结果也证明了物理扩散和化学键结合是湖泊表层沉积物吸附菲的影响因素。吸附反应开始是湖泊表层沉积物中有机质溶解相产生的吸附作用,菲被吸附到湖泊表层沉积物表面[11],此过程吸附反应速率较快。根据反应动力学曲线,此过程发生在开始反应的3 h;随着沉积物表面吸附位点逐渐减少,菲开始被吸附至沉积物内部,此过程较慢,发生在反应的3 h之后。
2.2 沉积物对菲的解吸
湖泊表层沉积物中菲的含量和解吸比例变化曲线如图2所示。湖泊表层沉积物对菲的解吸在试验开始3 h内的解吸速率较快,然后解吸速率逐渐降低,在24 h后沉积物对菲的解吸量变化较小,因此,湖泊表层沉积物对菲的解吸达到动态平衡的时间为24 h。含有镉的湖泊表层沉积物对菲的解吸比例是33.90%,而不含镉的湖泊表层沉积物对菲的解吸比例高达41.23%。由此可知,不含镉的湖泊表层沉积物对菲的解吸程度高于含有重金属镉的湖泊表层沉积物对菲的解吸程度。湖泊表层沉积物中镉的存在有利于保持湖泊表层沉积物吸附菲的稳定性,降低菲释放至水体的量,对稳定湖泊表层沉积物中有机菲的污染具有一定的作用。

图2 沉积物中菲的含量及解吸比例变化曲线Fig.2 Variation Curve of Phenanthrene Content and Desorption Ratio by Sediment
强络合能力的重金属镉可以和湖泊表层沉积物中的有机官能团如羧基和羟基等物质发生络合反应,使湖泊表层沉积物表面的吸附点位增多,强化了湖泊表层沉积物对菲的吸附能力[12]。湖泊表层沉积物含有的重金属镉增加了腐植酸的聚合度和沉积物中的有机质,强化了湖泊表层沉积物的表面吸附,水体中的菲逐渐迁移至湖泊表层沉积物,通过与沉积物结合提高了沉积物解吸菲的难度[13]。因此,有镉条件下,湖泊表层沉积物对吸附的有机物菲的解吸程度低于无镉条件下沉积物对菲的解吸程度。
沉积物对菲的吸附力主要是化学力,被吸附的菲在沉积物内部发生分子重排和内部扩散等,与湖泊表层沉积物结合形成有机复合物,此过程有新的化合物产生,被湖泊表层沉积物吸附的菲不再解吸。沉积物通过物理作用吸附的菲没有发生结构变化,在外界环境改变后被解吸并服从分配平衡,成为可逆吸附部分,其吸附和解吸进程很快[10,14-15]。结合吸附和解吸试验过程,试验的前3 h以湖泊表层沉积物对菲的物理吸附为主,因此,此过程进行较快。
2.3 吸附等温线
湖泊表层沉积物对菲的吸附等温线如图3所示。在外界温度恒定条件下增加环境中菲的含量,湖泊表层沉积物具有饱和吸附量,因此,随着吸附反应的进行,湖泊表层沉积物对菲的吸附量在吸附反应后期逐渐稳定。含有重金属镉的湖泊表层沉积物对菲的吸附量大于不含镉的湖泊表层沉积物对菲的吸附量,并由此可知,湖泊表层沉积物中的重金属镉小幅度提高了沉积物对菲的吸附量。由图3可知,Freundlich方程的拟合曲线比Langmuir方程的拟合曲线更符合试验条件下湖泊表层沉积物对菲的吸附过程。

图3 沉积物对菲的吸附等温线Fig.3 Adsorption Isotherms of Phenanthrene by Sediments
湖泊表层沉积物对菲的吸附等温线是吸附反应达到动态平衡时描述环境中菲含量和湖泊表层沉积物中菲含量的关系曲线,Freundlich方程和Langmuir方程是常用的等温吸附模型[16]。Langmuir方程基于假定结合点位在吸附物质表面是均等存在的,每个吸附点位的吸引力相同,以单分子层吸附为主,且方程假定离子被吸附后就不存在相互作用;Freundlich方程也认为吸附剂表面为单分子层吸附,但还假设吸附剂会有多种价态的分布,从而产生不同的亲和力[17]。
湖泊表层沉积物对菲的吸附选用Langmuir方程和Freundlich方程进行等温吸附拟合,如式(3)和式(4)。拟合结果如表2所示。
(3)
其中:ceq——吸附反应平衡时菲的浓度,mg/g;
qm——沉积物对菲的最大吸附量,mg/g;
qeq——沉积物对菲的平衡吸附量,mg/g;
b——拟合常数。
(4)
其中:kf,n——拟合常数。
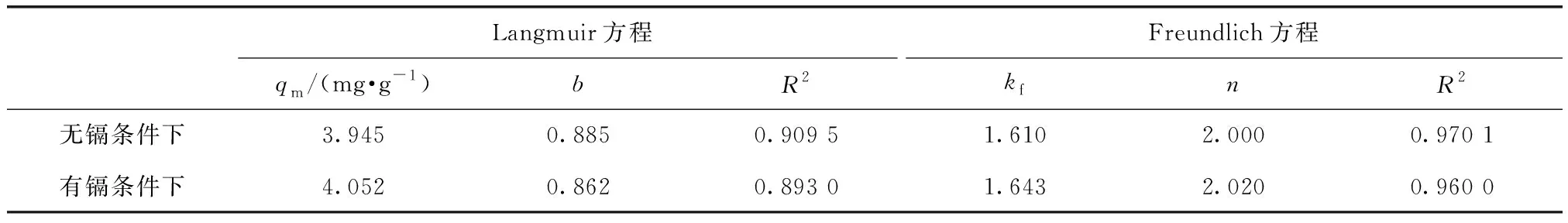
表2 沉积物对菲的吸附拟合参数Tab.2 Fitting Parameters of Phenanthrene Adsorption by Sediments
由表2可知,湖泊表层沉积物吸附菲的Freundlich方程拟合相关系数高于Langmuir方程拟合的相关系数,且含有镉的湖泊表层沉积物吸附菲的Langmuir方程拟合参数值小于0.900。湖泊表层沉积物对菲的等温吸附可用Freundlich方程较好的拟合,说明吸附剂(湖泊表层沉积物)对菲的吸附能力很强,湖泊表层沉积物对菲的吸附应为单分子层吸附,并伴随沉积物的微孔吸附和表面作用。
Freundlich等温吸附模型主要是基于物理吸附的放热反应,范德华力、氢键力、偶极间力、离子键力和化学吸附力是等温吸附的主作用力[18]。湖泊表层沉积物对菲的吸附更符合Freundlich等温吸附模型,表明随着外界环境中菲浓度的增加,湖泊表层沉积物对菲的吸附逐渐由表面物理吸附转为化学吸附,菲从沉积物表面逐渐填充至沉积物空隙,并被高能位点吸附固定于沉积物空隙[19]。
湖泊表层沉积物的量对菲的吸附量和吸附比例变化曲线如图4所示。湖泊表层沉积物对菲的吸附比例随沉积物的增加而提高,菲从水体环境逐渐聚集于沉积物。湖泊表层沉积物过量投加导致单位沉积物含菲量减少,无镉条件下湖泊表层沉积物中菲的含量从4.00 mg/g降至0.48 mg/g,有镉条件下湖泊表层沉积物中菲的含量从4.12 mg/g降至0.48 mg/g。虽然过量地投加吸附剂导致单位吸附剂吸附的吸附质减少,但是过量地投加表层沉积物有效降低了水体中菲的含量。
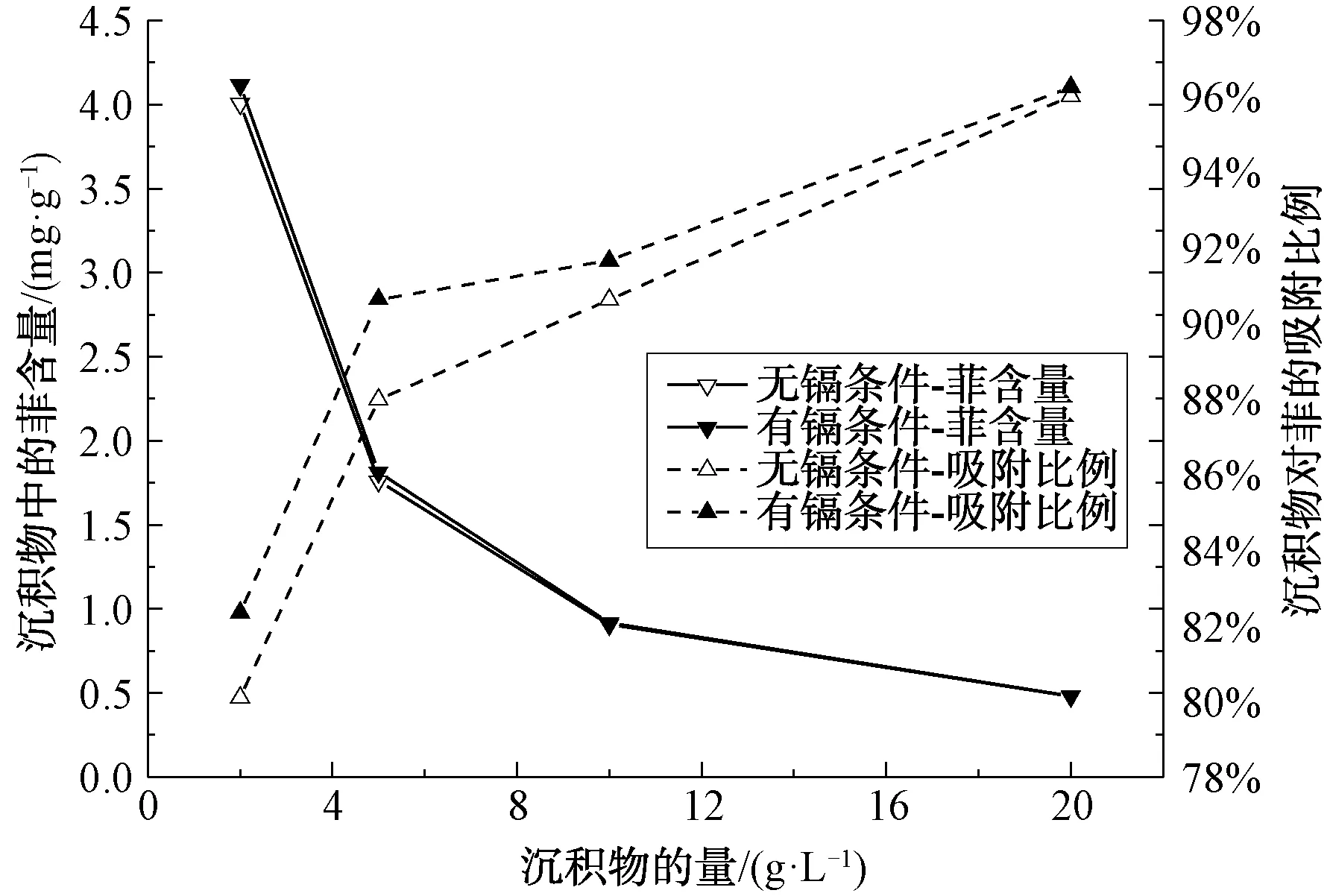
图4 沉积物的量对菲的吸附量及吸附比例变化曲线Fig.4 Variation Curves of the Amount of Sediment to Phenanthrene Adsorption and Adsorption Ratio
环境中菲的浓度一定时,湖泊表层沉积物间的胶结、絮凝作用与水体中表层沉积物的量呈正相关。因此,湖泊表层沉积物间相互作用的增强降低了沉积物与菲的相互碰撞频率,导致单位湖泊表层沉积物吸附菲的量减少[20-21]。
2.4 pH对吸附的影响
环境pH的变化对湖泊表层沉积物吸附菲的影响如图5所示。pH的变化影响湖泊表层沉积物对菲的吸附。pH值由4升至8时,含有镉的湖泊表层沉积物对菲的吸附比例略有下降,不含镉的湖泊表层沉积物对菲的吸附比例也呈现下降趋势。无镉条件下,湖泊表层沉积物对菲的吸附比例下降幅度大于有镉条件下湖泊表层沉积物对菲的吸附比例下降幅度。pH值由8升至10时,湖泊表层沉积物对菲的吸附比例下降趋势更明显;pH值=10时,无镉和有镉条件下,溶液中菲的浓度分别升至1.81、1.76 mg/L,吸附比例分别下降9.37%、8.7%;高pH值条件下,溶液中是否有镉对湖泊表层沉积物吸附菲的影响减弱。由上可知,湖泊表层沉积物对菲的吸附随着环境pH的升高而减弱,导致湖泊表层沉积物对菲的解吸,菲由湖泊表层沉积物逐渐转移到溶液中。

图5 不同pH条件下溶液中菲的含量及吸附比例变化曲线Fig.5 Variation Curves of Phenanthrene Content and Adsorption Ratio in Solution under Different pH Value
虽然外界环境的pH变化不改变菲的形态,但是外界环境的pH变化影响湖泊表层沉积物的形态和极性,低pH条件下湖泊表层沉积物易于吸附水体中的菲[19,22]。酸性环境会破坏湖泊表层沉积物中无机组分的部分结构,使得样品中有机组分更易与溶液环境接触,增强了湖泊表层沉积物中有机质的异质性,有机质异质性的增强强化了湖泊表层沉积物对菲的吸附。水体环境的pH值增大至10,镉会产生沉淀,影响表层沉积物对菲的吸附[9,23],因此,在pH值低时,表层沉积物对菲的吸附能力强。
3 结论
(1)水体中镉的存在小幅度提高了湖泊表层沉积物对菲的吸附量。拟一级动力学方程和拟二级动力学方程均能很好地拟合湖泊表层沉积物对菲的吸附过程,表明湖泊表层沉积物对菲的吸附过程既受物理扩散作用控制,又受以电子共用或转移的化学吸附机理控制。湖泊表层沉积物对菲的吸附作用在试验前3 h以物理吸附作用为主,因而反应速率较快。
(2)含镉的湖泊表层沉积物对菲的解吸程度低于不含镉的湖泊表层沉积物对菲的解吸程度,表明镉与湖泊表层沉积物中官能团发生的络合作用强化了对菲的化学吸附,溶液中的菲与沉积物结合产生新的有机复合物,不再被解吸。湖泊表层沉积物对菲的解吸,试验前3 h的解吸速率较快,表明前3 h解吸的菲是通过物理吸附作用与表层沉积物结合的。湖泊表层沉积物对菲的吸附解吸达到动态平衡的时间为24 h,试验前3 h沉积物对菲的吸附以物理吸附作用为主,3 h后沉积物对菲的吸附以化学吸附作用为主。
(3)等温状态下,湖泊表层沉积物对菲的吸附可用Freundlich方程拟合,表明湖泊表层沉积物对菲的吸附作用很强,表层沉积物对菲的吸附力既有物理吸附力又有化学吸附力,这符合湖泊表层沉积物吸附菲的动力学分析。湖泊表层沉积物的过量投加可以有效降低水体环境的菲浓度。
(4)环境pH的升高降低了湖泊表层沉积物对菲的吸附能力,湖泊表层沉积物对菲的吸附比例随外界环境pH的升高而降低。当pH值=10时,表层沉积物对菲的吸附比例仍高于80%,可见pH对湖泊表层沉积物吸附菲的影响是有一定限度的。
