基于生物信息学数据库探讨FOXO3基因在膀胱癌中的表达及临床意义
2020-10-19李兰兰卢建中刘善辉付生军
陶 燕,李兰兰,卢建中,刘善辉,付生军,张 静
(兰州大学第二医院,甘肃省泌尿系统疾病研究重点实验室/甘肃省泌尿系临床医学中心,甘肃 兰州 730030)
膀胱癌(bladder cancer,BLCA)是全球常见的泌尿系统恶性肿瘤之一。根据美国癌症协会的统计,在美国膀胱癌预计占所有新发癌症病例的5%,占所有癌症死亡人数的3%;预计2020 年膀胱癌发病率占泌尿系癌症的第2 位;膀胱癌患者的5 年存活率仅为14%[1]。膀胱癌一般分为两类:浅表性膀胱癌和肌层浸润性膀胱癌。尽管目前可用根治性膀胱切除术和新辅助化疗治疗膀胱癌,但由于其复发性高,预后依然比较差[2]。因此,迫切需要寻找对膀胱癌诊断和治疗更有效的生物标志物。
近年来的研究发现叉头转录蛋白O亚族(subfamily O of forkhead box transcription factors,FOXO)通过对转录过程的特异性激活参与调节细胞周期进程、能量代谢及肿瘤发生,FOXO 功能失调将导致细胞增殖失控和DNA 损伤积累,从而产生致癌作用[3]。其中FOXO3(或FOXO3a)是FOXO 亚家族中的重要成员之一,其与细胞凋亡、自噬、细胞周期、氧化应激、细胞分化、机体代谢和免疫应答等有重要关系[4]。研究表明FOXO3在多种肿瘤组织中异常表达,并与恶性肿瘤的不良预后密切相关[5-7]。本研究通过多种生物信息学数据库挖掘FOXO3 在膀胱癌中的表达及相关信息,以探讨其在膀胱癌中的表达及临床意义。
1 材料与方法
1.1 GEPIA数据收集与分析
通过GEPIA 基因表达谱动态分析数据库(http://gepia.cancer-pku.cn/index.html)[8]分析 FOXO3 在膀胱癌中的表达情况。GEPIA 是基于癌症基因组图谱(TCGA)和GTEx项目的9 736个肿瘤样本和8 587个正常样本进行数据分析。通过GEPIA数据库也可以进行一般的生存曲线分析,包括总生存率(overall survival,OS)和无疾病生存率(disease-free survival,DFS)。此外GEPIA 还可以分析目标基因与某些免疫检查点基因表达的相关性。
1.2 UALCAN数据库分析
利用UALCAN 数据库(http://ualcan.path.uab.edu/)[9]分析FOXO3 在膀胱癌中的表达以及FOXO3 表达与淋巴结转移的关系。UALCAN 是一个有效的癌症数据在线分析和挖掘的数据库,主要是基于TCGA 数据库中的相关癌症数据进行分析。
1.3 TIMER数据库分析
通过TIMER 数据库(https://cistrome.shinyapps.io/timer/)[10]中的基因模块分析膀胱癌中FOXO3 表达与免疫细胞浸润水平的相关性。TIMER 数据库涵盖了TCGA中的32种肿瘤,共计10 897个样本。TIMER数据库中分析的免疫细胞包括B 细胞、CD8+T 细胞、CD4+T细胞、中性粒细胞、巨噬细胞和树突状细胞。
1.4 String数据库分析
利用String数据库探索蛋白间相互作用。String数据库是由已知蛋白质和预测蛋白质之间相互作用的数据组成的数据库,包括直接的相互作用和间接的相互作用。本研究通过使用String 数据库分析FOXO3 蛋白-蛋白相互作用(protein-protein interaction,PPI),在数据库中输入“FOXO3”,物种类型选择“Homo sapiens”,置信度选择“Medium 0.400”,相互作用最大数选择10。
1.5 统计学分析
利用GEPIA数据库绘制生存曲线,两组比较采用Log-rank 检验。通过GEPIA 数据库基因分析工具中的Correlation 模块,利用 Pearson、Spearman 和 Kendall 方法对给定的TCGA和GTEx表达数据进行成对基因表达相关分析。通过TIMER 数据库中的Gene 模块分析FOXO3基因与免疫浸润水平的关系。以α=0.05为检验水准。
2 结 果
2.1 FOXO3基因在膀胱癌中的表达
通过GEPIA 数据库分析了FOXO3 在膀胱癌中的mRNA表达水平。结果发现FOXO3 mRNA在膀胱癌组织中的表达明显低于正常膀胱组织(P<0.01,图1)。
2.2 FOXO3基因在膀胱癌中的预后分析
通过GEPIA数据库分析了FOXO3与膀胱癌患者的预后关系,结果显示FOXO3 高表达组患者总生存率(OS)和无疾病生存率(DFS)较FOXO3低表达组显著降低(OS:HR=1.4,P<0.05;DFS:HR=1.5,P<0.05),见图2,表明FOXO3 高表达与膀胱癌患者预后不良相关。
2.3 FOXO3在膀胱癌中的表达与淋巴结转移的关系
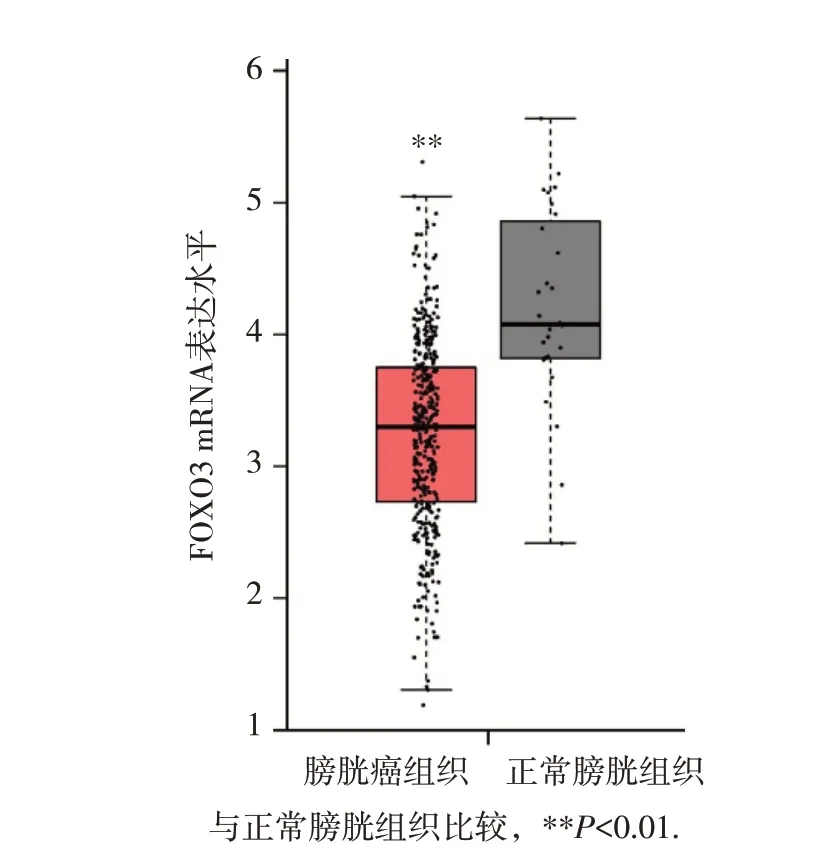
图1 FOXO3 mRNA在膀胱癌中的表达
通过UALCAN 数据库分析FOXO3 mRNA 表达水平与膀胱癌淋巴结转移的关系,结果表明FOXO3在膀胱癌无淋巴结转移组(N0)和淋巴结转移组(N1,N2,N3)的表达均显著低于正常膀胱组织(P<0.01),见图3。而 FOXO3 在 N0 与 N1、N2、N3 之间的表达差异无统计学意义,这说明FOXO3在膀胱癌中的表达水平与肿瘤是否发生淋巴结转移并无显著相关关系。
2.4 FOXO3在膀胱癌中的表达与免疫细胞浸润的关系
通过TIMER 数据库分析得到FOXO3 表达与膀胱癌免疫细胞浸润的相关性结果,表明FOXO3基因表达与细胞纯度无明显相关性,与B 细胞(r=0.133,P<0.05)、CD8+T细胞(r=0.262,P<0.01)、CD4+T细胞(r=0.12,P<0.05)、巨噬细胞(macrophages)(r=0.252,P<0.01)、中性粒细胞(neutrophils)(r=0.242,P<0.01)、树突状细胞(dendritic cells,DC)(r=0.162,P<0.01)的免疫浸润水平呈显著正相关(图4)。这提示FOXO3 有可能参与膀胱癌细胞的免疫浸润过程。
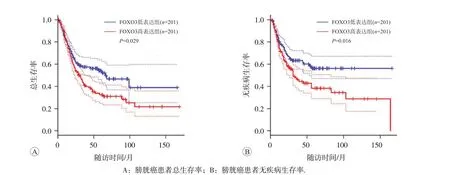
图2 GEPIA数据库分析FOXO3对膀胱癌患者总生存率和无疾病生存率的影响
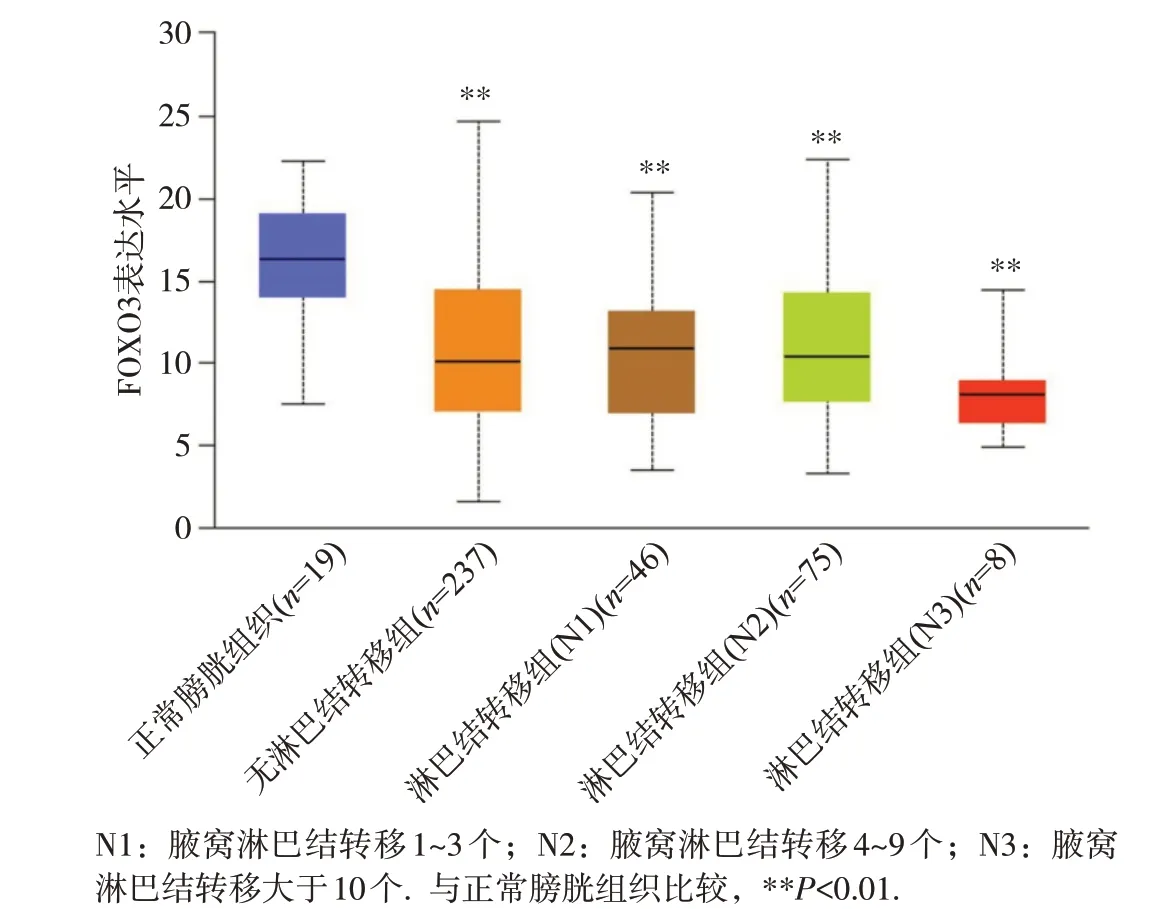
图3 FOXO3在膀胱癌中的表达与淋巴结转移的关系
同时我们收集了常见的40 多个免疫检查点基因,通过GEPIA 数据库的单基因分析工具中Correlation 模块分析了FOXO3基因表达与膀胱癌中免疫检查点基因表达水平的关系,发现FOXO3基因与NRP1(r=0.16,P<0.01)、 CD200R1(r=0.17,P<0.01)、 CD276(r=0.096,P<0.05)、CD1604(r=0.17,P<0.05)4 个免疫检查点基因的表达水平有显著的正相关性(图5)。
2.5 FOXO3基因的表达与DNA错配修复系统基因突变的关系
我们通过Sangerbox 单基因数据分析平台,利用TCGA 的表达谱数据评估了5 个错配修复系统(mismatch repairs,MMRs)基因:MLH1、MSH2、MSH6、PMS2、EPCAM突变与FOXO3基因表达的关系。结果显示:在包括膀胱癌在内的多数肿瘤中,FOXO3基因表达与MMRs基因的突变均呈现显著正相关(P<0.05或P<0.01),图6。
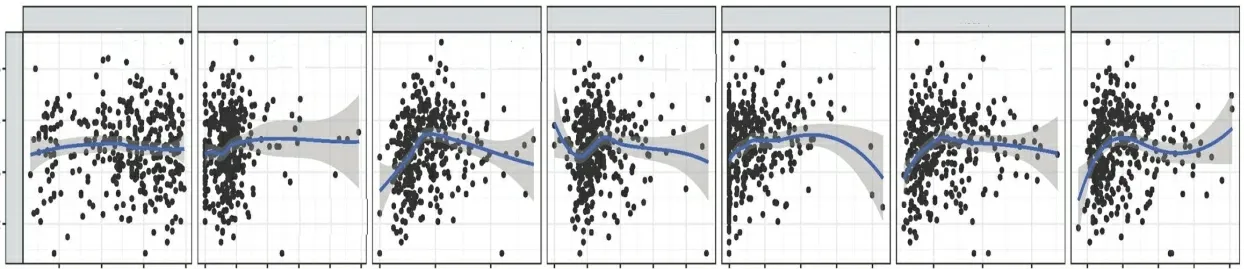
图4 FOXO3表达与膀胱癌免疫细胞浸润的关系

图6 FOXO3表达与DNA错配修复系统基因表达的相关性
2.6 FOXO3蛋白相互作用网络
String数据库中使用PPI网络分析,得到具有11个节点数的FOXO3 蛋白互作网络(图7),其中与FOXO3相 互 作 用 的 蛋 白 (score>0.900)包 括 AKT1、 SIRT1、EP300、 BCL2L11、 SOD2、 SGK1、 AKT2、 CREBBP、CDKN1B、SMAD4,大多数均参与细胞增殖、细胞凋亡、细胞自噬和细胞代谢等生理功能。
3 讨 论

图7 FOXO3蛋白相关的PPI网络图
膀胱癌具有较高的发病率和病死率,早期发现、诊断、治疗和预后预测可以显著改善患者的生命质量。目前对膀胱癌的手术、放化疗等综合治疗已获得相当的疗效,但存在手术治疗复发率高、放疗和化疗不良反应较大、放化疗耐药和转移、预后差等问题,因此急需开展新的研究,发现有效的诊断标志物和诊断方法。
FOX转录因子家族通过对转录过程的特异性激活参与调节细胞周期进程、能量代谢及肿瘤发生[3]。在FOXO 亚家族中研究最多的是FOXO3,研究发现FOXO3的表达水平与多种肿瘤密切相关。与正常和良性肿瘤组织相比,高级别前列腺癌中FOXO3的表达和活性均受到抑制[11];AN等[12]发现SIRT1-AMPK/FOXO3信号通路在逆转胃癌的化学抗性和肿瘤干细胞特性方面具有重要作用;LIU 等[13]发现FOXO3 可以通过抑制Nrf2/TR1 信号通路和增加细胞内活性氧的水平来逆转结肠癌对5-氟尿嘧啶的耐药性;同时也有研究发现FOXO3高表达与胶质母细胞瘤的进展有关,且其预后较差[14]。
FOXO3与膀胱癌的相关研究日益受到关注。本研究通过GEPIA数据库分析发现FOXO3在膀胱癌组织的表达低于正常组织,这与相关文献[15]通过免疫组织化学实验得到的“FOXO3在膀胱癌组织中的表达低于其癌旁组织”结论是相符的。另外还有研究报道肿瘤抑制基因Nkx2.8通过上调FOXO3 的表达能够抑制膀胱癌细胞的增殖[16];Polyphyllin I 可通过激活FOXO3 信号传导途径抑制膀胱肿瘤生长[17]。以上研究表明,FOXO3 信号途径与膀胱癌的发生发展密切相关,FOXO3在膀胱癌组织中低表达使其有望作为膀胱癌的诊断标志物。我们进一步利用GEPIA数据库进行生存分析,发现膀胱癌患者中FOXO3高表达组患者总生存率和无疾病生存率较FOXO3低表达组显著降低,提示其表达与患者预后密切相关。通过UALCAN数据库分析发现FOXO3在膀胱癌无淋巴结转移组(N0)和淋巴结转移组(N1,N2,N3)之间的表达差异无统计学意义,表明FOXO3在膀胱癌患者中的低表达与肿瘤是否发生淋巴结转移没有特定的关系。
肿瘤免疫微环境在肿瘤的发生发展过程中具有重要作用[18]。本研究利用TIMER数据库分析发现FOXO3基因表达与B细胞、CD4+T细胞、CD8+T细胞、树突状细胞、巨噬细胞和中性粒细胞的免疫浸润水平均有显著的正相关性,表明FOXO3有可能参与膀胱癌细胞的免疫浸润过程。有文献[19]报道FOXO1能促进B细胞的分化、增殖、存活,但FOXO3 对B 细胞的作用不大,这与数据库的分析结果不一致,所以非常有必要深入研究FOXO3与这些免疫细胞浸润水平的关系。进一步在GEPIA平台分析发现在膀胱癌中FOXO3基因与NRP1、CD200R1、CD276、CD160这 4 个免疫检查点基因的表达水平有显著正相关性。因此关注FOXO3表达与免疫检查点基因表达水平的关系可以为膀胱癌免疫治疗提供新的方向。此外,MMRs 为细胞内的错配修复机制,该机制的关键基因功能丧失会导致DNA复制错误无法被修复,进而导致较高的体细胞突变的产生[20]。我们利用TCGA 表达谱数据分析发现FOXO3 表达与膀胱癌细胞中5 个错配修复基因(MLH1、MSH2、MSH6、PMS2、EPCAM)突变有显著正相关性。这也为FOXO3在膀胱癌的研究提供了新思路。
FOXO3 信号途径参与多种肿瘤的发生发展过程。我们使用String 数据库预测与FOXO3 相互作用的蛋白,这些蛋白主要有AKT1、SIRT1、EP300、BCL2L11、SOD2、SGK1、AKT2、CREBBP、CDKN1B、SMAD4。其中,AKT 可抑制FOXO3 的转录活性,导致FOXO3向核外转移并被泛素-蛋白酶体途径降解,从而抑制前列腺癌细胞凋亡[21],表明靶向AKT 信号可以促进肿瘤细胞的凋亡。在膀胱癌中,microRNA-608可以通过激活AKT/FOXO3 信号诱导细胞周期阻滞于G1 期来抑制癌细胞的增殖[22]。此外,SIRT1 低表达与胃癌患者预后不良有关,SIRT1 通过激活AMPK/FOXO3 信号途径抑制肿瘤细胞化疗耐药[12];在乳腺癌细胞中过表达EP300能够上调FOXO3的活性,从而增加细胞对拉帕替尼的敏感性[23];在前列腺癌细胞中,FOXO3位点的磷酸化可以抑制SGK1 诱导的细胞自噬和凋亡[24]。FOXO3与部分蛋白分子的关系是在非肿瘤模型中进行的,如在哺乳动物卵巢中,FOXO3通过促进卵巢颗粒细胞凋亡来调节卵泡闭锁和卵泡生长,FOXO3表达下调会降低促凋亡因子BCL2L11 的mRNA 水平[25];在骨性关节炎模型中,FOXO3 过表达可诱导SOD2 和过氧化氢酶的表达,从而抑制软骨损伤的发展[26];FOXO3还可通过激活CDKN1B(p27kip1)的表达来调节成年大鼠脊髓损伤后的再生[27]。膀胱癌中FOXO3与这些蛋白分子之间的相互作用鲜有报道,它们的具体作用机制需要进一步实验验证。
综上所述,本研究通过对生物信息学数据库的挖掘,发现FOXO3在膀胱癌组织中呈低表达,肿瘤患者中高表达与患者的不良预后密切相关;FOXO3有可能参与膀胱癌细胞免疫浸润过程,并与部分免疫检查点基因的表达水平有显著正相关性;FOXO3表达与DNA错配修复基因的突变关系密切;FOXO3通过与其他蛋白的相互作用参与细胞增殖、凋亡、自噬和代谢等过程。这些表明FOXO3有望成为膀胱癌的诊断标志物和治疗靶标。FOXO3作为一个潜在的抑癌基因,有必要深入研究该基因在膀胱癌中的作用机制和功能,以期为FOXO3在膀胱癌中的靶向治疗提供理论基础。
