营养状态与鼻咽癌患者同步放化疗预后的关系
2020-10-17赵伟张华颖赖浩林源
赵伟张华颖赖浩林源
鼻咽癌是我国最常见的恶性肿瘤之一,特别是在我国南方,发病率占我国头颈部肿瘤60%以上,发病率高达10/10万~30/10万[1]。放疗是鼻咽癌的首选治疗方案,对于局部晚期鼻咽癌,放疗联合化疗的综合治疗方案是标准的治疗方式。然而,同步化疗不仅可加重放疗引起的急性毒副反应,且引起的胃肠道反应和骨髓抑制可进一步导致患者进食减少,营养丢失和消耗,在消耗增多和摄入减少的双重作用下,引起营养不良[2]。近年来在放化疗过程中发现大多患者处于异常的营养和代谢状态,导致营养不良并最终影响治疗效果。因此,深入了解和分析鼻咽癌患者同步放化疗过程中的营养状况,对预防和治疗鼻咽癌患者的营养不良具有重要意义。本研究观察鼻咽癌患者同步放化疗前中后的营养状况评分变化及其与临床病理特征的关系,以期评价营养状况与预后的关系,为有效预防和纠正营养不良,改善预后提供理论基础。
1 资料与方法
1.1 研究对象
收集2010年8月至2011年12月于广西医科大学附属肿瘤医院接受根治性调强放疗联合同步化疗的初治鼻咽癌患者。纳入标准:⑴经病理组织学确诊为非角化性鼻咽癌;⑵治疗前未接受手术、化疗、放疗、免疫治疗等抗肿瘤治疗;⑶KPS≥70分;⑷临床分期(鼻咽癌2010年第7版UICC/AJCC分期标准)Ⅰ~Ⅳb期;⑸无严重的内分泌疾病、营养代谢疾病和消化系统疾病病史;⑹无严重心、肺、肝、肾脏疾病;⑺血生化检查:总胆红素、谷草转氨酶和谷丙转氨酶≤正常值上限的1.5倍;肌酐清除率≥30 mL/min;⑻MRI图像资料以及相应营养学评估等临床资料完整。排除标准:⑴有远处转移或患有其他恶性肿瘤的患者;⑵治疗结束后3个月内失访的患者;⑶有活动性的全身感染;⑷有严重的慢性消耗性疾病患者;⑸妊娠、哺乳期女性;⑹同时接受其他慢性系统性的激素治疗或免疫治疗;⑺严重的合并症,如无法控制的糖尿病和高血压等。
1.2 治疗方法
所有患者鼻咽和颈部采用全程调强适形放疗技术,临床靶区(clinical target volume,CTV)根据受累程度不同分为高危临床靶区(CTV1)和低危临床靶区(CTV2)。CTV1为鼻GTVnx外扩5~10 mm(根据邻近的解剖结构调整外扩距离,需包括全部鼻咽部黏膜以及黏膜下0.5 cm)。CTV2为CTV1外扩5~10 mm,需包括颈部淋巴引流区。计划靶区(planning tumor volume,PTV)包括治疗过程中的摆位误差和器官运动,分别为GTVnx、GTVnd、CTV1 和 CTV2 外扩 3 mm。外照射每天1次,每周5次。各靶区处方剂量:PGTVnx和PGTVnd剂量分割模式为总剂量70.00~73.00 Gy,分次剂量 2.12~2.39 Gy;PCTVnd 60.00~66.00 Gy,分次剂量 2.00~2.10 Gy;PCTV1 总剂量60.00 Gy,分次剂量 2.00 Gy;PCTV2 总剂量 54.00 Gy,分次剂量1.80 Gy。同步化疗方案:单药顺铂化疗,顺铂100 mg/m2d1,d22和(或)d43给药,静脉滴注,共2~3个疗程。治疗过程中按临床医师常规方式处理,自行进食,全程无专业营养师参与。患者若反应严重、进食明显减少时给予葡萄糖、氨基酸、脂肪乳和水溶性维生素等肠外营养,并根据患者情况调整;所有患者均未进行肠内营养支持、入鼻饲、胃造瘘等。
1.3 观察指标
收集患者一般特征包括性别、年龄、同步化疗、体重、体质指数(BMI)、伴随疾病、吸烟习惯、饮酒史和营养支持情况等,肿瘤情况包括TNM分期,分化程度,肿瘤体积以及侵犯的部位等。
放疗前1周(治疗前),放疗第4周(治疗中期)和放疗结束时分别评估血液学指标(总蛋白、白蛋白、球蛋白、铁蛋白、肌酐、尿素氮、血小板、白细胞、中性粒细胞计数、淋巴细胞计数、红细胞、血红蛋白),同时采用欧洲肠外肠内营养协会(ESPEN)于2002年推出的用于成年住院患者营养风险筛查工具(nutritional risk screening 2002,NRS2002)以及患者提供的主观整体营养状况评估(patient-generated subjective global assessment,PG-SGA)量表评价营养状况。NRS2002 量表总评分≥3分者,说明存在营养风险,给予营养支持;<3分者定期复查营养风险筛查。PG-SGA量表总体评估A级(0~1分)为营养良好,不需营养干预,保持随诊;B级(2~8分)为可疑或中度营养不良,进行营养教育并干预;C级(>9分)为重度营养不良,急需进行症状改善及营养干预。
1.4 随访
治疗结束后,前2年每3个月随访1次,第3~4年每半年随访1次,之后每年随访1次,随访截至2016年12月。研究终点为总生存期(overall survival,OS)、及远处无转移生存期(distant metastasis-free survival,DMFS)。OS定义为治疗开始至死亡或随访结束的间隔时间;DMFS定义为从治疗开始至首次发生远处转移的间隔时间。
1.5 统计学分析
统计分析釆用SPSS 22.0软件。采用Pearson相关分析和Spearman秩相关分析血液学指标与PG-SGA评分的关系。采用单因素方差分析(one-way ANOVA)对计量资料进行差异性分析,采用LSD-t检验进行两两比较。采用χ2检验对分类资料进行差异性分析。生存分析釆用Kaplan-Meier法和Log-rank检验。釆用双侧检验,以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
共134例患者符合标准纳入本研究,其中男性104例,女性30例,中位年龄为42岁(范围:17~77岁),其余临床资料见表1。
2.2 鼻咽癌患者放化疗过程中营养状况评分的变化
治疗前,治疗中期和治疗结束时NRS2002评分≥3分的患者所占比例分别为30.60%(41/134),75.37%(101/134),85.82%(115/134),差异有统计学意义(P<0.001),见表 2。
PG-SGA量表评估结果显示,治疗前、治疗中期和治疗结束时C级和B级患者所占比例均逐渐增加,且放疗中期以及放疗结束时的所占比例均较治疗前明显增加,3个时间段C级和B级患者所占比例比较差异均有统计学意义(P<0.001)。见表3。
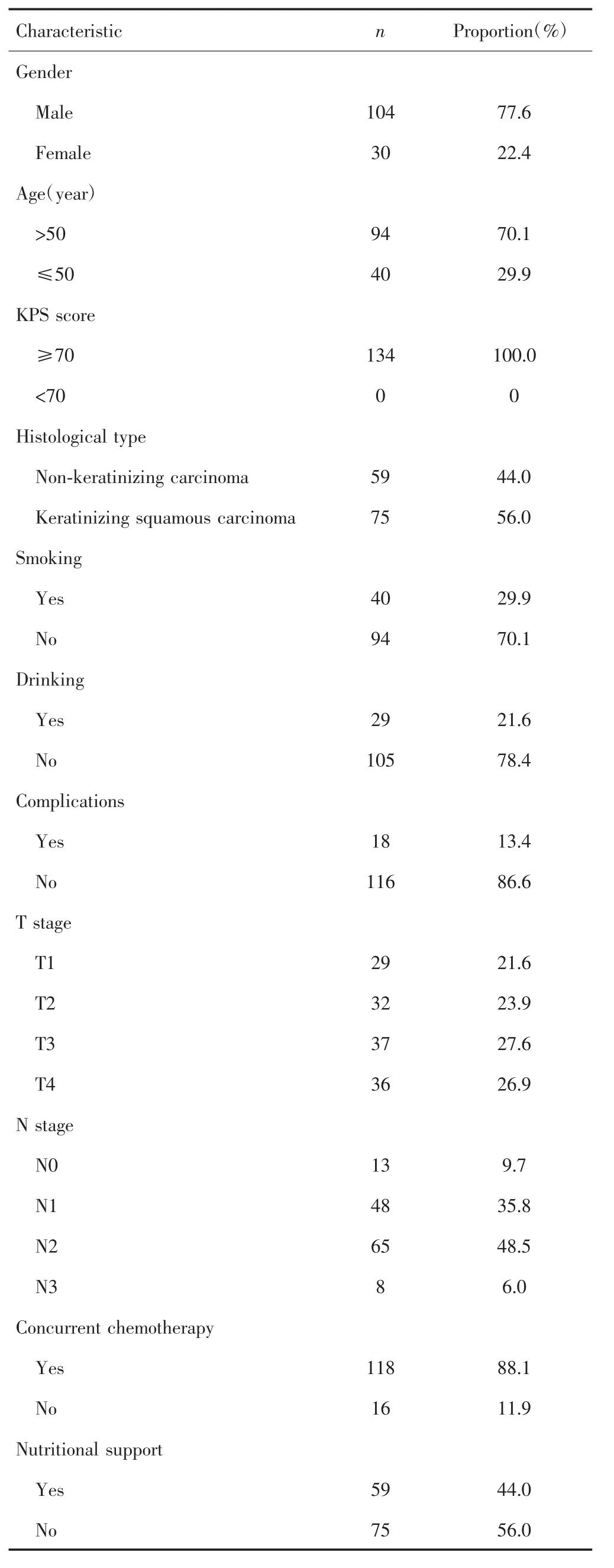
表1 134例鼻咽癌患者的基线资料Tab.1 Baseline data of 134 patients with nasopharyngeal carcinoma
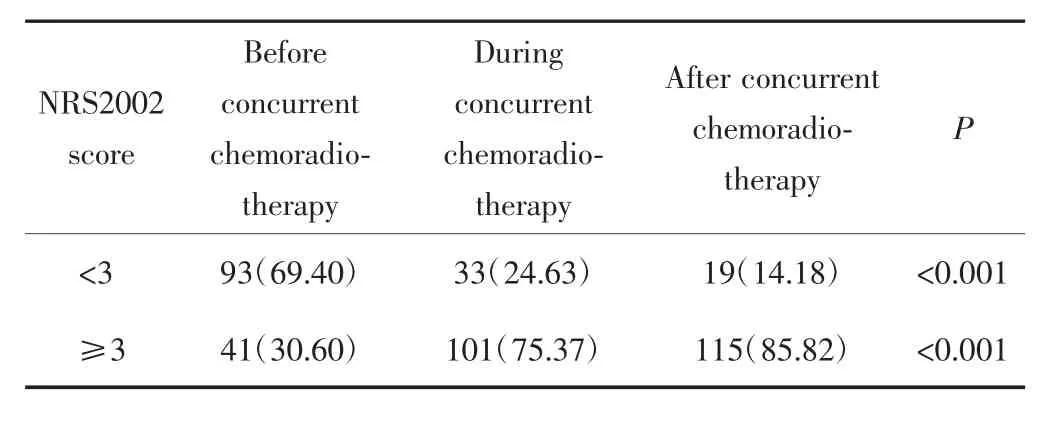
表2 鼻咽癌患者同步放化疗前、中、后NRS2002评分情况[n(%)]Tab.2 NRS2002 scores of NPC patients before,during and after concurrent chemoradiotherapy[n(%)]

表3 鼻咽癌患者同步放化疗前、中、后PG-SGA评分情况[n(%)]Tab.3 PG-SGA scores of NPC patients before,during and after concurrent chemoradiotherapy[n(%)]
2.3 治疗后的营养状况与患者临床病理特征的关系
PG-SGA评分与性别、年龄、疾病史、吸烟、饮酒、分化程度等无相关性(P>0.05),与T分期、N分、肿瘤体积以及各侵犯部位均与PG-SGA评分呈正相关(均P<0.05)。见表 4。
2.4 不同营养状况患者的生存分析
根据PG-SGA评分分为3组:营养良好组(0~1分)、可疑或中度营养不良组(2~8分),重度营养不良组(≥9分)。结果显示,治疗前3组5年OS分别为100%,89.1%和80.0%,差异有统计学意义(P<0.001);治疗中 5年 OS分别为93.8%,83.8%和 60.5%,差异有统计学意义(P<0.001);治疗后5年OS分别为100.0%,84.0%和 54.3%,差异有统计学意义(P<0.001)。见图 1。
治疗前3组5年DMFS分别为100%,92.6%和80.0%,差异有统计学意义(P<0.001);治疗中 5年DMFS分别为93.8%,88.8%和75.8%,差异有统计学意义(P<0.001);治疗后 5年DMFS分别为 100.0%,90.1%和57.1%,差异亦有统计学意义(P<0.001)。见图2。

表4 治疗后PG-SGA评分与患者临床病理特征的关系Tab.4 Correlation of PG-SGA score and clinicopathological characteristics of patients after treatment

图1 不同治疗时期患者的5年OS生存曲线Fig.1 5-year OS survival curves of patients in different treatment periods

图2 不同治疗时期患者的5年DMFS生存曲线Fig.2 5-year DMFS survival curves of patients in different treatment periods
3 讨论
鼻咽癌患者治疗前后存在一定程度的营养不良,降低了放化疗的耐受性和依从性,影响疗效和生活质量[3]。癌症患者易发生营养不良,尤其是晚期患者营养不良发生率高达40%~80%,其中头颈部肿瘤患者发生率更高[4]。张海荣等[5]采用营养指数模型对104例接受调强放疗的鼻咽癌患者进行评价,结果显示放疗前后鼻咽癌患者营养不良发生率分别为 6.73%和69.23%,表明放疗后鼻咽癌患者营养状况较放疗前明显恶化。本研究分别采用NRS2002和PG-SGA量表对鼻咽癌患者治疗前中后3个阶段进行进行营养状况评估,结果发现,治疗前有将近30.60%的患者存在营养不良风险,47.01%的患者需要营养干预及针对症状的治疗手段;至治疗第4周以及放疗结束时,具有营养不良风险的患者及需要进行干预和纠正的患者持续增加,其中治疗中期75.37%的患者伴营养不良风险,76.87%的患者需要进行干预和纠正;至治疗结束时具有营养不良风险的患者达85.05%,91.05%的患者营养状态下降到中重度营养不良,说明在同步放化疗前鼻咽癌患者已存在较高的营养不良风险,且在治疗过程中营养状况持续恶化,因此鼻咽癌患者一经诊断应积极给予营养评估,尤其应加强关注治疗过程中以及治疗结束时患者的营养状态,以及时采取营养干预及针对症状的治疗手段。
如前所述,鼻咽癌患者不管在治疗前,还是治疗过程中均存在较高的营养不良风险,已成为影响患者治疗耐受性和效果不可忽视的因素之一。但是由于营养不良发生的机制复杂,包括患者一般情况、肿瘤本身因素及治疗等因素的影响,因此对于引起营养不良的原因目前尚没有明确的循证医学证据。鉴于多项研究报道PG-SGA较NRS2002更能有效全面地反映非手术肿瘤患者的营养状态,是评价肿瘤患者营养状况和预后较好的工具[6-7]。因此,本研究进一步分析治疗结束时PG-SGA定量评分与患者临床病理特征的相关性,结果显示,PG-SGA定量评分与T分期、N分期、肿瘤体积以及各侵犯部位均呈正相关,说明这些特征在患者营养不良的发生中有其独特作用。考虑这些因素与营养不良发生有关的原因:⑴肿瘤体积方面,随着肿瘤体积增大,机体代谢异常、炎性反应、胰岛素抵抗和负氮平衡肿瘤愈明显[8-9],合成代谢降低,能量消耗增加,从而导致营养不良。⑵鼻咽癌患者T分期与肿瘤侵犯部位和体积均有一定联系,T分期较晚往往提示肿瘤体积更大,侵犯部位和器官更多,放疗照射范围更广,照射剂量更高,尤其对上消化道和唾液腺的照射损伤更严重;较高的N分期意味着颈部淋巴结需接受更多的放射剂量,同时腮腺和颌下腺照射剂量更高,这些因素可导致患者口腔和咽喉部急性毒副反应加重,进一步影响患者食欲,从而造成营养不良[7,10]。本研究中腭肌/椎前肌、口咽、颅底骨质、翼腭窝、鼻旁窦、颅内、翼内肌等侵犯部位与PG-SGA定量评分显示了中-高度相关性,因此认为这3个因素之间相互联系而导致营养不良发生[11]。但是,本研究中肿瘤N分期与PG-SGA定量评分呈弱相关,因此肿瘤N分期与营养状况的关系尚需要进一步研究。此外,值得注意的是,本研究虽然发现性别、年龄、疾病史、吸烟、饮酒、分化程度与PG-SGA评分呈负相关,但均无统计学意义,这一结论除了年龄因素外,与既往多项研究不一致[8-9]。分析原因可能与各研究采用的营养评价工具不同有关,既往研究中主要BMI、体重或生活质量评分(QOL)进行营养不良评价,而本研究采用PG-SGA评价系统。
目前已有大量研究报道影响鼻咽癌放化疗后的预后因素,包括患者一般情况[12],如年龄、性别、KPS评分,吸烟和饮酒;肿瘤相关的因素的影响,如临床分期[13]、原发肿瘤体积与直径[14-15]、组织病理类型、EBV DNA[16],但尚未形成统一认识。然而营养状况对鼻咽癌患者预后影响的研究较少,且主要集中于体重和血液学指标如 BMI[17],贫血,血清白蛋白[18]等研究。因此本研究进一步随访观察并分析PG-SGA评分对预后的影响,结果发现,生存组患者治疗前中后NRS2002评分≥3分患者所占比例、PG-SGA定量评分较死亡组患者升高,而白蛋白、红细胞、血红蛋白水平较死亡组患者降低;同时不管在治疗前,还是治疗中期或治疗结束时,患者的OS和DMFS也均随着营养状况的恶化而缩短。ORELL-KOTIKANGAS等[19]采用PG-SGA评估头颈部肿瘤患者营养状态与预后的关系,亦发现营养不良的患者较无营养不良患者的无病生存期显著缩短(13个月vs 66个月),与本研究结果一致,说明营养状况是影响患者预后的因素,PG-SGA评分能较好地反映同步放化疗鼻咽癌患者的营养状况及预后,在目前临床上尚缺乏能针对性用于恶性肿瘤患者营养评价“金标准”指标的情况下,可将PG-SGA视为评价营养状况和预后的工具。
综上所述,鼻咽癌患者治疗前已存在较高的营养不良风险,且在同步放化疗过程中营养状况和血液学指标表现为持续恶化。肿瘤体积,T分期以及腭肌/椎前肌、口咽、颅底骨质、咀嚼肌间隙、鼻旁窦、颅内侵犯等与鼻咽癌患者的营养状态有关,而营养状态的恶化与不良预后有关。因此,对于PG-SGA评估营养不良的鼻咽癌患者应进行及时的营养支持和干预,以改善患者预后。
