硫酸烧渣酸浸液制备氧化铁红的工艺研究
2020-10-16马雯浩陈凯旋印体健魏腾龙方晓宇王百年
马雯浩,陈凯旋,印体健,魏腾龙,方晓宇,王百年
(合肥工业大学化学与化工学院,安徽合肥230009)
硫酸烧渣是以硫铁矿为原料生产硫酸过程中产生的废渣,据统计,生产1 t硫酸产生0.8~1.5 t的硫酸烧渣[1]。国内硫酸工业每年排放的硫酸烧渣超过700万t,但大部分未得到有效的综合利用,其利用率不到20%[2-3],大多处理方法是填埋或直接堆放,造成资源的严重浪费和大量土地被占用,而且污染生态环境[4]。硫酸烧渣一般呈红色或红棕色,其主要成分为氧化铁,铁元素含量达30%~60%,在铁矿资源日渐匮乏的情况下,硫酸烧渣是极具价值的二次资源[5]。目前我国关于硫酸烧渣的综合利用方式主要有制取铁盐,制备净水剂,回收贵金属,制取铁系颜料如氧化铁黄、铁黑、铁蓝等[6-11]。本文通过酸浸、氧化、沉铁、除杂、煅烧五个工序制备氧化铁红,具有原料易得、生产成本低、生产周期短、能耗较小等优点,是一种对硫酸烧渣的有效综合利用方式,具有重要的研究意义和社会利用价值。
1 实验部分
1.1 实验流程(图1)

图1 硫酸烧渣酸浸液制备氧化铁红的工艺流程
1.2 实验方法
1.2.1 制备硫酸烧渣酸浸液
在实验室前期研究的基础上,选用草酸作为酸浸助剂,加入量为20%(m草酸/m硫酸烧渣),反应温度98℃,硫酸溶液质量浓度50%,搅拌转速200 rpm下连续反应7.5 h,可获得硫酸烧渣酸浸液。原料硫酸烧渣由安徽某企业提供。
1.2.2 氧化铁红的制备
(1)制备粗氢氧化铁:取计量的硫酸烧渣酸浸液,缓慢滴加计量的过氧化氢,持续搅拌,冷却至室温后,加入浓氨水至所需pH值,设定水浴温度条件,沉化数小时后过滤、洗涤,滤饼于80℃下充分干燥,所得褐色样品待测。
(2)氢氧化铁精制:确定沉铁工艺优化条件后,在此条件下重复上述实验步骤,但滤饼不需干燥,直接添加氢氧化钠溶液反应,一定时间后,过滤、洗涤、干燥,所得暗红色样品备用待测。
(3)煅烧制备氧化铁红:取适量上述步骤所得的氢氧化铁样品于瓷坩埚中,设定煅烧温度和时间后,入马弗炉煅烧,随炉冷却,所得红棕色样品待测。
1.3 分析检测方法
实验过程中对溶液或固体样品中的全铁、Fe2+、Al含量采取滴定方法,以及对待测样品的元素和含量进行X射线荧光光谱分析(XRF),对待测样品的物相和结构进行X射线衍射(XRD),操作参考文献[12]。
2 实验结果与讨论
2.1 沉铁工艺单变量条件实验
2.1.1 酸浸液中初始铁离子浓度对铁回收率的影响
在H2O2与Fe2+摩尔比为1,体系pH值为5.2,反应温度为35℃,反应时间为30 min条件下,考查硫酸烧渣酸浸液中不同初始铁离子浓度时的铁回收率,所得实验结果如表1、图2。C0为酸浸液初始铁离子浓度(1.81 mol/L)。
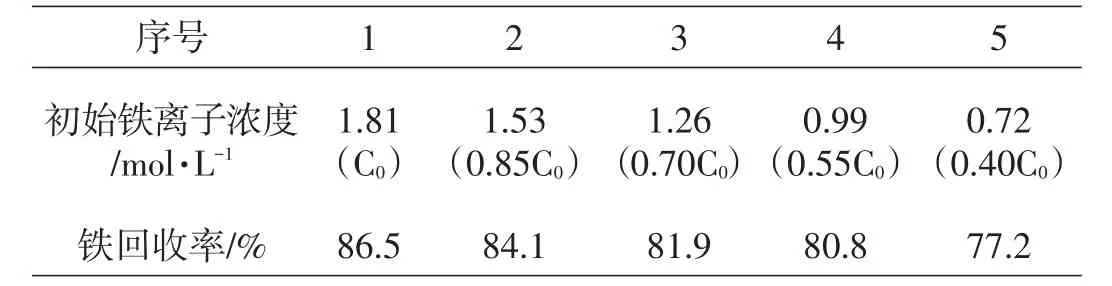
表1 不同初始铁离子浓度时的铁回收率

图2 不同初始铁离子浓度时的铁回收率
由表1和图2可以看出,随着硫酸烧渣酸浸液中初始铁离子浓度的逐渐增大,相应的铁回收率也不断增大。因此,后续实验中选择的酸浸液初始铁离子浓度为1.81 mol/L。
2.1.2 H2O2与Fe2+摩尔比对铁回收率的影响
在酸浸液初始铁离子浓度为1.81 mol/L,体系pH值为5.2,反应温度为35℃,反应时间为30 min条件下,考查不同H2O2与Fe2+摩尔比时的铁回收率,实验结果如表2、图3。
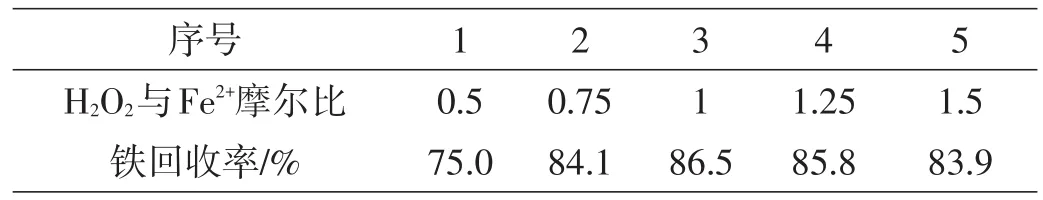
表2 不同H2O2与Fe2+摩尔比时的铁回收率
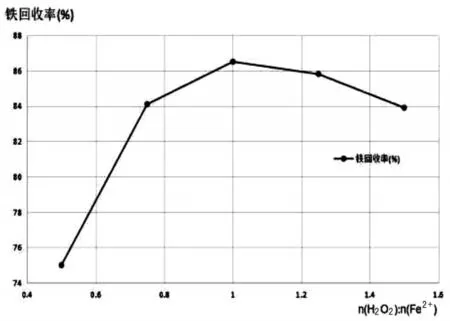
图3 不同H2O2与Fe2+摩尔比时的铁回收率
由表2和图3可以看出,当H2O2与Fe2+摩尔比小于1时,随着H2O2与Fe2+摩尔比的逐渐增加,铁回收率不断增大;当H2O2与Fe2+摩尔比为1时,铁回收率达到最大值为86.5%;当H2O2与Fe2+摩尔比大于1时,铁回收率反而开始降低。因此,后续实验中选择较合适的H2O2与Fe2+摩尔比为1。
2.1.3 体系pH值对铁回收率的影响
在酸浸液初始铁离子浓度为1.81 mol/L,H2O2与Fe2+摩尔比为1,反应温度为35℃,反应时间为30 min条件下,考查不同体系pH值时的铁回收率,所得实验结果如表3、图4。

表3 不同体系pH值时的铁回收率
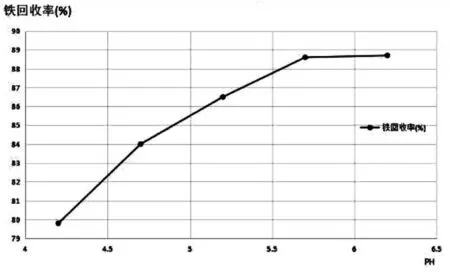
图4 不同体系pH值时的铁回收率
由表3和图4可以看出,在体系pH值小于5.7时,溶液中铁的回收率随着体系pH值的增加而增加;而当体系pH值达到5.7之后,溶液中铁离子的回收率基本不变。分析其可能原因为:随着体系pH值的逐渐变大,酸浸液中的Fe3+不断与OH-结合生成Fe(OH)3沉淀,当pH值达到5.7时,酸浸液中的Fe3+已基本完全沉淀,所以在此之后铁回收率基本不变。考虑到pH值调节剂氨水的使用耗量,后续实验中选择较适宜的体系pH值为5.7。
2.1.4 反应时间对铁回收率的影响
在酸浸液的初始铁离子浓度为1.81 mol/L,H2O2与Fe2+摩尔比为1,体系pH值为5.7,反应温度为35℃条件下,考查不同反应时间下的铁回收率,所得实验结果如表4、图5所示。
由表4和图5可以看到,当反应时间小于2 h,铁回收率随着反应时间的延长而不断增大;当反应时间达到2 h之后,铁回收率基本保持不变。分析其可能的原因是:Fe3+与OH-需要一定的反应时间才能完全转化成Fe(OH)3沉淀,2 h后Fe3+已基本完全沉淀,所以在此之后铁回收率不再随时间发生变化。考虑到经济效益以及反应效率等因素,后续实验的反应时间选择2 h较宜。
2.1.5 反应温度对铁的回收率的影响
在酸浸液初始铁离子浓度为1.81 mol/L,H2O2与Fe2+摩尔比为1,体系pH值为5.7,反应时间为2 h条件下,考查不同反应温度时的铁回收率,所得实验结果如表5、图6所示。

表4 不同反应时间时的铁回收率

图5 不同反应时间时的铁回收率

表5 不同反应温度时的铁回收率
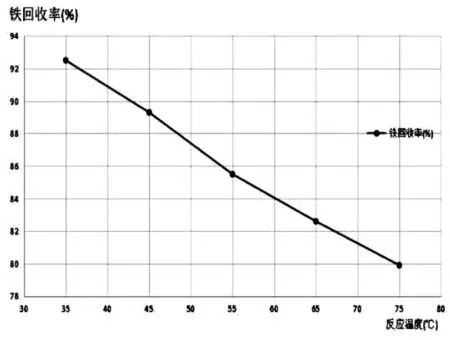
图6 不同反应温度时的铁回收率
由表5和图6可以看到,随着反应温度的逐渐升高,铁的回收率不断减小。分析其可能的原因为:随着温度升高,一方面促进了H2O2的分解,未能充分氧化Fe2+,使得没有足够多的Fe3+与OH-反应产生沉淀;另一方面,高温使得部分氨挥发,氨水浓度减小,促使反应向逆方向进行,Fe(OH)3沉淀减少,从而导致铁的回收率有所下降。因此,较适宜的反应温度为35℃。
2.2 沉铁工艺正交实验
由上述五个单变量条件实验所得出的结果可以看出,H2O2与Fe2+摩尔比、体系pH值、反应温度和反应时间这四个因素对铁回收率均有较明显的影响。因此,进行四因素四水平的正交实验,对沉铁工艺条件进一步优化。正交实验因素水平表如表6所示,回收率结果与极差分析结果如表7所示。

表6 正交实验因素及水平表

表7 正交实验结果与极差分析
由极差分析可知:对沉铁反应中铁回收率的影响显著性水平顺序为:H2O2与Fe2+摩尔比>反应时间>体系pH值>反应温度。
观察表7中因素A的四个K值大小,发现K1为最大值,即铁回收率最高,故A因素的较优水平为表6中的A1;同理,B、C、D因素的较优水平分别为B2、C4、D4,则较优水平组合为A1B2C4D4。因此,正交实验所确定的制备氧化铁红较适宜的沉铁工艺条件为:初始铁离子浓度为1.81 mol/L,H2O2与Fe2+摩尔比为0.9,反应温度为35℃,体系pH值为6.0,反应时间为2.5 h。在此优化条件下三次重复实验,铁回收率平均值为97.5%。所制得的氢氧化铁滤饼经NaOH溶液(0.01 mol/L)搅拌除铝8 min,滤饼中的Al含量降至0.02%,可视为已基本除净。
2.3 氧化铁红的制备
以除杂纯化后的Fe(OH)3滤饼为原料,使用马弗炉加热煅烧制备氧化铁红,以样品色泽和样品中Fe2O3的质量分数为主要考查指标,分别对煅烧温度、煅烧时间进行单变量条件实验并分析数据,确定较优化的煅烧工艺条件。
2.3.1 煅烧温度的影响
设定马弗炉煅烧时间为2 h,考查不同煅烧温度下所得样品的颜色和氧化铁红含量,实验结果如表8、图7。

表8 不同煅烧温度下所制得样品的颜色和氧化铁红含量

图7 不同煅烧温度下所制得样品中氧化铁红的含量
由表8及图7看出,温度为700℃~750℃时,随着煅烧升温,样品中Fe2O3质量分数不断增大;当煅烧温度为750℃时,样品中Fe2O3含量达到最大值96.4%;当煅烧温度进一步升高时,样品中Fe2O3含量反而稍有降低。观察样品颜色可见,750℃下煅烧得到的氧化铁红样品呈红棕色,接近国家技术指标要求,而800℃及更高温度下煅烧制得的样品颜色偏黑且逐渐加深;同时,煅烧温度越高,所需要的热电费用就越高。因此,后续实验的煅烧温度选择为750℃。

图8 不同煅烧温度下的样品XRD图
由图8可以看出,当煅烧温度为700℃~900℃时,随着温度升高,晶体衍射角没变,表明产品物相没有发生变化;衍射峰型形状相似,结晶度高,结构有序,表明煅烧制备得到的产品均是纯度较高的α-Fe2O3。比较700℃和750℃的谱图,可发现750℃的晶体衍射峰较尖锐,峰宽较小,说明晶体的结晶度和Fe2O3的纯度随着温度的升高而逐渐提高;而煅烧温度在800℃~900℃时,峰高、峰宽基本相等,这与表8实验数据规律一致。
2.3.2 煅烧时间的影响
设定煅烧温度为750℃的实验条件下,考查不同煅烧时间下制备所得样品的颜色和氧化铁红含量,所得实验结果如表9、图9所示。

表9 不同煅烧时间下所制得样品的颜色和氧化铁红含量
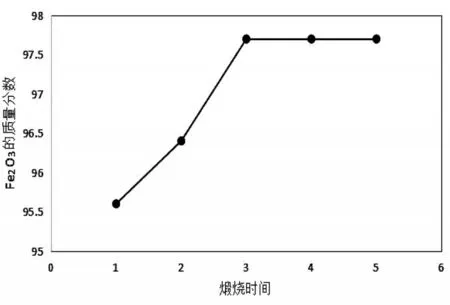
图9 不同煅烧时间下所制得样品中氧化铁红的含量
由表9和图9可以看出,当煅烧时间小于3 h,样品中Fe2O3质量分数随煅烧时间的延长而不断增加;当煅烧时间为3 h,样品中Fe2O3质量分数达到最大值为97.7%;继续延长煅烧时间,样品中Fe2O3质量分数保持不变。不同煅烧时间下所制得样品的颜色均为红棕色,表明煅烧时间的变化对氧化铁红样品颜色的影响较小。由于煅烧时间越长,所需的热电费用就越高,因此确定较合适的煅烧时间为3 h。
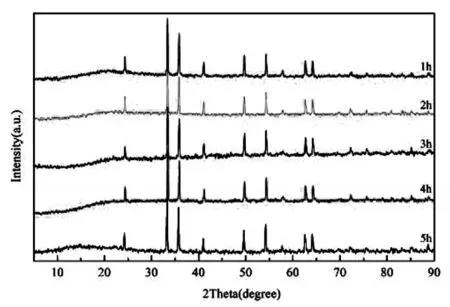
图10 不同煅烧时间的样品XRD图
由图10可以看出,随着煅烧时间的不断增加,晶体衍射峰没有发生明显变化,表明产品物相没有发生改变;衍射峰峰形尖锐,没有杂相衍射峰,表明制得的样品均是纯度较高的α-Fe2O3。当煅烧时间为1~3 h时,晶体衍射峰变化较小;而煅烧时间为3~5 h时,晶体衍射峰的峰高和峰宽基本相等,这与表9实验数据规律一致。
2.4 样品的XRF分析
用XRF分析制备所得氧化铁红产品中的主要氧化物,所得结果如表10所示。

表10 氧化铁红样品的主要氧化物及其含量
3 结论
通过单变量条件实验和正交实验,考查了各种工艺条件对沉铁工艺铁回收率的影响,得到的沉铁工艺优化条件为:硫酸烧渣酸浸液中初始铁离子浓度为1.81mol/L,H2O2与Fe2+摩尔比为0.9,体系pH值为6.0,反应温度为35℃,反应时间为2.5 h,在此优化条件下硫酸烧渣酸浸液中铁的回收率可达97.5%。以氧化铁红质量分数为主要指标,综合考虑样品色泽和成本问题等,最终确定煅烧工艺较合适的煅烧温度为750℃,煅烧时间为3 h。成品中氧化铁红纯度达97.7%,超过国标要求,颜色为红棕色,样品中Al含量可降至0.02%。
