混合营养型马勒姆杯棕鞭藻的重描述及其系统发育分析
2020-10-15马明洋王红霞龚迎春
陈 嫚 马明洋 王红霞 胡 强 龚迎春
(1. 中国科学院水生生物研究所藻类生物技术与生物能源研发中心,武汉 430072; 2. 中国科学院大学,北京 100049)
混合营养型是很多原生生物的一个重要特征,近年来已获得了越来越广泛的关注[1,2]。混合营养型鞭毛藻在水生态系统中广泛存在, 而且是水生态系统中细菌的主要摄食者[3]。马勒姆杯棕鞭藻(Poterioochromonas malhamensis)[4]属于金藻纲(Chrysophyceae)棕鞭藻目(Ochromonadales)棕鞭藻科(Ochromonadaceae)杯棕鞭藻属(Poterioochromonas)[5], 是典型的混合营养型鞭毛藻, 被认为是研究营养型转变[6,7]和其他有趣行为如细胞体积调控[8,9]、摄食特性[10]及抗菌作用[11]的模式生物。此外,P.malhamensis在摄食产毒蓝藻和降解微囊藻毒素中发挥重要作用[12,13], 因此可能具有控制水华的巨大潜能。另外, 近年来有报道指出P. malhamensis是微藻(如小球藻[14,15]和集胞藻[16])的商业化培养中的主要摄食者并造成严重的经济损失。
虽然P. malhamensis具有重要的生态学作用并对微藻产业带来巨大危害, 但它的物种鉴定却十分混乱。Poterioochromonas藻体单细胞, 前端两根不等鞭毛, 叶绿体周生, 光合产物为金藻昆布多糖。具几丁质囊壳, 囊壳由上方的杯形和下方中空的柄组成[4]。由于形态极为相似, 杯棕鞭藻属(Poterioochromonas)常与棕鞭藻属(Ochromonas)混淆, 而囊壳的存在与否是区分Poterioochromonas与Ochromonas的重要特征[17]。P. malhamensis于1952年首次被报道, Pringsheim将其命名为Ochromonas malhamensis[18], 该株系即现在P. malhamensis的模式株SAG933-1a。后来Péterfi利用光学和电子显微镜揭示其存在囊壳结构, 将其重命名为Poterioochromo-nas malhhamensis[19]。此后, 研究报道了许多P.malhamensis或Poterioochromonassp., 它们的来源十分广泛, 如微藻培养系统[14,15], 水华样品[20], 甚至白蚁的消化道内[21]。然而, 已有研究提供的形态学数据非常不完善, 且至今针对该物种一直没有详细全面的形态描述。
对于P. malhamensis的形态鉴定, 其难点是检测几丁质囊壳的存在, 这也是Poterioochromonas属的重要特征[4]。然而, 这个重要的形态学特征在P.malhamensis有些类群的报道中并未被发现, 即使是模式株SAG933-1a[18]。此外, 近年来在微囊藻培养体系中分离的Poterioochromonassp. DO-2004[22]和CCMP2718[23], 还有从苔藓环境中分离到的其他株系[24]等, 也没有观察到囊壳结构, 从而给该类群的鉴定带来很大困惑。因此, 检查P. malhamensis囊壳的有无十分关键。此外, 研究表明Poterioochromonas形态变异性大, 包括细胞大小和形状, 叶绿体的形态和数目, 细胞表面结构, 鞭毛相对身体的长度, 甚至是胞内储存物的数量与种类, 在生长的不同时期或周围的环境或食物发生变化时, 其形态变化很大[25],这些具有高变异性的形态是鉴定P. malhamensis时的又一大难题。因此, 寻找稳定可信的形态特征是对P. malhamensis进行物种鉴定的有效手段。
作为形态高度变化的小型鞭毛藻, 分子数据的引入是对形态学特征的重要补充, 并对其正确的物种鉴定起到关键作用。P. malhamensis的SSU rDNA基因早在1999年就被测序[26], 从而为该物种的准确鉴定提供宝贵的参考信息。然而, 直至目前, 该物种的模式株SAG933-1a却没有被测序, 从而极大限制了该物种的准确鉴定。随着分子生物学方法的快速发展, 越来越多来自环境样品的分子序列被鉴定为Poterioochromonasspp., 但没有任何形态学数据的支撑[27,28], 这对Poterioochromonas的分类学研究造成很大困扰。此外, 大量研究表明许多命名为Ochromonas的物种在进化树中位于Poterioochromonas分支内[25], 也造成了这两个属的分类混淆。
本研究旨在对分离自小球藻的P. malhamensis的形态特征进行全面的形态描述和分子系统发育分析, 并收集模式株SAG933-1a作为参考, 从而对P. malhamensis及相似物种的分类鉴定提供详细的基础信息。
1 材料与方法
1.1 样品采集与培养
P. malhamensis样本采集自美国亚利桑那州立大学内的小球藻培养中, 可大量摄食小球藻, 该株系暂定为CMBB008。这株鞭毛藻在倒置显微镜(Olympus CKX41)下通过毛细玻璃管分离并在pH 6.5的AF-6培养基[29]中培养, 培养条件为(23±1)℃,持续提供50 μmol photons/(m2·s)的光照。
为对其形态学进行比较研究, 分别从德国哥廷根大学藻种保藏中心(Culture Collection of Algae at Göttingen University, SAG)购买P. malhamensisSAG933-1a以及从美国海洋藻类和微型生物国家保藏中心(National Center for Marine Algae and Microbiota, NCMA)购买P. malhamensisCCMP3181和P. stipitataCCMP1862, 并进行纯培养, 培养条件同CMBB008。
1.2 光学显微镜观察
通过显微镜(Olympus BX53)的微分干涉功能进行形态学观察, 并使用配置的DP80相机(Olympus)拍照, 用cellSens图像软件进行拍摄及图像处理。
在观察囊壳时, 将1 mL卡尔科弗卢尔-伊文斯蓝染料(Calcofluor White-Evans blue, CW-Eb; Sigma-Aldrich)加入1 mL细胞悬液中, 然后在暗处静置30min, 随后在荧光显微镜(激发/发射波长 = 355/435 nm)下观察[30]。叶绿体的数目通过自发荧光观察。为统计叶绿体数目, 测量囊壳长度及杯体长宽和细胞大小等数据, 随机选取至少30个处于稳定期的细胞进行观察, 长度通过cellSens的图像功能进行测量。
将10 μL BODIPY 505/515染料(DMSO溶解, 储存液浓度为5 mmol/L; Invitrogen)加入1 mL细胞悬液中进行染色, 在室温下暗处静置10min后在荧光显微镜(激发/发射波长=490/515 nm)下观察胞内的油滴[31]。
1.3 电子显微镜观察
鞭毛藻扫描电镜和透射电镜的样品制作方法参照Gong等[32]。此外, 本文还对该鞭毛藻的胞囊开展扫描电镜观察。胞囊的收集方法为: 在AF-6培养基中加入麦粒(1粒/10 mL)静置培养获得高浓度的细胞。随后提供低光[10—20 μmol photons/(m2·s)],光周期为12h﹕12h。每天在光镜下监测是否有胞囊的产生。一旦有大量胞囊产生, 将培养液以3000×g离心10min, 弃去上清, 将沉淀在酒精灯上方加热直至水分蒸发干。加入2—4滴浓盐酸, 酒精灯加热至盐酸蒸发。然后依次加入2—4滴浓硫酸和浓硝酸, 重复上述步骤, 酸处理将去除胞囊的有机质。然后将处理干净的胞囊在含变色硅胶的真空干燥器中干燥3d[33], 制作扫描电镜样品并拍照。
1.4 DNA提取, 扩增和测序
将P. malhamensisCMBB008、SAG933-1a和CCMP3181及P. stipitataCCMP1862的细胞经过12000×g离心5min, 参照DNeasy Blood & Tissue试剂盒(Qiagen)说明书提取细胞的总DNA。
SSU rDNA基因片段扩增采用引物SSU-F(5′-AACCTGGTTGATCCTGCCAGT-3′)和SSU-R(5′-TGATCCTTCTGCAGGTTCACCTAC-3′)[34], 反应程序设置为95℃预变性5min; 95℃变性1min, 50℃退火1min, 72℃延伸2min 30s, 35个循环; 72℃末端延伸10min。rbcL基因片段扩增采用设计的引物rbcL-F(5′-CAGTAGTATGGACAG-3′)和rbcL-R(5′-CCAACTACAGTTCCAGC-3′), 反应程序设置为95℃预变性5min; 95℃变性30s, 45℃退火30s, 72℃延伸1min, 35个循环; 72℃末端延伸10min。
扩增的DNA片段在琼脂糖凝胶电泳后通过E.Z.N.A.®胶回收试剂盒(OMEGA, Biotek)纯化, 然后根据说明书连接到pGEM-T®载体(Promega)上, 转入大肠杆菌感受态细胞(DH5α)。蓝白斑筛选出白色克隆, 根据单克隆PCR的电泳结果挑选5—10个阳性克隆送往武汉天一辉远公司测序, 最后将四个株系的SSU rDNA和rbcL序列上传至GenBank。
1.5 系统发育分析
为了确定P. malhamensisCMBB008及Poterioochromonas属在金藻纲中的系统发育地位, 用本研究中测定的4个SSU rDNA和3个rbcL序列, 以及从NCBI(https://www.ncbi.nlm.nih.gov/)中收集的金藻纲的49个SSU rDNA和28个rbcL序列构建系统发育树, 此外分别选取4个和2个真眼点藻纲的SSU rDNA和rbcL序列作为外类群。将上述序列利用ClastalX软件[35]进行比对, 然后用SeaView[36]修剪序列, 同时用最大似然法(Maximum likelihood, ML)[37]和贝叶斯推断法(Bayesian Inference, BI)[38]进行进化分析。使用最大似然法在线建树(http://www.atgc-montpellier.fr/phyml/), 分支节点支持率采用Bootstrap 1000次检验; 贝叶斯推断法分析在MrBayes软件中进行, 共运算1000000代, 对每1000代进行1次抽样。
2 结果
2.1 形态学描述
P. malhamensisCMBB008细胞形状多变, 大部分是球形或卵圆形, 也可见其他不规则形状(图 1A—D), 细胞大小为6.5—12.4 μm(表 1)。没有眼点。每个细胞有两根长短不等的鞭毛: 长鞭毛是体长的1—1.5倍, 短鞭毛在显微镜下有时难以观察到(图 1A、1B)。长鞭毛上附生茸毛, 而短鞭毛光滑(图 2A、2B)。细胞纵分裂, 细胞复制产生两套鞭毛(图 2C)。典型的叶绿体呈棕黄色的二裂片状(图 1E), 其形状和颜色会在不同的生长阶段和培养条件下稍有变化(图 1A—E)。不含叶绿体的细胞非常罕见(图 1F)。细胞有时会通过囊壳的柄附着在颗粒上而聚集成群体(图 1G)。在细胞体侧有时能观察到带状或柄状的伪足(图 1D和1H、图 2F)。透明的伸缩泡位于细胞前端, 细胞核在尾部(图 1B)。细胞能通过吞噬摄食小球藻或细菌, 食物颗粒在食物泡中消化(图 1H、1I)。在摄食过程中, 细胞通过鞭毛吸附小球藻(图 2D), 通过细胞膜摄入小球藻或排出食物残渣(图 2E)。细胞在摄食时很容易体型拉长且形成伪足(图 2F)。稳定期的细胞中常可见油滴和大的昆布多糖液泡(图 1J、1K)。囊壳在光学显微镜下很难观察到, 要借助CW-Eb染料在荧光显微镜下观察(图 1M、1N)。囊壳杯状结构较宽和浅(图 1L),平均宽度和深度为9.4和8.0 μm(表 1)。空的囊壳常通过柄基部聚集成簇(图 1L)。在观察中还罕见地发现胞囊形成的初级阶段, 色素体膨大致密, 细胞外包裹一层厚的胶状物质, 细胞位于囊壳的杯状结构上(图 1O、1P)。
细胞在饥饿条件下产生硅质胞囊(图 3)。胞囊呈球形, 直径10—15 μm, 表面光滑。胞囊顶部有一个小孔, 小孔周围有三层领状结构: 第一层圆锥形,第二层含有三个向内弯曲的凸起, 第三层含有三个扁平的圆顶(图 3D—F)。在有些胞囊中, 小孔被一小型的塞子封口(图 3F)。
透射电镜照片揭示了胞质中细胞器的超微结构(图 4)。细胞有一个大的细胞核(1.6—2.1 μm), 核仁和细胞质清晰可见(图 4A、4B和4E)。高尔基体是由许多半圆环, 即扁平膜囊堆积而成, 周围有大量圆形囊泡(图 4F)。叶绿体和线粒体的数目和大小会随着细胞营养方式的不同而发生轻微改变: 在细胞自养时, 叶绿体很明显, 而线粒体数量少且个体小(图 4A); 当转化为吞噬营养时, 会出现大量食物泡, 叶绿体会变得很小或消失, 但是线粒体的数目或体积大小会增大(图 4B)。两片二裂片状叶绿体中间有桥连, 细胞核和叶绿体共用外膜(图 4E)。鞭毛呈现“9+2”型微管结构(图 4D)。另外, 可见鞭毛根部的过渡区, 过渡螺旋结构及含过渡平面的基体等超微结构(图 4C和G)。
2.2 分子系统发育学分析
基于最大似然法和贝叶斯推断法(ML/BI)构建SSU rDNA(图 5)和rbcL(图 6)基因的系统发育树以确定P. malhamensisCMBB008的系统发育地位以及该属与金藻纲中其他物种的关系。通过测序获得P. malhamensisCMBB008, SAG933-1a, CCMP 3181和P. stipitataCCMP1862的SSU rDNA基因序列(登录号分别为MH536660、MH536656、MH 542674和MH536657)和前三株P. malhamensis的rbcL基因序列(登录号分别为MH643691、MH64 3685和MH643684)。系统发育分析最后比对的SSU rDNA序列包含57个物种1686个碱基,rbcL序列包含33个物种914个碱基。
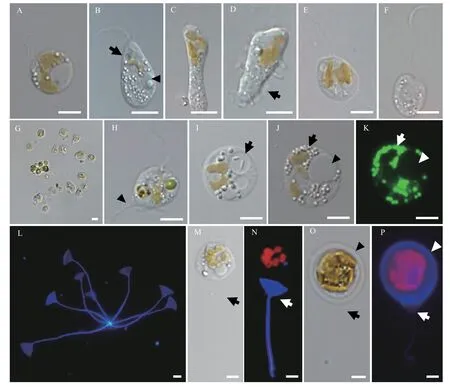
图1 P. malhamensis CMBB008的光学形态照片Fig. 1 Light micrographs of P. malhamensis CMBB008
SSU rDNA基因树(图 5)包含金藻纲中的5个目。所有的Poterioochromonas聚为一支, 位于棕鞭藻目(Ochromonadales)中, 该分支内分3个群(A、B和C):P. stipitataCCMP1862和Poterioochromonassp. ACOI-1258形成分支A;P. malhamensisCCMP 3181, HT-2和两株Poterioochromonassp.(CCMP 2718和CCMP2060)形成分支B; SAG933-1a和其他P. malhamensis, 3株Poterioochromonassp., 2株未培养的金藻共同构成分支C。在分支C中, CMBB 008株系最先分化, 其他株系构成另外一支后分化。此外, A支与B和C构成的进化支以较高的支持率(ML/BI=73.7%/0.92)形成姊妹支, B和C形成姊妹支在SSU rDNA树中支持率较低(ML/BI<50%/0.70)。Poterioochromonas支系与含3株未定种的分支D亲缘关系密切(ML/BI>90%/0.95)。最后, A-D共同形成的大分支与4株Ochromonas也形成亲缘关系很近的姐妹支(ML/BI>90%/0.95)。与Poterioochromonas形态相似的Ochromonas属位于棕鞭藻目的两个分支中。
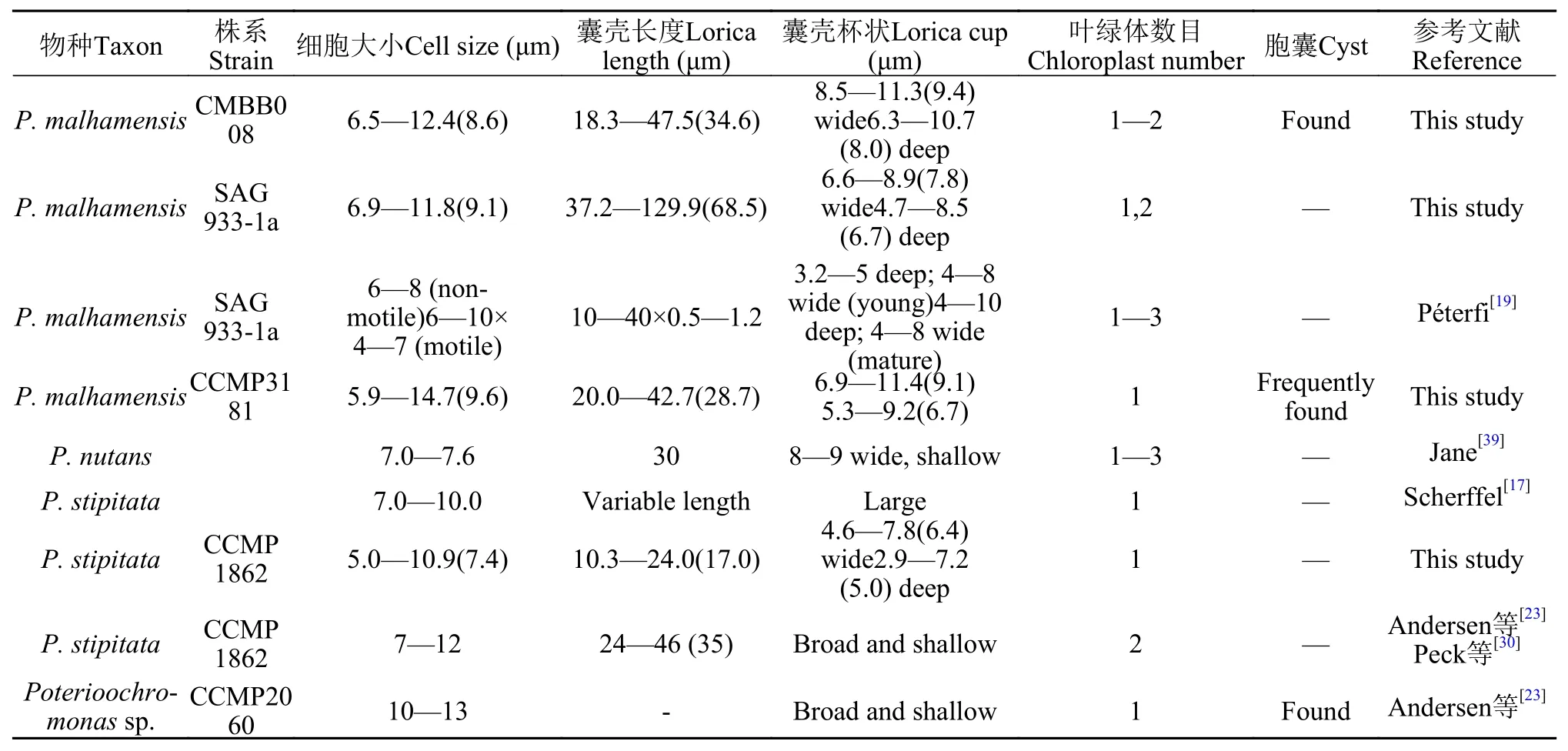
表1 Poterioochromonas不同种群的形态比较Tab. 1 Morphology comparison between different population of Poterioochromonas
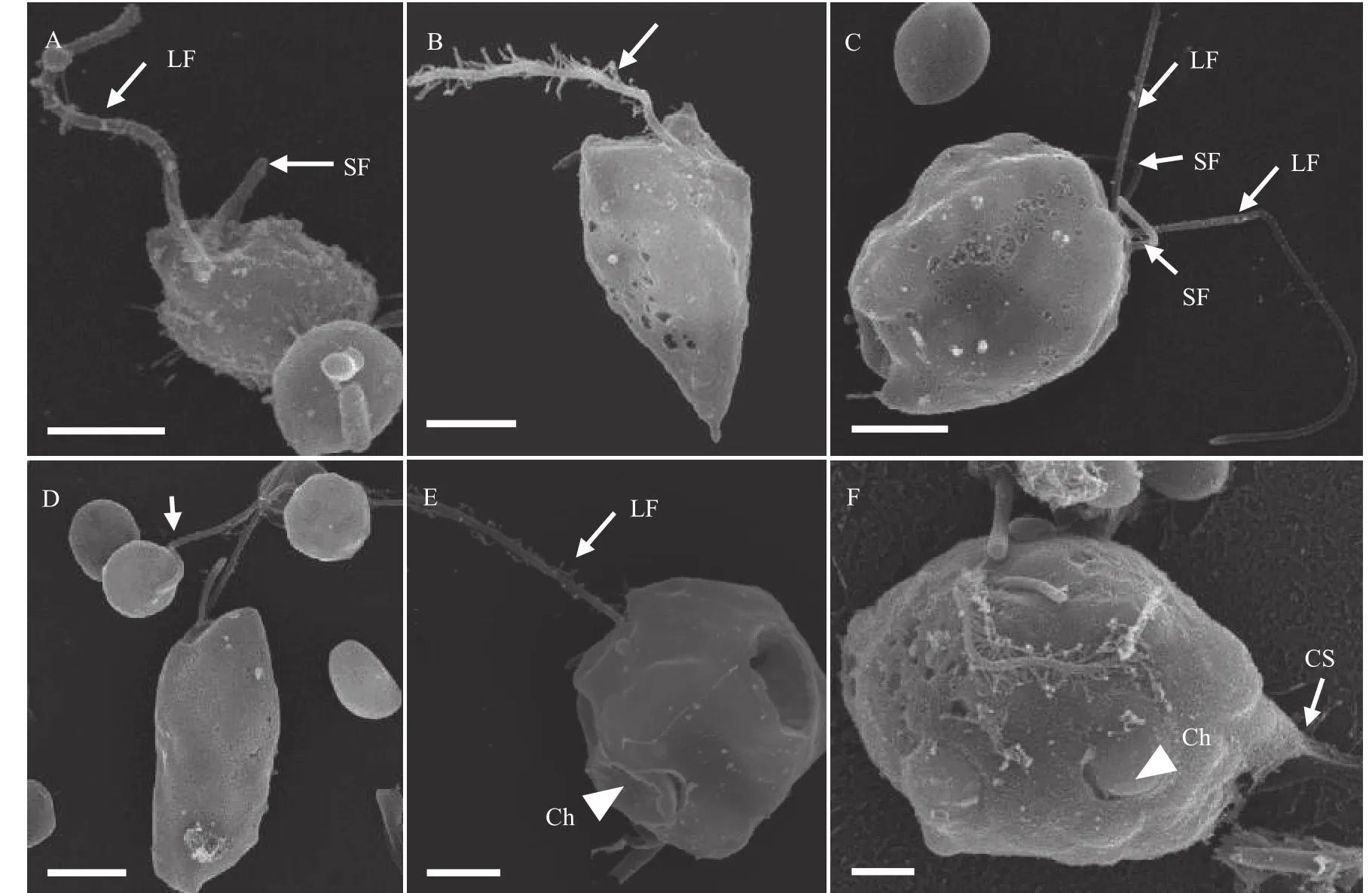
图2 P. malhamensis CMBB008的扫描电镜照片Fig. 2 Scanning electron micrographs of P. malhamensis strain CMBB008
在NCBI中金藻纲的rbcL序列相对较少, 为获得更准确的系统发育分析, 本研究收集了几乎所有的Poterioochromonas的rbcL序列构建系统发育树(图 6), 结果表明基于不同基因的进化树整体拓扑结构略有区别, 但Poterioochromonas支的拓扑结构与SSU rDNA基因树表现出一致性, 也分为支持率很高的三个支系。
3 讨论
3.1 P. malhamensis的种间形态学比较
基于详细的形态学观察, 本研究分离的CMBB 008株系与最早对P. malhamensis的描述几乎是一致的[18,19], 特征如下: 细胞呈球形或卵形, 有一个或两个二裂片状的叶绿体, 没有眼点, 有两根不等鞭毛和鞭毛附近的伸缩泡, 细胞后部的金藻多糖液泡及特殊的囊壳结构。BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)比对结果表明CMBB008与模式株SAG933-1a是同一个种(SSU rDNA-ITS基因序列相似度99.76%)。因此形态学和分子数据均支持本研究中分离自亚利桑那小球藻培养的鞭毛藻为P.malhamensis。
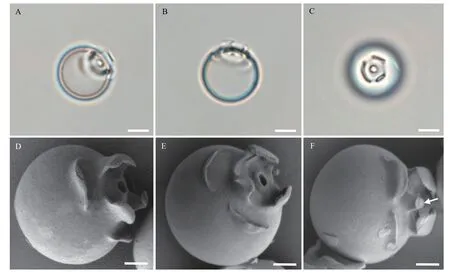
A—C. 光镜照片; D—F. 扫描电镜照片; 图F中箭头表示孔塞; 标尺: A—C为5 μm; D—F为2 μm A—C. Light micrographs; D—F. Electron micrographs. Arrow in F represents plug in pore. Scale bars: 5 μm for A—C, 2 μm for D—F
到目前为止,Poterioochromonas属仅报道3个种, 分别是P. malhamensis[19]、P. stipitata[17]和P.nutans[39]。然而有关这3个物种的区分存在争议, 每个物种都找不到一个在形态上可以与其他物种区分的明显特征[19]。P. stipitataScherffel为该属模式种, 单细胞, 球形或长条形。细胞7—10 μm, 长鞭毛长达20 μm, 长鞭毛是短鞭毛的2.5倍长。一个叶绿体, 无眼点。有杯状囊壳, 囊壳后端有一条细而中空的柄[17]。P. nutans的囊壳比P. stipitata更宽和浅,有1—3个叶绿体[39]。Péterfi[19]认为P. malhamen-sis和P. stipitata可能属于同种异名, 但缺少更多数据的支持。后来Peck[30]认为P. malhamensis囊壳柄的基部为单一的足, 少数足具2条分支, 而P. stipitata的足具3条或多于3条分支, 此特征可用于区分P. malhamensis和P. stipitata。本研究针对前人研究中争议比较大的叶绿体数目和囊壳形态这两个特征进行了深入的观察比较。
叶绿体数目一直是Poterioochromonas分类学研究者广泛关注且存在争议的一个特征。根据Pringsheim对P. malhamensis的模式株SAG933-1a的描述, 该物种叶绿体的大小和颜色变化较大, 一个叶绿体由两个部分连接而成[18], 但对于同一株系,Péterfi[19]观察到1—3个叶绿体或者更多。P.nutans也有1—3个叶绿体[39], 而P. stipitata有1个[17]或2个[22](表 1)。本研究经过对大量细胞的观察, 发现P. malhamensisSAG933-1a的叶绿体有1—2个,P.malhamensisCCMP3181和P. stipitataCCMP1862通常只有1个叶绿体, 而CMBB008的叶绿体与SAG 933-1a类似, 有1—2个。此外, 本研究通过透射电镜的观察(图 4B), 发现P. malhamensis处于吞噬营养状态时叶绿体会变小, 表明叶绿体数目和大小在不同营养状态下也会有所变化, 这与前人的研究一致[15,21]。为此, 我们推断叶绿体数目的变异性在不同种甚至是同一物种的不同株系或者同一株系的不同营养时期中普遍存在, 因此不适合用叶绿体数目来进行Poterioochromonas不同物种之间的区分。

图4 P. malhamensis CMBB008的透射电镜照片Fig. 4 Transmission electron micrographs of P. malhamensis strain CMBB008
另外, 学者们普遍认为囊壳是鉴定Poterioochromonas的重要结构[23]。然而在P. malhamensis的物种鉴定过程中, 有些被鉴定为P. malhamensis的物种完全没有观察到囊壳结构, 即使是P. malhamensis的模式株SAG933-1a, 其囊壳也被观察到时有时无, 这给其分类带来很大困扰。因此有学者怀疑Poterioochromonas中含有一些没有囊壳的物种[23], 如果该结论成立, 则该属的形态特征描述需要重新定义。为此, 我们对所分离的CMBB008以及从不同保藏中心收集的P. malhamensisSAG933-1a、CCMP3181和P. stipitataCCMP1862的囊壳进行了详细的观察, 发现它们都具有囊壳, 表明囊壳是P. malhamensis或Poterioochromonas的基本结构。虽然该结果仅仅是基于四个株系的观察, 但是仍具有重要的意义。将我们的研究方法和前人进行比较, 有两个问题值得引起注意: 首先,Poterioochromonas具有两种形态, 即不含囊壳的游动细胞形态和具有囊壳的有柄固着形态, 在培养过程中细胞大多是以游离的形式存在, 此时很难观察到囊壳,因此给物种鉴定带来困难, 而已有研究几乎都是根据游离细胞的观察判断是否含有囊壳。在本研究中我们发现, 虽然附着有细胞的囊壳结构很难观察到, 但是没有细胞附着的囊壳却普遍存在且常常出现多个囊壳聚集成簇的现象(图 1G和1L)。这些光秃的囊壳柄是细胞游离后留下来的, 由于其主要成分是几丁质[30], 因此可以在培养物中存在较长的时间, 本研究正是基于这些游离囊壳柄的观察判断细胞含有囊壳结构的。另外, 在本研究中我们采用CW-Eb对囊壳进行染色, 该方法极大提高了囊壳在显微镜下的可视性。虽然早在1980年Herth[40]已提出可用CW-Eb对P. malhamensis的囊壳结构进行有效染色, Peck[30]也利用该方法对一些金藻的囊壳开展了研究, 但在Poterioochromonas的鉴定中并没有得到广泛应用, 有些学者在形态学观察过程中没有利用任何染色[22], 有些染色方法明显没有CW-Eb效果好[23]。因此本研究认为所有的P. malhamensis都有囊壳, 至少在生活史的某些阶段, 前人没有观察到囊壳结构主要是受限于所使用的方法。我们强烈建议将CW-Eb染色作为观察Poterioochromonas囊壳结构的标准方法, 此外在观察过程中不能仅对游动细胞进行观察, 还要对该细胞的培养物进行全面详细观察, 采样过程中注意对培养器皿底部样品的采集, 以快速确定该细胞是否可以形成囊壳结构。

图5 基于金藻纲SSU rDNA基因序列的系统发育树Fig. 5 Phylogenetic tree based on the SSU rDNA gene sequences of Chrysophyceae
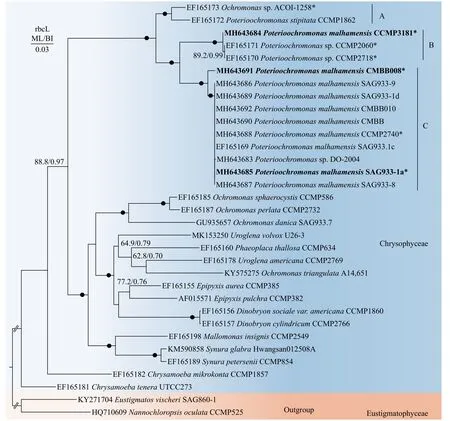
图6 基于金藻纲rbcL基因序列的系统发育树Fig. 6 Phylogenetic tree based on the rbcL gene sequences of Chrysophyceae
以上观察表明叶绿体和囊壳在细胞的不同生活史时期其形态表现出较大的变异性, 将其作为Poterioochromonas属不同物种之间的区分标志存在很大困难, 为此, 本研究试图通过对形态上更为稳定的胞囊的观察, 为该属的物种鉴定寻找更为稳定的结构特征。胞囊是细胞在饥饿状态下形成以抵御不良环境, 前人在鉴定与Poterioochromonas形态相似的Ochromonas属时, 认为胞囊形态比游泳细胞的形态更稳定可靠[41,42]。此前, 仅Andersen等[23]对两株Poterioochromonas未定种(CCMP2060和CCMP2718)的胞囊形态进行报道。本研究通过扫描电镜详细观察了CMBB008的胞囊(图 3), 发现其与上述两个物种的领状结构有很大不同, 此外本研究观察到CMBB008的胞囊具有孔塞, 该结构在前两株研究中没有被发现。考虑到胞囊结构在不同株系间的显著区别, 它很有可能作为种间区分的有效特征。然而, 目前有描述胞囊结构的株系非常少,因此后续需要对更多Poterioochromonas的胞囊结构进行全面观察, 以证明胞囊结构是否有Poterioochromonas种间区分的潜力。
3.2 P. malhamensis的种内形态学比较
在Poterioochromonas属中, 虽然仅有3个物种,但是P. malhamensis无疑是最受关注而且是报道最多的物种。将本研究中的CMBB008与P. malhamensis其他种群比较, 发现不同种群细胞大小相似, 但是囊壳变化较为明显(表 1)。CMBB008的囊壳长度总体小于模式株SAG933-1a(18.3—47.5 μmvs.37.2—129.9 μm), 而且P. malhamensis的囊壳长度总体大于P. stipitata(12—130 μmvs. 10—24 μm)。除囊壳长度外, 比较研究结果表明, CMBB008的囊壳杯状较深且宽(8.0 μm深和9.4 μm宽), SAG 933-1a适中(6.7 μm深和7.8 μm宽), 而P. stipitata较浅而窄(5.0 μm深和6.0 μm宽)。总的来说,P. stipitata的囊壳杯状比P. malhamensis更小。另一点需要注意的是, 本研究所测量的SAG933-1a囊壳比前人的描述显著更长(37.2—129.9 μmvs. 10—40 μm), 囊壳的杯状形态也稍有区别(表 1)。因为囊壳具有重要的生态学作用[30], 并存在形态可塑性, 据报道室内培养超过30年的P. malhamensis相比于新分离的株系在形态学和生理学上都会对环境产生不同的响应[43], 因此长期在实验室培养可能导致囊壳形态发生改变。总之, 仅通过形态学特征难以区分不同种群, 后期有待寻找合适的分子标记以对种群进行有效区分。
3.3 Poterioochromonas的系统发育分析
关于Poterioochromonas的系统发育研究, 以前的报道数据十分有限。此外, 由于Ochromonas个体微小, 结构简单, 且与Poterioochromonas形态极为相似, 主要区别在于后者具有囊壳结构。由于在早期研究中, 囊壳结构的染色方法没有得到很好的应用, 导致很多本应属于Poterioochromonas的物种被错误鉴定为Ochromoanas。因此在进化树中Poterioochromonas常常与Ochromonas类群分布在一起[24,28],导致这两个属系统发育关系的混淆。本研究从NCBI收集了近缘物种的基因序列进行分析, 结果证实所有的Poterioochromonas聚在一起(分支A+B+C)且与Ochromonas分开(图 5和图 6), 表明Poterioochromonas是单系发生的。在进化树中,Poterioochromonas分支先与3个来自环境样品的未鉴定种聚为一支, 然后与Ochromonas分支聚在一起, 推测含环境样品的分支可能是Poterioochromonas与Ochromonas的过渡阶段。
如上所述, 依据形态特征, 目前Poterioochromonas属只有三个有效种, 除了研究较多的P.malhamensis外,P. stipitata和P. nutans由于没有模式标本和模式株保存, 这两个种的确凿性仍值得怀疑。有趣的是, 在本研究中, SSU rDNA和rbcL基因树的Poterioochromonas支中也显示了三个明显的分支(图 5)。SSU rDNA树中Poterioochromonas中的大部分株系聚在P. malhamensis模式株SAG933-1a所在的分支C, 表明已报道的Poterioochromonas株系大部分为P. malhamensis。意外的是, 本研究中基于两种基因构建的进化树均表明CMBB008和P. malhamensisSAG933-1a所在的分支有一定的距离, 且支持率较高(SSU rDNA树中ML/BI = 86.1%/0.92,rbcL树中ML/BI > 90%/0.95)。由于CMBB008和SAG933-1a在形态上很难区分, 虽然我们发现它们囊壳柄的长度存在一定差异, 但是由于该结构受环境因子影响较大, 而且针对SAG933-1a自身而言,其长度变化也存在很大差异, 所以目前暂时不能作为区分两者的标志。此外, 两者的SSU rDNA基因序列1769 bp中只有2个碱基差异, 相似度高达99.89%, 因此不建议鉴定为其他物种。本研究仍将分支C中的CMBB008鉴定为P. malhamensis, 后续需要更多基因标记或基因组学信息进行进一步确认。分支C中还包括几株未定种, 例如分离自微囊藻的Poterioochromonassp. DO-2004[22]、ZX1[20]及UTEX-LB-2575, 还有一些分离自环境样品的克隆。这些物种由于缺乏全面的形态特征描述, 以及缺乏模式株序列作为参考, 因此很难鉴定到种。本研究以P. malhamensis的模式株SAG933-1a作为参考, 由于它们的相似度非常高, 因此可以将上述未定物种鉴定为P. malhamensis。另一个物种P. stipitataCCMP1862位于分支A, 同Andersen[25]构建的系统发育树一样,P. stipitataCCMP1862总是与Poterioochromonassp. ACOI-1258聚为一支, 说明ACOI-1258可能为P. stipitata。然而,P. stipitataCCMP1862并不是分离自Poterioochromonas模式种P. stipitataScherffel的来源地, 所以不能确定CCMP 1862所在的分支A是否可以代表P. stipitata。因此后续有待于从模式种来源地收集P. stipitata并进行详细和准确的鉴定, 以对P. stipitata的有效性进行最终确认。此外, 意外的是被鉴定为P. malhamensis的CCMP3181并没有分布在分支C中, 而是与P.malhamensisHT-2和两株Poterioochromonas的未定种形成另一分支(分支B)。结合CCMP3181在形态上不同于其他P. malhamensis的特性, 如单个叶绿体和频繁产生胞囊(表 1), 认为将该株系鉴定为P.malhamensis有待怀疑, 后续更多来自B类群的形态学和分子数据将有利于阐述这一疑点。
4 总结
本文对一株危害小球藻的P. malhamensis进行了详尽的光学和超微结构描述以及分子系统发育研究。首次揭示该物种胞囊的扫描电镜结构, 并推测胞囊结构可作为Poterioochromonas属种间区分的特征。此外, 囊壳是用来鉴定Poterioochromonas的重要特征, 建议将CW- Eb染色作为观察囊壳的标准方法。SSU rDNA和rbcL基因构建的进化树均表明Poterioochromonas属是单系的, 且Poterioochromonas分支分为三支, 预示着这些类群可能涵盖三个种。在下一步的工作中, 亟需获得更多株系尤其是模式株的形态, 分子序列以及基因组或转录组数据, 以对该类群的物种多样性进行全面厘清。
致谢:
感谢华盛顿大学Robert A. Andersen对本文提出宝贵的修改意见。
