腐殖酸对沉积物中纳米银的释放及其毒性的影响研究
2020-10-15黄娇龙刘夏薇黄曼绮鲍少攀
黄娇龙 刘夏薇 黄曼绮 鲍少攀 唐 巍 方 涛
(1. 中国科学院水生生物研究所, 武汉 430072; 2. 湖北医药学院附属襄阳市第一人民医院, 襄阳 441000;3. 中国科学院大学, 北京 100049)
纳米银(Silver nanoparticles, AgNPs)在消费品(水过滤器、油漆、化妆品、除臭剂、纺织品、食品包装、功能化塑料、医疗器械、伤口敷料、洗衣机和冰箱等电器)、生物材料(各种生物医学传感器的开发)和水处理等多个领域有着广泛的应用[1]。据估计, 2016年全球对银的年需求量超过已2.76×107kg, 且当前AgNPs的全球年产量为约为(3.6—4.5)×105kg[2—5]。含AgNPs产品的广泛使用将不可避免地导致进入到水环境中AgNPs增加, 从而引发了人们关于AgNPs水生态安全性的担忧[6]。
进入水环境的AgNPs可以发生同聚(与其他纳米粒子聚集)或异聚(与天然矿物质和有机胶体聚集)现象, 并最终可能沉降到沉积物表面[7]。对于不同深度沉积物样品的分析表明, 进入沉积物中的AgNPs绝大部分(>94%)积累在其表层(<5 mm)[8]。这些AgNPs对沉积物生态系统具有不容忽视的影响, 如研究人员发现沉积物中AgNPs不仅对底栖动物具有急慢性毒性[9,10], 还对微生物的群落结构和活性具有一定影响[11—14]。
进入沉积物的AgNPs会发生一系列物理化学转化, 如氧化溶解[15]、硫化[16—18]和氯化[19]。AgNPs也可与天然有机物(NOM)相互作用, 进而使得AgNPs的环境行为和毒性发生改变[20—25]。NOM如腐殖酸(HA)和富里酸(FA), 广泛分布于土壤、沉积物和水中, 但NOM如何影响沉积物中AgNPs的归趋尚不清楚。
因此, 本研究主要关注沉积物中NOM对其中AgNPs释放的影响, 并探明释放出的AgNPs的毒性作用。研究将为揭示AgNPs在水环境中的迁移转化和生态环境安全性评价提供科学依据。
1 材料与方法
1.1 实验仪器与材料
JEM-2100型透射电子显微镜(TEM)、D/MXIIIA型X射线衍射仪(XRD)、Multiwave 3000微波消解仪、NexION300X电感耦合等离子体-质谱仪(ICP-MS)、ROTINA380高速台式离心机、OS20-Pro数字顶置式搅拌器、冷冻干燥机、arium basic型超纯水仪、D3024R高速冷冻离心机和SpectraMax M5多功能酶标仪。
本研究中所用的纳米银溶液购自上海沪正纳米科技有限公司(中国, 上海)。硝酸银(AgNO3)、碳酸钙(CaCO3)购自国药控股有限公司(中国, 北京), 纯度达到99.8%。电子级硝酸(HNO3)购自苏州晶瑞化学股份有限公司(中国, 江苏), UP级, 含量为68.0%—70.0%。腐殖酸(HA), 灰分低于10%, 购自天津光复精细化工研究所(中国, 天津)。所有购买的化学品均为分析纯及以上。实验中所用的玻璃仪器和塑料仪器使用前均经10%HNO3浸泡24h以上。
1.2 受试生物
野生型成年斑马鱼[体重: (0.3±0.03) g, wt; 长度: (3.3±0.07) cm]来自中国科学院水生生物研究所。实验前, 将斑马鱼放入脱氯水中, 使其在与后续试验相同的条件下适应10d, 适应期间没有鱼死亡。在整个实验中, 光暗循环为14﹕10, 水温保持在(26.6±0.2)℃, pH稳定在7.59±0.07, 并且溶解氧(DO)含量保持在5 mg/L以上。每天用新孵化的盐水虾(Artemia salina)喂食2次。
1.3 实验方法
配制沉积物 本研究所使用的沉积物是经济合作与发展组织(OECD)化学品测试导则219《沉积物-水系统中摇蚊毒性试验 加标于沉积物法》(英文版)中所提出的配制沉积物[26]。同时根据Hund-Rinke等[27]提出的修改意见: 降低沉积物中有机质含量(泥炭占5%降低到2%)。因此, 本研究中所使用的配制沉积物的组分为: 78%石英砂、20%高岭石黏土和2%泥炭。通过550℃煅烧来去除配制沉积物中的天然有机物[28], 通过引入腐殖酸来增加配制沉积物中天然有机物含量[29], 得到本研究使用的4种腐殖酸含量不同的配制沉积物: 0、1%、5%和10%。配制沉积物实际测得的有机质和含水率如表 1所示。实验前, 沉积物在与后续试验相同的条件下陈化7d。
加标沉积物沉积物中AgNPs的浓度设定为100 μg/g Ag dw(dw, 干重), 该浓度的选取是基于预测沉积物中AgNPs浓度为87.8—614.4 μg/g[13]和先前的研究[10,22]。沉积物加标方法参照Cong等[22]的方法, 即将一定体积的银溶液加入到已知质量的沉积物中, 用干净的木铲搅拌, 搅拌均匀后得到目标沉积物浓度。对于AgNPs处理组, 我们分别添加了200 mL AgNPs溶液。对于银离子处理组, 我们分别添加了200 mL AgNO3溶液。沉积物加标后,对每种加标浓度的沉积物进行定量检测(表 1), 处理组之间加标沉积物浓度无显著性差异(P>0.05),具有可比性。
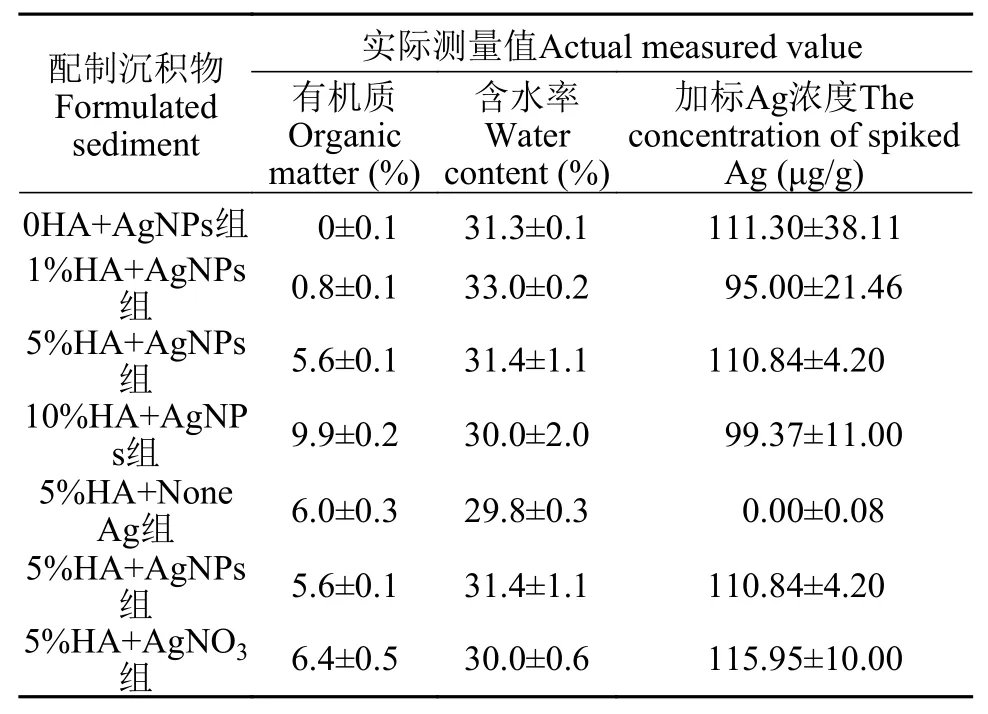
表1 实验中配制沉积物实际的有机质、含水率和加标Ag浓度(平均值±标准误, n=3)Tab. 1 The actual organic matter, water content and the concentration of spiked Ag of the formulated sediments in the experiment (Mean ± SEM, n=3)
水-沉积物微宇宙系统的建立实验中对沉积物共进行了6种处理, 分为HA处理组(0HA+AgNPs组、1%HA+AgNPs组、5%HA+AgNPs组和10%HA+AgNPs组)和Ag处理组(5%HA+None Ag组、5%HA+AgNPs组和5%HA+AgNO3组)两大部分。所有处理组沉积物中银浓度均为100 μg/g Ag dw, 每组实验设置3个平行。实验在40 cm×25 cm×25 cm的玻璃缸中进行, 将2 kg(干重)对照或加标的沉积物引入玻璃缸中(沉积物的厚度为2—3 cm), 然后在48h后小心地加入脱氯自来水(11.6 L, 水柱高度为12 cm), 在加水过程中尽量避免扰动沉积物表面。为了防止斑马鱼直接接触沉积物中的AgNPs, 在沉积物上方安装了一块玻璃孔板(孔径为2 mm)。所有装置放在恒温(25℃)条件下。遵循Simpson等[30]的建议, 加标沉积物+上覆水系统在引入受试生物之前平衡10d, 以达到接近平衡的条件, 平衡期与暴露期在相同条件下进行。待系统平衡10d后, 将540只斑马鱼均匀且随机地引入到18个水-沉积物微宇宙系统中, 连续暴露30d。在暴露期间, 温度保持在(26.6±0.2)℃, pH稳定在7.59±0.07, 并且用充氧泵持续充气使DO含量保持在5 mg/L以上。在暴露的第15天和第30天时, 各取样1次, 每次取15条鱼,冰上解剖, 以获得斑马鱼的肝脏、脑、鳃和肠道组织, 并用滤纸吸干多余水分。将所有组织在液氮中冷冻并保存在-80℃直至分析。用来测量斑马鱼组织中的银积累以及组织中的抗氧化酶活性, 并分析斑马鱼的肠道微生物群落。
1.4 银浓度的测定
水样: 于15d和30d时在各个微宇宙系统中采集14 mL水样, 其中4 mL水样用来测水中可溶性Ag的含量[12]。简言之, 将4 mL水在超滤管(Millipore Amicon Ultra-4 3 Kda)中以7500 r/min离心30min,然后用电子级硝酸消化, 并在加热板上130℃加热赶酸, 冷却后, 超纯水定容使硝酸终浓度为2%, 通过电感耦合等离子体质谱仪(ICP-MS, NexION 300X, PekinElmer, USA)测定消化液中Ag的浓度。另外10 mL水样按照Cambier等[31]描述的方法分析水中的总Ag含量, 消化及测定方法与可溶性Ag相同。
沉积物样品: 用注射器在各个体系中采集约10 g沉积物样品, 冷冻干燥并研磨, 过100目筛后保存于-20℃下待测。沉积物中Ag浓度测定参照Cong等[32]的方法进行, 即称取0.1 g待测沉积物于聚四氟乙烯管中, 加入电子级硝酸, 微波消解后转移到电热板130℃加热赶酸, 冷却后, 超纯水定容使硝酸终浓度为2%, 然后用电感耦合等离子体质谱仪(ICP-MS,NexION300X, PekinElmer, USA)测定消化液中Ag的浓度。
组织样品: 斑马鱼组织(肝脏, 脑, 鳃和肠道)中的Ag积累根据Brittle等[33]的方法测量。即称取一定质量的组织样品, 分别加入到玻璃烧杯中消解。消解过程分为三步, 第一步为冷消解, 加入5 mL电子级硝酸, 在室温条件下放置15min; 第二步为热消解, 将烧杯放置在180℃的加热板上消解, 直至所有的固体物质都溶解完全; 第三步, 将消解温度降至80℃, 直至消解液体积<200 μL时停止消解, 冷却后加水定容使溶液中硝酸的终浓度为2%, 然后通过ICP-MS测定消解液中Ag浓度。
1.5 生物标志物的测定
取冷冻的组织样品, 准确称取组织样品质量,按重量(g)﹕体积(mL)=1﹕9的比例, 加入9倍体积的生理盐水, 使用手持式均质/分散机(SCILOGEX, D-160, Berlin, USA), 在冰水浴条件下将斑马鱼组织样品(肝脏, 脑和鳃)匀浆。然后使用高速冷冻离心机将组织匀浆在4℃下以3500 r/min离心15min, 取上清液即得10%组织匀浆。尽快测定以确定酶活性和蛋白质水平[34]。具体的测量操作和计算按照南京建成生物工程研究所(中国, 江苏)试剂盒的说明书进行。
1.6 肠道微生物群落组成的测定
按照TransGen AP221-02: TransStart Fastpfu DNA Polymerase说明书从斑马鱼肠道样品中提取微生物DNA, DNA浓度和纯度利用NanoDrop2000进行检测, 利用1%琼脂糖凝胶电泳检测DNA提取质量。使用引物338F(5′-ACTCCTACGGGAG GCAGCAG-3′)和806R(5′-GGACTACHVGGGT WTCTAAT-3′)通过热循环PCR系统(GeneAmp 9700,ABI, USA)扩增细菌16S rRNA基因的V3-V4高变区。PCR反应在含有4 μL5×FastPfu缓冲液, 2 μL 2.5 mmol/L dNTPs, 0.8 μL正向引物(5 μmol/L), 0.8 μL反向引物(5 μmol/L), 0.4 μL FastPfu聚合酶, 0.2 μL BSA和10 ng模板DNA的20 μL混合物中进行。PCR条件如下: 在95℃变性3min, 29个扩增循环(95℃变性30s, 55℃退火30s, 72℃延伸45s), 最后72℃延伸10min, 保持10℃直到停止。
根据Majorbio Bio-Pharm Technology Co., Ltd(中国上海)的标准方案, 在Illumina MiSeq平台(Illumina, San Diego, USA)上对纯化的扩增子进行测序。使用UPARSE(版本7.1 http://drive5.com/uparse/)对操作分类单位(OTU)进行聚类, 具有97%的相似性截止值, 并使用UCHIME识别和移除嵌合序列。
1.7 数据统计与分析
所有数据均表示为平均值(Mean)±标准误(SEM)。使用IBM SPSS 20.0统计软件(SPSS, Chicago, IL,U S A)进行统计学分析。基于数据的正态性(Kolmogorov-smirnov和Levene检验)和单因素方差分析(ANOVA)与事后最小显著性差异(LSD)多重比较检验评估各处理组之间的差异。统计显著性在0.05的置信水平下确定。
2 结果与讨论
2.1 纳米银的表征结果
通过分析不同区域的205个颗粒的TEM图像获得尺寸分布, 观察到该溶液中纳米颗粒的尺寸为正态分布, 平均粒径为(21±0.2) nm (图 1d)。图 1e为X射线衍射图, AgNPs在38.16°、44.26°、64.62°和77.48°处显示XRD衍射峰, 对应于(111)、(200)、(220)和(311)的晶面。这些峰与面心立方(FCC)结构很好地吻合[35]。
2.2 沉积物中纳米银向水柱的释放
所有处理组的水柱中总Ag浓度在15d时为(0.01±0.01)—(2.53±0.52) μg/L, 在30d时为(0.01±0.00)—(1.05±0.10) μg/L(图 2)。15d时, 除5%HA+None Ag组外, 各组的Ag浓度显著低于30d时的浓度。在实验中, 从沉积物中释放到水柱中Ag为沉积物中总银的0.02%, 与以前的研究结果类似[10,22]。不同实验组中释放的Ag量存在差异, 因此我们进一步研究了HA对沉积物中AgNPs释放的影响。
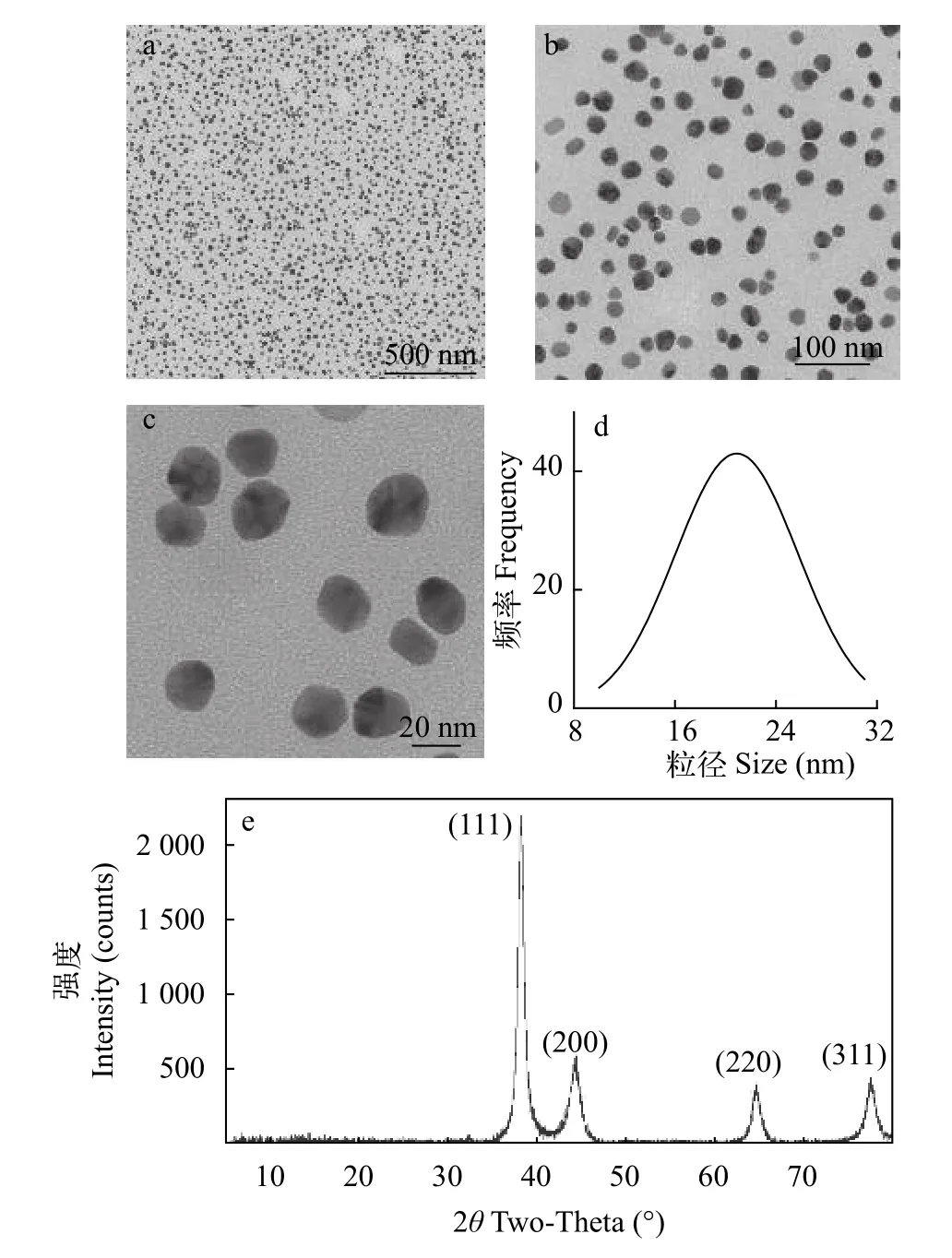
图1 纳米粒子的表征Fig. 1 Characterization of nanoparticles
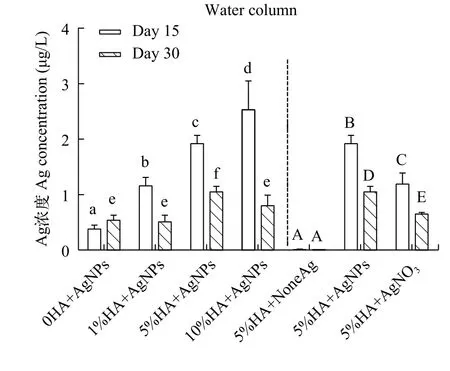
图2 水柱中Ag的浓度Fig. 2 Ag concentration in the water column
2.3 沉积物中腐殖酸的含量对纳米银向水柱释放的影响
由图 2可见, 在第15天时, 沉积物HA含量为0、1%、5%和10%的AgNPs处理组中释放的Ag浓度分别为(0.38±0.07)、(1.16±0.15)、(1.92±0.15)和(2.53±0.52) μg/L。在第30天时, 沉积物HA含量为0、1%、5%和10%的AgNPs处理组中Ag浓度分别为(0.54±0.09)、(0.51±0.12)、(1.05±0.10)和(0.80±0.19) μg/L。在15d时, 随着沉积物中HA含量的增加, 水柱中Ag的浓度显著增加。在30d时, 除0HA+AgNPs组外, 其他HA处理组水柱中的Ag浓度显著减少, 其中5%HA+AgNPs组水柱中Ag浓度显著高于其他组。总体而言, HA的存在促进了沉积物中AgNPs向水柱的释放, 且高HA含量(5%和10%)下的促进作用更强。以前的研究表明, NPs可以与环境中多种类型的有机配体相互作用, 可能使NPs形成表面涂层[36],并通过电荷和空间稳定化减少聚集[37—40]。作为一种天然有机配体, HA与AgNPs结合减少了AgNPs聚集, 增强了AgNPs的迁移性。一方面, HA是一种天然的金属络合剂, Li等[25]提出HA的氮和羧基官能团可以结合在AgNPs的表面层以增加AgNPs-HA的稳定性; 另一方面, HA是一种弱酸性物质, 沉积物中pH的降低可能会导致Ag+的释放。因此, HA的存在, 增强了AgNPs的迁移性和稳定性, 使其更容易释放到水柱中, 并在水柱中停留。值得注意的是,在相同的HA含量下, AgNO3处理组的Ag含量显著低于AgNPs处理组。
AgNPs在地表水中的浓度估计值为2.2 μg/L[41,42]。美国环境保护署将淡水和海水中Ag的急性水质标准分别设定为3.2和1.9 μg/L[43,44]。此外, 已经证明AgNPs在μg/L浓度下即可产生毒性作用[45]。在本研究中, 0HA + AgNPs处理组释放的Ag为(0.38±0.07) μg/L, 10%HA + AgNPs处理组释放的Ag达到(2.53±0.52) μg/L, 这与Ag的急性水质标准浓度非常接近。
2.4 释放到水柱中的Ag在斑马鱼组织中的积累和分布
如图 3所示, 肝脏和肠道中的Ag积累高于鳃和脑中的Ag积累, 这与之前的一些研究相似[46,47]。斑马鱼对PVP包被的AgNPs的饮食暴露也导致Ag在肝脏和肠道中的显著积累[48]。因为肠道的表面积大, 食物的消化也发生在肠道中, 而且Ag可以吸附在食物和沉积物颗粒上, 所以Ag容易在肠道中积累[49]。基因表达分析显示AgNPs通过改变编码酶和蛋白质基因的功能引起斑马鱼的肠道毒性[49]。Ag在肠道被吸收后, 通过血管运输到肝脏, 并在肝脏中积聚[50]。Cambier等[31]证实了这一结果。在沉积物HA含量相同的条件下, 暴露30d后, AgNO3处理组中斑马鱼肝脏和脑中的Ag积累显著高于AgNPs处理组; 而肠道中的Ag积累则刚好相反。这可能是AgNPs和Ag+在不同组织中的吸收和转运方式不一样。沉积物中在AgNPs浓度相同的条件下, 暴露30d后, 10%HA+AgNPs组中斑马鱼肝脏的Ag积累显著高于其他处理组, 表明沉积物中HA含量越高,斑马鱼肝脏中的Ag积累更多, HA促进了AgNPs在斑马鱼体内的积累。
在暴露15d后, 在肝脏、脑、鳃和肠道组织中检测到最高Ag浓度分别为(0.54±0.04)、(0.03±0.01)、(0.05±0.02)和(0.97±0.01) μg/g Ag wt(wt, 湿重, 下同)。暴露30d后, 斑马鱼肝脏、脑、鳃和肠道组织中Ag的浓度分别增加到(1.24±0.04)、(0.07±0.04)、(0.04±0.02)和(1.14±0.09) μg/g Ag wt。这与其他研究结果一致[46,47,51]。在30d内, 整个斑马鱼体内Ag的积累达到(0.54±0.04) μg/g Ag dw。例如, 在水性暴露中, 暴露于麦芽糖涂覆的AgNPs(20 nm)中21d的斑马鱼体内Ag浓度为0.88 μg/g Ag dw[52]。当用0.3和0.5 mg/L AgNPs暴露于河水时, 斑马鱼分别积累了(1.31±0.64)和(10.7±7.50) μg/g的Ag[53]。暴露于100和10 μg/L AgNPs悬浮液的雄性斑马鱼的累积值分别为(0.16±0.08)和(0.87±0.29) μg/g Ag dw[54]。斑马鱼饮食(盐水虾)暴露于100 μg/L Ag 21d后体内积累了1.39 μg/g dw的Ag[48]。我们发现, 尽管暴露途径不同, 但AgNPs在鱼类组织中主要积累在肝脏和肠道的趋势是一致的, 在脑和鳃组织中的积累则较少。
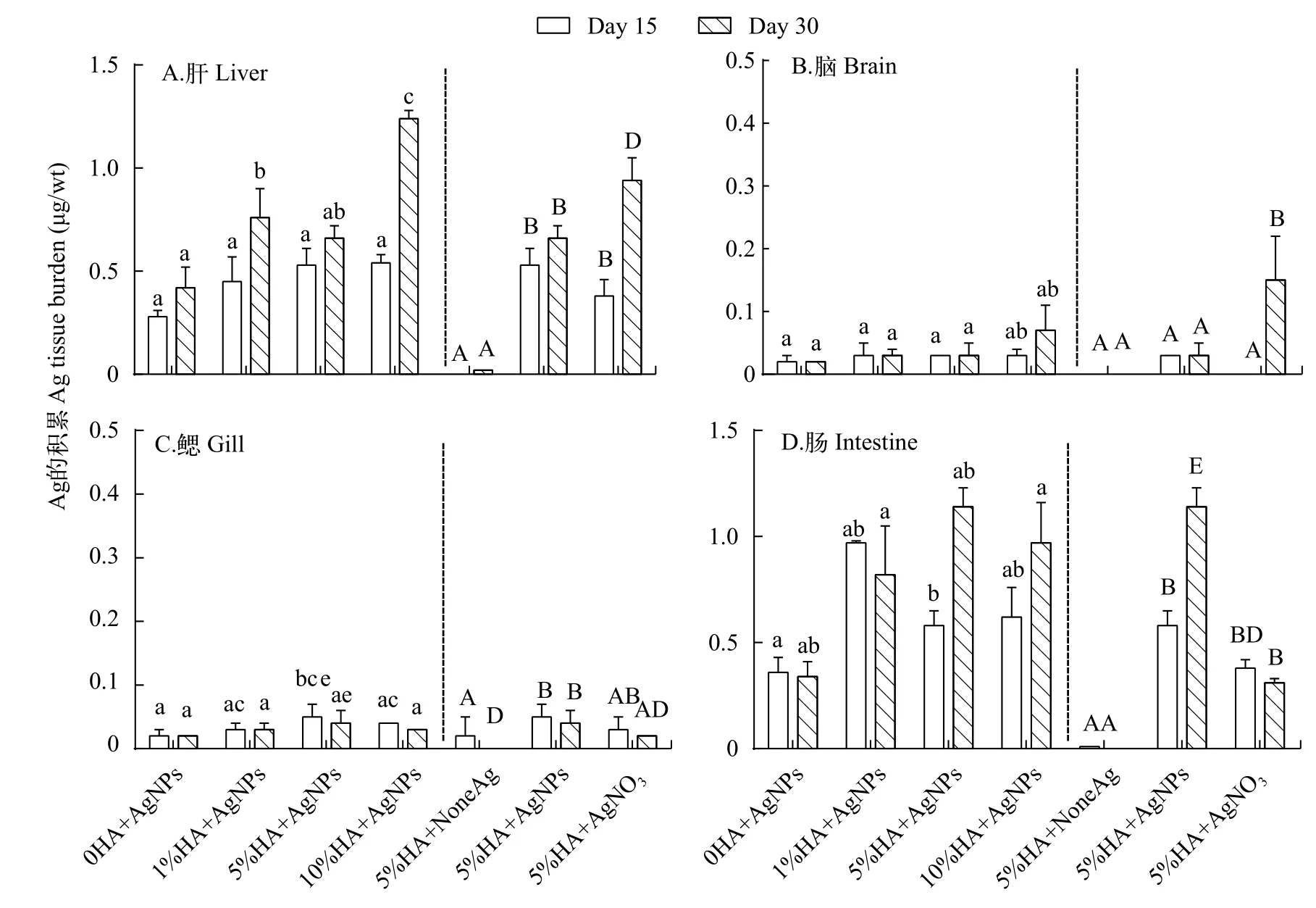
图3 Ag在斑马鱼组织(肝、脑、鳃和肠)中的积累Fig. 3 Accumulation of Ag in tissues (liver, brain, gill and intestine) of zebrafish
2.5 释放到水柱中的银对斑马鱼组织的氧化应激效应
实验中没有发现由于银暴露引起的斑马鱼死亡, 因此我们检测了Ag是否在斑马鱼中引起氧化毒性。如图 4所示, 在沉积物HA含量相同的条件下,暴露30d后, AgNPs处理组中斑马鱼肝脏的CAT和SOD活性显著低于无银组, 而AgNO3处理组则无显著性差异。Devi等[55]报告了类似的结果, 他们观察到斑马鱼暴露于100 μg/L PVP-AgNPs(22—26 nm)15d会降低肝脏中的CAT和SOD活性。此外, Zeng等[53]证明斑马鱼长期暴露于高浓度(1.5—2 mg/L)的PVP-AgNPs可降低CAT和SOD活性。实际上,SOD是对抗活性氧(ROS)的第一道防线, 在此过程中CAT用来分解过氧化氢, 使机体免受损伤。这些酶的活性降低体现了氧化应激效应的增加[53]。因此, 斑马鱼肝脏中SOD和CAT活性的降低可能是由于AgNPs引起的氧化应激效应增加。在一般情况下, 生物体受到外源胁迫, 氧化应激效应增加。但当氧化胁迫的程度超过机体/细胞的承受能力时,其氧化应激体系不足以产生足够的反馈, 此时, 氧化应激效应反而会降低[56]。但在本研究中, Ag处理组中斑马鱼肝脏CAT和SOD的活性显著降低(图 5)。这可能是由于AgNPs引起的长期压力, 氧化损伤超出细胞耐受范围。酶活性水平的降低与氧化应激的增加相对应, García-Sánchez等[56]观察到类似的结果。Cao等[57]也发现, 在大多数时间, 暴露于离子液中的斑马鱼与对照组相比, 抗氧化酶的活性显著下降。沉积物中AgNPs浓度相同时, 暴露期间, 随着沉积物HA含量从0升高到5%, 斑马鱼肝脏中的CAT和SOD活性无显著变化, 但当HA含量升高到10%时, 斑马鱼肝脏的CAT和SOD活性显著降低。这表明沉积物HA含量越高, 斑马鱼肝脏受到的氧化应激效应更强。
在本研究中, 尽管肝脏中SOD和CAT的活性降低, 但它们在脑和鳃中没有显著变化。此外, Na+K+-ATP和Ca2+Mg2+- ATP的活性在肝脏、脑和鳃中也没有显著变化(图 5)。

图4 斑马鱼组织(肝、脑和鳃)中的酶活性(CAT和SOD)Fig. 4 Enzymatic activity (CAT and SOD) in tissues (liver, brain and gill) of zebrafish
2.6 释放到水柱中的银对斑马鱼肠道微生物的影响
肠道内的微生物菌群对机体的健康起着重要作用[58]。积累在肠道中的银会对其本身造成一定的影响, 同时也可能会对生存在其中的微生物造成影响。因此, 我们研究了沉积物中释放到水柱中的Ag对斑马鱼肠道微生物群的影响。如图 6所示, 放线菌和变形杆菌是主要的肠道微生物群, 其次是梭杆菌门和厚壁菌门, 还包括衣原体门和拟杆菌门。这与其他水性暴露研究中的斑马鱼肠道微生物群的物种组成大致相同[59,60]。然而, 在我们的研究中,与其他水性暴露研究相比, 沉积物的存在有利于放线菌的定植, 因此放线菌为该条件下的优势物种。如表 2所示, 随着沉积物中HA含量的升高, 斑马鱼肠道微生物的ACE指数、Chao指数、Shannon指数、Simpson指数和Coverage指数均无明显的变化。在相同的HA含量下, AgNPs处理组和AgNO3处理组与无银组之间的微生物多样性无显著性差异(P>0.05), 表明AgNPs/Ag+暴露不会显著影响肠道微生物群的多样性和丰度。然而, Udayangani等[60]的研究发现, 壳聚糖银纳米复合材料(CAgNCs)的膳食补充剂显著降低了变形菌的丰度, 并增加了梭杆菌和拟杆菌的丰度, 这可能与这项研究中使用的AgNPs浓度更高有关。

图5 斑马鱼组织(肝、脑和鳃)中Na+ K+ - ATP和Ca2+ Mg2+- ATP的活性Fig. 5 Enzymatic activity (Na+K+-ATP and Ca2+Mg2+-ATP) in tissues (liver, brain and gill) of zebrafish
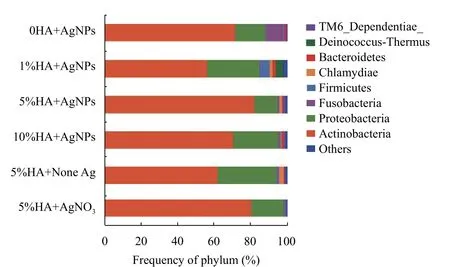
图6 门水平下斑马鱼肠道微生物组成Fig. 6 Intestinal microbiota composition of zebrafish at the phylum level
如图 7所示, 处理组之间的群落组成没有显著差异, 但PCA结果显示在HA含量相同的条件下,AgNPs处理组具有与无银组显著不同的结构。这表明AgNPs能够影响斑马鱼的肠道微生物群的结构。在HA含量相同的情况下, 无银组(5%HA+None Ag组)与银处理组(5%HA+AgNPs组)具有显著不同的群落结构。在AgNPs含量相同的情况下,10%HA+AgNPs处理组与0HA+AgNPs处理组之间的差异最大, 表明沉积物HA含量越高, 释放到水柱中的Ag对斑马鱼肠道微生物群落结构的影响越大。

表2 斑马鱼肠道微生物的α多样性(平均值±标准误, n=3)Tab. 2 Alpha diversity of intestinal microbiota in zebrafish (Mean±SEM, n=3)
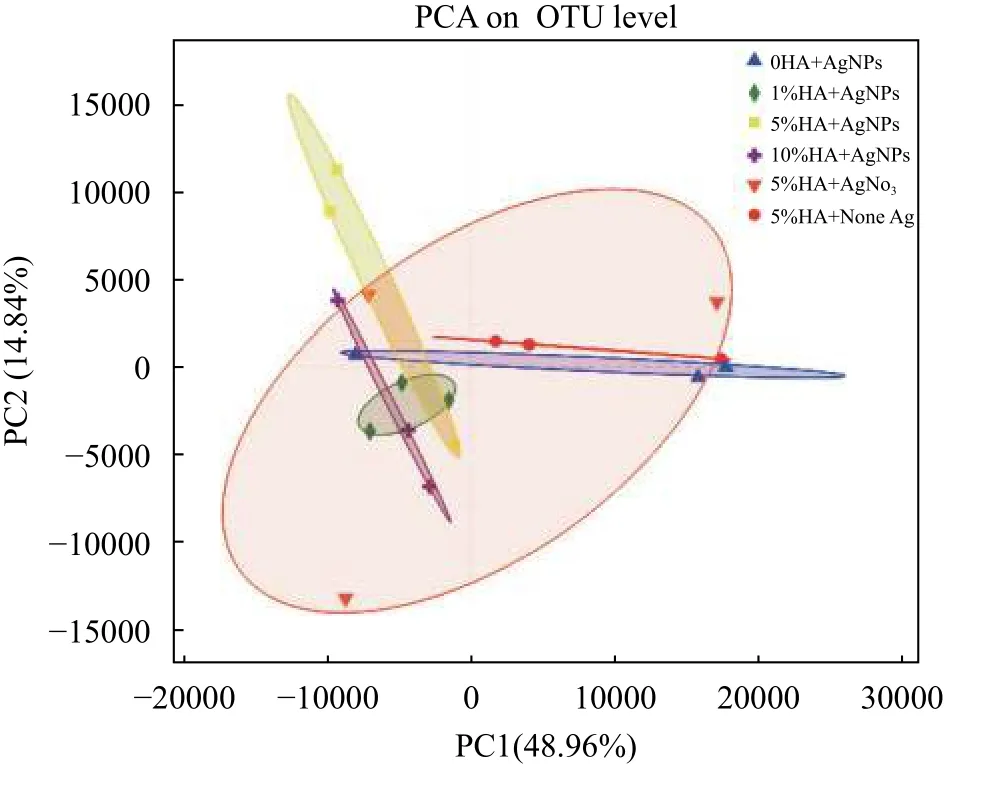
图7 斑马鱼肠道微生物结构的PCA分析Fig. 7 PCA analysis of intestinal microbiota structure in zebrafish
2.7 腐殖酸对释放到水柱中银的毒性效应的影响
我们的研究发现添加HA可促进Ag在斑马鱼体内的积累。在暴露30d后, 肝脏和肠道中的Ag积累分别达到(1.24±0.04) μg/g wt(10%HA+AgNPs处理组)和(1.14±0.09) μg/g wt(5%HA+AgNPs处理组)。这些结果表明具有较高HA含量的沉积物, 释放到水柱中的Ag浓度更高, 斑马鱼组织中Ag的积累也更高。在AgNO3处理组中高HA含量下释放到水柱中的Ag也具有相似的趋势。
具有高HA含量的沉积物, 释放到水柱中Ag浓度更高, 暴露其中的斑马鱼的肝脏组织中Ag积累增加, 并引起斑马鱼肝脏组织中CAT和SOD活性降低,造成斑马鱼组织氧化应激效应。
由图 7可知, 沉积物HA含量越低, 处理组所包含的区域离对照组的距离越近; 沉积物HA含量越高, 处理组所包含的区域离对照组的距离越远。因此, 从沉积物释放到水柱中的Ag影响了斑马鱼肠道微生物的群落结构。相比于低HA含量来说, 沉积物HA含量高, 释放到水柱中的Ag更多, 在肠道中的Ag积累也更高, 对斑马鱼肠道微生物群落结构的影响更大。
3 结论
沉积物中的AgNPs可以释放到水柱中, 且沉积物中HA能够促进AgNPs的释放。释放到水柱中的Ag能够在斑马鱼的肝脏、脑、鳃和肠道等组织中积累, 并能导致斑马鱼肝脏产生一定程度的氧化应激反应, 还能够改变斑马鱼的肠道微生物群落结构。值得注意的是, HA浓度越高, 斑马鱼组织积累Ag越多, 肠道微生物结构变化更大。这些结果意味着汇集到沉积物中的AgNPs是一个潜在污染源, 环境条件(如NOM)变化可导致其环境风险显著增加,应予以重视。
