农杆菌介导大麦无筛选标记转基因植株的获得
2020-10-15龚强王轲叶兴国杜丽璞徐延浩
龚强,王轲,叶兴国,杜丽璞,徐延浩
(1长江大学农学院,湖北荆州 434025;2中国农业科学院作物科学研究所,北京 100081)
0 引言
【研究意义】大麦(Hordeum vulgareL.)是世界第四大禾谷类作物,约占禾谷类作物总产量的8%[1]。大麦营养成分丰富,富含蛋白质、抗性淀粉、纤维素和维生素等,而且大麦抗旱、耐贫瘠、耐盐碱性能较强,适应性广,在应对恶劣环境化和土壤盐渍化等逆境胁迫方面有着重要意义。目前,国内外大麦转基因研究大多以转化效率较高的品种Golden Promise为受体,利用其他商业化大麦进行转化难以获得转基因植株,或者转化效率很低,限制了大麦基因工程育种的步伐。近几年,大麦高质量参考基因组序列和部分基因功能注释不断完善[2],需要对大麦进行功能基因组研究。另外,国内还未发现有关无筛选标记转基因大麦研究的报道。因此,提高大麦的遗传转化效率,拓宽大麦遗传转化的基因型,建立大麦无筛选标记遗传转化体系,对于大麦基因工程改良和产业化种植具有重要意义。【前人研究进展】长期以来,有关大麦遗传转化的研究较少,转化效率较低。1994年 WAN等[3]利用基因枪分别转化大麦 Golden Promise幼胚、愈伤组织和小孢子,首次获得可育转基因株系。TINGAY等[4]利用农杆菌介导法建立了大麦Golden Promise幼胚的转化体系,转化效率 4.2%。TRIFONOVA等[5]通过调整生长调节剂的种类、预培养时间和微损伤等方法,获得大麦转基因植株,转化效率1.7%—6.3%。FANG等[6]将绿色荧光蛋白作为可视标记,以hpt作为筛选基因,利用农杆菌介导转化大麦Golden Promise幼胚,转化效率3.4%。TRAVELLA等[7]依据荧光原位杂交技术(fluorescence in situ hybridization,FISH)检测结果,比较了农杆菌介导和基因枪介导对大麦转化效率和转基因拷贝数等的影响,发现农杆菌介导的转化效率是基因枪的2倍,且在利用农杆菌介导获得的转基因植株中目标基因表达稳定、沉默情况较少。BARTLETT等[8]对农杆菌转化大麦后的再生过程进行了进一步优化,将hpt标记基因和luc荧光素报告基因转化大麦Golden Promise幼胚,转化效率提高到25%。HENSEL等[9]进一步研究了外植体不同处理方法和共培养条件等因素对大麦转化效率的影响,进一步提高了大麦Golden Promise幼胚的转化效率(高达 86.0%),商业化春性大麦品种Optic、Helium和冬性大麦品种Igri、Tafeno等的转化效率也达到0.2%—7.8%。目前,国内有关大麦遗传转化的研究非常少,还处在建立高频再生体系和提高遗传转化效率的研究阶段[10-20]。国内最早获得大麦转基因植株的研究报道出现于 2004年,任江萍等[21]以啤酒大麦品种晋引6号幼胚为材料,用基因枪法对1 200个幼胚进行了轰击,获得了7株阳性植株,转化效率为0.58%,在过表达TrxS的转基因植株中,α-淀粉酶和β-淀粉酶的活性有显著性提高[22]。吕维涛等[23]通过农杆菌介导法将反义磷脂酶Dγ转入大麦,获得了可耐0.7% NaCl的植株。李静雯等[24]利用RNAi抑制B-hordein的合成,降低了大麦品种Golden Promise籽粒蛋白质的含量。随着转基因技术的发展, 转基因植物的安全性已经引起了公众的广泛关注,其中筛选标记基因的存在是转基因植物安全性评价的主要隐患。人们先后提出了几种获得无筛选标记转基因植物的技术,包括共转化法、定位重组体系、多元自动转化载体系统、转座子再定位系统和同源重组体系等,其中共转化法应用最为普遍[25-26]。特别是农杆菌介导的双 T-DNA载体共转化法,不但可以避免将细菌筛选标记转入植物,而且可以从转基因植物中排除nptII、Bar、hpt等筛选标记,在获得安全型转基因植物方面具有独特优势[26]。农杆菌介导的共转化系统已经在很多植物如烟草[27]、大豆[28]、玉米[29]、高粱[30]、水稻[31]和小麦[26]中成功获得无筛选标记的转基因植株。【本研究切入点】虽然大麦Golden Promise的遗传转化效率较高,但是其他大麦品种转化效率仍然很低,需要拓展大麦基因型范围和提高转化效率。转基因大麦安全问题无疑会受到关注,在国内建立大麦无筛选标记转基因系统迫在眉睫。【拟解决的关键问题】本研究拟以优良大麦品种Vlamingh为受体,通过对培养基成分及培养步骤进行优化,建立其高效遗传转化体系。进一步利用农杆菌介导的共转化法将双T-DNA表达载体导入大麦,并通过后代自然分离获得无筛选标记转基因大麦植株。本研究将拓宽大麦转基因的受体基因型范围,为大麦基因功能解析和转基因育种提供高效的转化体系,为安全型转基因大麦材料创制提供技术保障。
1 材料与方法
1.1 植物材料和表达载体
供试材料为澳大利亚主栽大麦品种Vlamingh,播种于中国农业科学院作物科学研究所人工气候室,生长期间的温度为25℃,光周期为16 h光照、8 h黑暗。取授粉后 12—14 d 的幼胚用于遗传转化。T0代转基因大麦植株及时移栽,放置于人工气候室中生长和检测。T1代转基因大麦植株2018年9月种植于中国农业科学院试作物科学研究所温室,用于筛选无筛选标记转基因植株。
植物表达载体 pWMB123由叶兴国实验室构建[26],包含2段独立的T-DNA区域,一段T-DNA区域含有Bar,另一段T-DNA区域含有GUS(图1)。将表达载体pWMB123转入农杆菌菌株C58C1后用于大麦转化。

图1 双T-DNA表达载体pWMB123结构Fig. 1 The structure of pWMB123 vector with double T-DNA regions
1.2 培养基
大麦遗传转化所用的基本培养基为 MS,在 MS培养基中添加不同有机物质(表 1),所有培养基的pH调整为5.8,121℃灭菌15 min。
将大麦幼胚诱导的愈伤组织分为3份,1份转移到过渡培养基(transition medium,TM),另外2份分别转移到分化培养基(differentiation medium,DM)和改良的分化培养基(modified differentiation medium,DMM:DM 培养基添加 kinetin(KT)1 mg·L-1、6-benzylaminopurine(6-BA)0.5 mg·L-1和 1-naphthaleneacetic acid(NAA)0.05 mg·L-1),光照培养2周,诱导绿芽分化。
将完整的大麦幼胚接种到1/2MS培养基上,进行成苗培养,利用该方法探索吲哚乙酸(indole-3-acetic acid,IAA)、吲哚丁酸(indole butyric acid,IBA)和萘乙酸(NAA)不同配比对大麦植株生根的影响。共利用 15种不同生长素配比的培养基对大麦植株的生根效果进行比较(表 2)。此外,根据已发表的文献[9,32],探索添加IBA,且没有其他生长素的第一次筛选培养基(first selection medium,SM1)、DM和大麦再生培养基(barley regeneration medium,BRM,NH4NO30.32 g·L-1、KNO33.64 g·L-1、KH2PO40.325 g·L-1、CaCl2·2H2O 0.441 g·L-1、MgSO4·7 H2O 0.246 g·L-1、NaFeEDTA 27.53 mg·L-1、MnSO4·H2O 84 μg·L-1、H3BO331 μg·L-1、ZnSO4·7 H2O 72 μg·L-1、Na2MoO4·2H2O 1.2 μg·L-1、CuSO4·5 H2O 0.25 μg·L-1、CoCl2·6 H2O 0.24 μg·L-1、KI 1.7 μg·L-1、Vitamin B5 112 mg·L-1、6-BAP 0.225 mg·L-1、L-glutamine 146.4 mg·L-1、36 g·L-1maltose stock, and 196 μL·L-1和 CuSO4·5 H2O 0.245 mg·L-1)的生根效果。

表1 农杆菌介导转化大麦幼胚所用培养基及其组成Table 1 Composition of the media used for Agrobacterium-mediated barley immature embryo transformation (g·L-1)
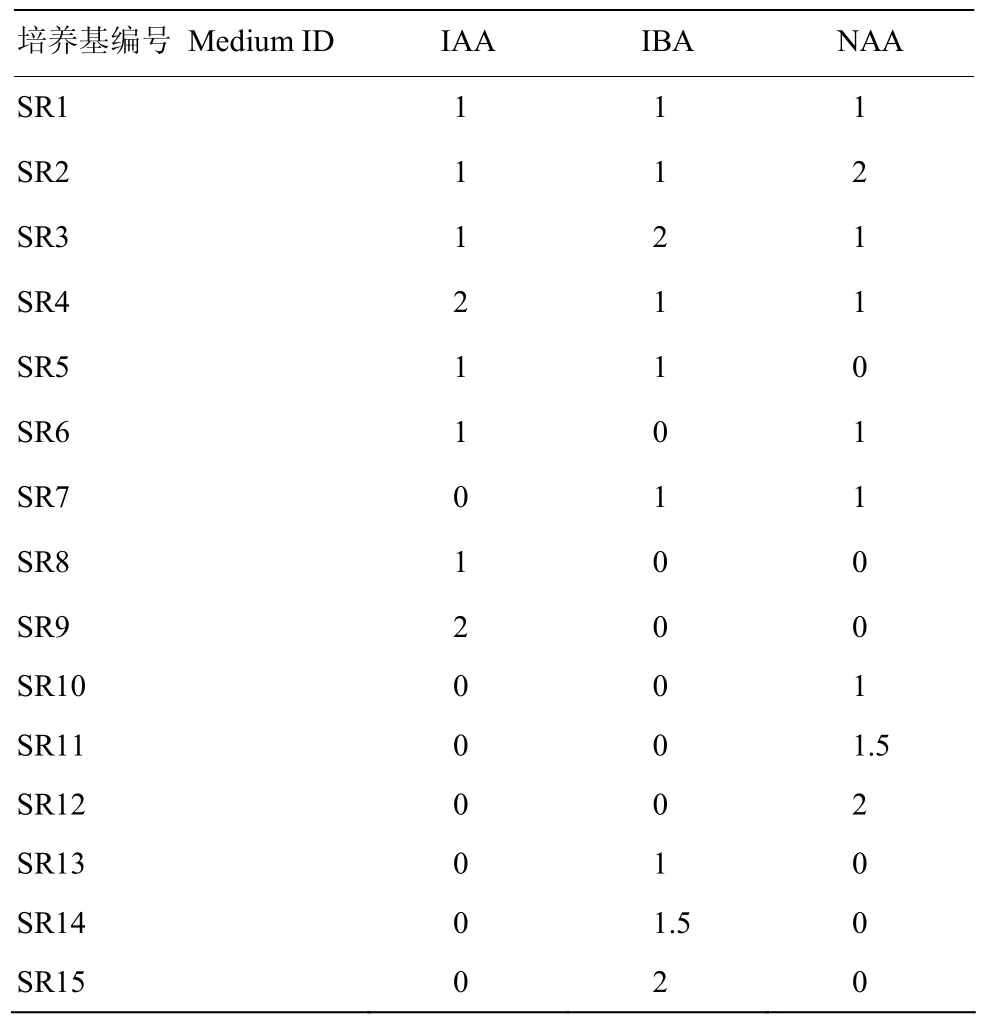
表2 不同激素配比的15种1/2MS生根培养基Table 2 Composition of 15 rooting media with different hormone ratios on the basis of 1/2 MS medium (mg·L-1)
1.3 农杆菌介导转化大麦幼胚
参考 BARTLETT等[8]方法进行农杆菌介导的大麦转化,并进行较大改动,具体步骤如下:
1.3.1 取样和灭菌 分批次种植大麦受体材料,取开花授粉后14 d左右的未成熟大麦籽粒,用70%乙醇表面灭菌 1 min,然后用 15%次氯酸钠震荡灭菌 15 min,最后用无菌水洗4—5次。在显微镜下用解剖刀掀开大麦种皮,用尖镊子小心剥取大麦完整胚放置于没有乙酰丁香酮的侵染液(infection medium,IM)培养基中。
1.3.2 农杆菌侵染和共培养 将携带表达载体pWMB123的C58C1农杆菌28℃过夜培养,取2 mL菌液5 000 r/min离心,然后加入2 mL IM培养基,侵染大麦幼胚约 10 min,然后将胚放入共培养培养基(co-culture medium,CM),23℃黑暗共培养。
1.3.3 愈伤组织的诱导 共培养2 d后,切除胚轴,盾片面向上转移到SM1,进行愈伤的诱导和第一次筛选培养,25℃黑暗培养14 d左右,然后将愈伤组织转移到SM2进行第二次筛选培养,25℃黑暗培养21 d左右。
1.3.4 愈伤组织的分化,转基因苗的生根及移栽 将愈伤组织转移到DM,25℃光照条件下培养2—3周,诱导绿芽分化。然后及时将绿芽转到1/2MS生根培养基(rooting medium,RT)继续25℃光照培养,根系健壮的再生小植株直接移栽到花盆中。
1.4 T0代转基因植株的鉴定
从移栽成活的抗性再生植株上取少量叶片,利用Bar蛋白抗体试纸条法(取1 cm长的叶片,液氮速冻破碎;加入0.4 mL Extractin buffer,将试纸条标有指示箭头的一端浸入 buffer内,静止 1 min,观察 Bar蛋白抗体表达结果)检测Bar,利用组织化学染色法结合PCR扩增检测GUS。
1.5 T1代中无筛选标记转基因植株筛选
种植T0代Bar和GUS均为阳性的转基因植株,利用新型植物基因组提取试剂盒 CW0531(康为世纪生物科技有限公司)从叶片中提取基因组DNA,然后分别用特异引物 Bar-F:5′-ACCATCGTCAACCACT ACATCG-3′,Bar-R:5′-GCTGCCAGAAACCCACGTC ATG-3′和 GUS-F:5′-CAAGGAAATCCGCAACCATA TC-3′,GUS-R:5′-TCAAACGTCCGAATCTTCTCCC-3′对基因组中的Bar和GUS进行PCR检测。PCR扩增体系为2×Taq Master Mix(诺唯赞生物科技有限公司,南京)7.5 μL、10 pmol·L-1引物各 0.5 μL 和 DNA模板50—200 ng,补充ddH2O至15 μL。反应程序为95℃ 5 min;95℃ 30 s,60℃ 30 s,72℃ 1 min,35个循环;72℃ 5 min。取5 μL PCR产物用1%琼脂糖凝胶电泳分析。统计 T1代转基因植株中Bar和GUS的分离情况,筛选只含有GUS不含有Bar的无筛选标记转基因植株。
1.6 Southern blot杂交
利用CTAB法从转基因大麦叶片中提取高质量基因组 DNA,对 30 μg基因组 DNA用限制性内切酶EcoRⅠ进行过夜酶切,然后利用 1%的琼脂糖凝胶在30 V电压下电泳16 h。将凝胶置于20%盐酸溶液中变性处理10 min,用ddH2O清洗2—3次。通过真空泵转膜仪将酶切后的 DNA片段转移至带正电的尼龙膜上。以pWMB123质粒DNA为模板,分别用Bar和GUS特异引物(Bar-F、Bar-R、GUS-F和GUS-R)扩增的片段作为探针,探针标记和杂交过程参考 DIG High Prime DNA labelling and Detection Starter Kit II(Roche,美国)说明书进行。利用Tanon 5200化学发光成像系统显影。
2 结果
2.1 不同培养基对大麦愈伤组织分化植株和生根的影响
将 SM2培养基上的大麦幼胚诱导的愈伤组织分为3份,1份按照BARTLETT等[8]方法转移到TM上,在弱光照条件下(光照条件下用纸遮盖培养皿)培养2周;另外2份分别转移到DM和DMM上。大麦幼胚愈伤组织经在DM和DMM上正常光照培养2周后,发现DMM上大多数愈伤组织的能产生绿芽点或绿苗(图2-A),而DM上仅有少数愈伤组织产生绿芽点(图2-B),表明DMM比DM更适合大麦愈伤组织分化。将在TM弱光条件下继代培养的愈伤组织转移到 DMM 培养 2周后发现,虽然有绿芽的产生(图2-C),但分化率明显不及直接分化的愈伤组织。
将分化培养基上产生大麦再生小植株直接转移到生根培养基1/2MS上,发现再生植株产生白化现象(图3-A)。然后在培养基中添加2.5 mg·L-1的CuSO4,发现可以显著降低白化现象(图 3-B)。因此,后续所有使用的生根培养基都添加了2.5 mg·L-1的CuSO4,但是转基因苗在1/2MS培养基上仍然不生根。
为了解决大麦转基因植株生根困难的问题,首先利用一步成苗培养方法激素不同配比对大麦植株生根的影响。共利用15种不同生长素配比的培养基对大麦植株的生根效果进行了比较(表2),培养10 d后发现单加IBA的生根效果最好(图4)。不同浓度的IBA都可以显著促进大麦的生根,其中1 mg·L-1的生根效果最佳,因此,生根培养基中选择添加到1 mg·L-1的IBA。
虽然一步成苗的大麦植株在添加 IBA的 1/2MS培养基上生根效果很好,但转基因大麦植株在该培养基上生根效果并不理想。因此,又探索了添加IBA的没有其他生长素的SM1、DM和BRM的生根效果。结果表明,大麦转基因植株在仅添加IBA无其他生长素的DM和BRM虽然生长状态不错,但是仍然很难生根,而在添加IBA的无其他生长素的SM1的生根效果很好。

图2 大麦愈伤组织在不同培养基上的分化情况Fig. 2 Differentiation performance of barley callus on different shoot induction medium

图3 CuSO4对转基因大麦小植株白化现象的影响Fig. 3 The effect of copper sulfate on the albinism of transgenic barley plants
2.2 大麦转基因T0代阳性植株的获得和检测
利用携带pWMB123表达载体的C58C1农杆菌共转化了大麦品种Vlamingh的138个幼胚,经过愈伤组织诱导和2次筛选培养,获得了125个抗性愈伤组织,愈伤组织诱导率为91%。抗性愈伤组织经过在优化过的培养基上分化和生根,共获得14棵候选转基因植株(BL1—BL14),转化效率为 10.14%。将幼苗及时移栽至花盆,在温室中生长。然后对 T0代转基因植株进行试纸条检测,并提取基因组DNA进行目标基因的PCR检测。Bar蛋白抗体试纸条检测结果显示全部转基因植株中均含有Bar(图6-A);组织化学染色和PCR扩增结果显示,其中4株转基因株(BL2—BL5)不含有GUS(图6-B和图6-C),说明携带GUS和Bar的2个T-DNA的共转化效率为71.43%。
2.3 T1代中无筛选标记转基因大麦植株的获得
为了获得无筛选标记大麦转基因植株,选取4个Bar和GUS均为阳性的T0代大麦转基因植株BL1、BL6、BL7和BL8,形成T1代株系,研究T1代中外源转入基因的分离情况。理论上,T1代应该分离出4种类型:Bar+GUS—、Bar—GUS+、Bar—GUS—和Bar+GUS+。利用PCR方法共检测了98株T1代转基因植株(图7),在BL8株系获得了2株无筛选标记(Bar—GUS+)植株(表3),共检测到3株Bar+GUS—类型植株,没有检测到Bar—GUS—类型植株,其他植株全部为Bar+GUS+类型(表3)。根据PCR检测结果,选取部分T1代转基因植株,分别利用Bar和GUS作探针进行Southern blot鉴定(图8),进一步证实BL8-15和BL8-19为无筛选标记的转基因植株。在BL-8株系中无筛选标记植株的获得效率为 6.9%,在全部 T1代植株中无筛选标记植株的获得效率仅有 2.04%。以上结果也证实,Bar和GUS可以在大麦转基因后代中稳定遗传和表达。

表3 T1代株系中Bar和GUS的分离情况Table 3 Genotyping detection for the Bar and GUS genes in the selected T1 lines by PCR

图4 大麦再生植株在不同激素配比培养基上的生根情况Fig. 4 Rooting status of transgenic barley plantlets on 15 media with different hormone ratios

图5 不同培养基成分对大麦再生植株生根的影响Fig. 5 Effect of different media containing various auxin ratios on the rooting of transgenic barley plantlets
3 讨论
3.1 大麦遗传转化体系优化

图6 T0代转基因大麦植株鉴定Fig. 6 Identification of T0 transgenic barley plants
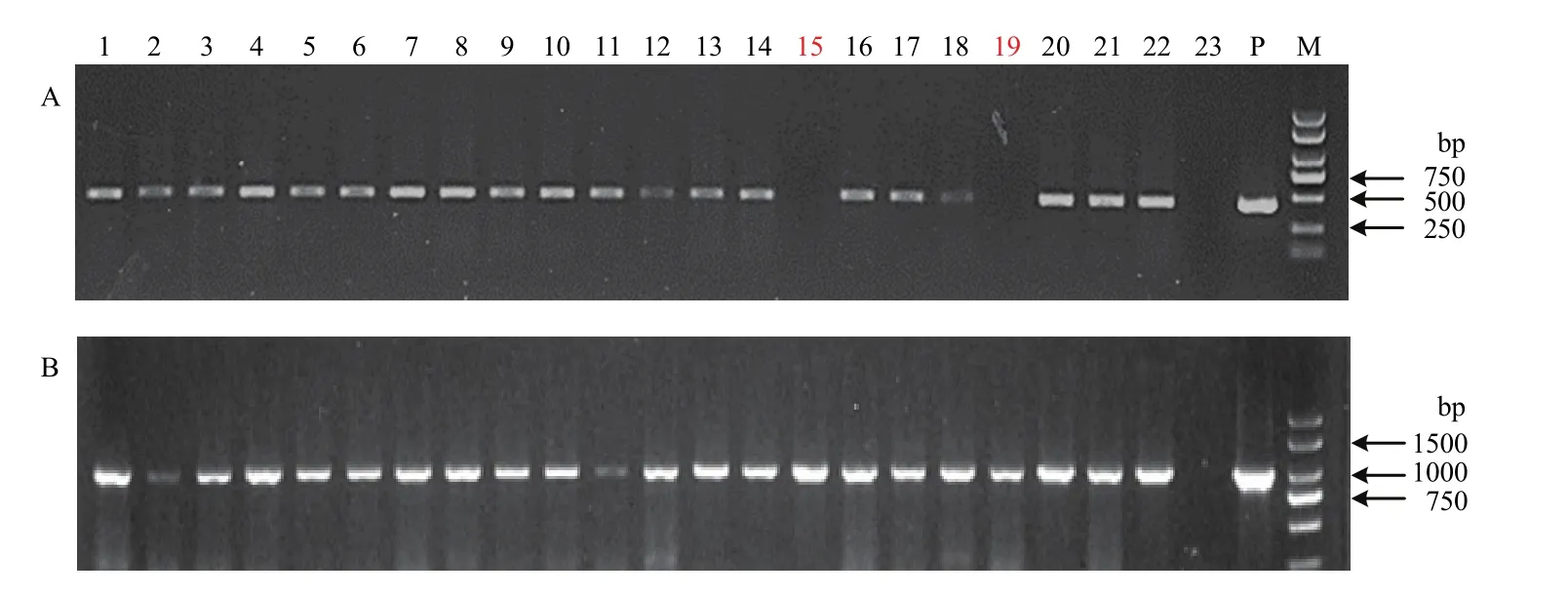
图7 T1代转基因大麦株系BL8中Bar(A)和GUS(B)的PCR检测Fig. 7 PCR detection of Bar (A) and GUS (B) genes in T1 transgenic barley plants
目前,国内外大麦遗传转化的受体品种主要为Golden Promise,基因型范围非常窄。本研究利用了再生能力比较强的大麦品种Vlamingh,拓展了大麦遗传转化的范围。尤其重要的是,该大麦品种为春性,在温室条件下其生长周期比Golden Promise短一个月以上, Vlamingh作为受体材料不但可以缩短转化周期,还可以减少在温室培养材料的水电等消耗。本研究参考 BARTLETT等[8]描述的大麦遗传转化体系,并根据之前的文献报道和叶兴国实验室在小麦遗传转化方面积累的经验,对大麦遗传转化体系进行了优化。首先,发现同样的大麦愈伤组织经过在TM上培养后分化能力下降(图2),因此认为可以省略TM这一步骤,这样不但缩短了大麦的遗传转化过程,也节省了时间和成本。另外,还对分化培养基进行了优化发现DMM分化效果最好(图2)。通过调节生根培养基中不同激素比例(图4)和培养基关键成分(图5),筛选到了生根效果较好的 SM1。利用优化后的转化体系植株再生率很高,但是由于改良分化培养基和生根培养基用了一些愈伤组织和再生植株,减少了器官齐全转基因植株的数量,最终的转化效率只有10.14%,该体系实际转化效率应该更高。
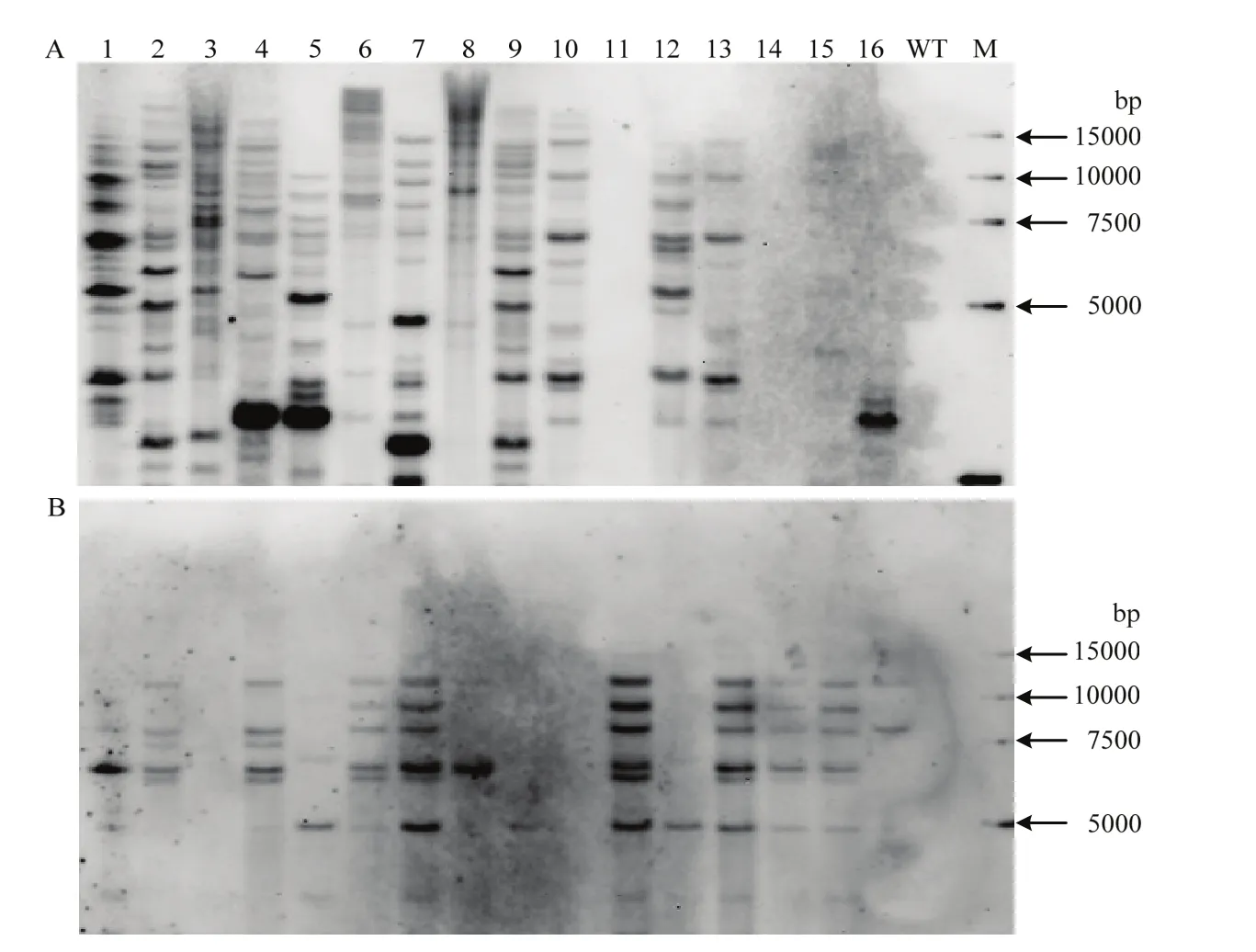
图8 T1代转基因大麦植株的Southern blot鉴定Fig. 8 Southern blot detection of T1 transgenic barley plants
3.2 无筛选标记转基因大麦植株获得效率
WANG等[26]对农杆菌转化双 T-DNA载体的 12个小麦T1株系进行了无筛选标记转基因植株筛选,在3个株系中获得了无筛选标记转基因植株,无筛选标记转基因植株的获得效率分别为 40.0%、14.3%和7.5%;而在全部T1代群体(共12个株系)中无筛选标记转基因植株的获得效率仅为4.3%。MATTHEWS等[33]利用农杆菌转化双T-DNA载体,也成功获得了3个只含目标基因的无筛选标记转基因大麦植株,无筛选标记转基因植株获得效率0.83%—18.55%。根据孟德尔遗传定律,如果筛选标记基因和目标基因在 T0代转基因植株中都以单拷贝形式存在,T1代中无筛选标记植株的获得效率应为 18.75%,而本研究中 BL8株系T1代中无筛选标记转基因植株的频率仅为6.9%。本研究T1代大麦转基因植株的Southern blot鉴定结果显示(图8),Bar和GUS在转基因植株中整合的拷贝数较高,尤其Bar的拷贝数在多数转基因植株中高达10个以上,显著降低了无筛选标记转基因植株的频率。因此,为了提高无筛选标记转基因植株获得效率,需要降低转基因植株中Bar整合的拷贝数。
MCCORMAC等[27]发现双 T-DNA载体中 2个T-DNA区的大小影响外源转入基因整合的拷贝数。WANG等[26]研究结果也表明,携带Bar的T-DNA区段较小导致其在转基因植株中整合的拷贝数较多。在本研究中,含Bar的T-DNA区段长度仅为1.7 kb左右,而含GUS的T-DNA区段长度为4.4 kb,Southern结果也显示GUS基因在转基因植株中的拷贝数确实低于Bar。因此,增加含Bar的T-DNA区段长度可以降低Bar在T0代转基因植株的拷贝数,从而达到增加T1代无筛选标记转基因植株的获得效率。
3.3 获得无筛选标记转基因植物的意义
目前,转基因植物的生物安全性越来越引起了公众关注,成为了转基因植物商业化种植的主要限制。实际上选择标记的存在是转基因作物商业化的主要障碍之一。早期消除选择标记和不必要的载体骨架将有助于克服生物安全性限制,并有助于环境释放转基因大麦。因此,开发无标记的转基因大麦对于大麦转基因育种和大麦转基因商业化有重要意义。
在植物遗传转化研究中使用的标记基因主要有 2种类型:第一种是细菌选择性标记,如bla、kan和aadA等;第二种是植物选择标记,如nptII、Bar和hpt。尽管标记基因应用于遗传转化过程显著提高了植物的转化效率,但是由于大多数选择标记编码抗生素或除草剂的基因,获得转基因植株后这些基因在植物基因组中的存在和表达就变得多余。基因枪介导的共转化可以去除植物选择标记,但是由于细菌选择标记与载体中的目标基因紧密连接,因此不能去除细菌选择标记。基因枪转化线性植物表达盒可以成功去除转基因植物中的所有标记基因[34-35]。因此,无筛选标记转基因植株通常利用基因枪介导或农杆菌介导的共转化方法获得。但是,无筛选标记转基因植株的获得效率与筛选标记基因整合的拷贝数密切相关,而一般情况下基因枪转化产生的拷贝数显著高于农杆菌转化。所以,农杆菌介导的共转化法是获得无筛选标记转基因植株的最优方法。
4 结论
本研究发现改良的DMM能显著提高大麦愈伤组织的分化能力;添加1.0 mg·L-1的IBA的SM1(无其他生长素)的生根效果最佳;利用大麦品种Vlamingh建立了高效遗传转化体系且转化效率可达10.14%,进一步利用双T-DNA的表达载体在T1代中通过自然分离成功获得了无筛选标记大麦转基因植株。
