胺碘酮与决奈达隆诱发脂质代谢紊乱的机制研究
2020-10-15赵圣刚许建江孙凤娟张祥宇张冉江力勤
赵圣刚 许建江 孙凤娟 张祥宇 张冉 江力勤
胺碘酮是广泛应用于临床的抗心律失常药物,但该药可造成肝脏、甲状腺、肺等器官组织损伤,最终导致非酒精脂肪性肝病、肝损伤、肺纤维化和甲状腺功能障碍等[1-3],决奈达隆和胺碘酮可导致总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)水平升高等为主要表现的血脂紊乱[1,4-12]。目前研究认为胺碘酮分子结构类似甲状腺激素,可与甲状腺激素竞争性结合肝脏甲状腺受体β1(thyroid receptor β1,TRβ1),进而诱发脂质代谢紊乱。此外决奈达隆作为胺碘酮的替代药物,在胺碘酮分子结构基础上去除碘,降低了胺碘酮由于高碘导致的甲状腺功能损害的发生率。本研究旨在探讨胺碘酮和决奈达隆诱发血脂代谢紊乱的初步机制,评价药物的安全性,现报道如下。
1 材料和方法
1.1 实验动物与分组 雄性SD大鼠30只由浙江省实验动物中心供应[合格证:SCXK(浙)2008-0033号],清洁级,体重180~220 g。经常规饲养1周后,按照随机数表法分为胺碘酮(AM)组、决奈达隆(DR)组、对照组,每组10只。根据人和动物间体表面积折算系数计算等效剂量和课题组前期试验确定,胺碘酮和决奈达隆药物剂量均为120mg·kg-1·d-1。动物实验条件:SPF级大鼠饲养室、SPF级大鼠实验室,温度(22±2)℃,湿度 50%~70%,光照 150~200 Lx,12 h明暗交替,噪音<50 dB,屏障系统温度、湿度、光照、压力梯度等设有自动控制和显示系统,每笼5只,饲养于不锈钢笼具中。采用不同浓度等容积灌胃给药,给药体积为2 ml/100 g,每天上午给药1次,对照组喂等量的自来水,连续15周。
1.2 药物及试剂仪器 胺碘酮:类白色片,批号:175;决奈达隆:类白色片,批号:HK-59499,由赛诺菲安万特制药有限公司生产。TRβ1、单磷酸腺苷活化蛋白激酶(AMP-activated potein kinase,AMPK)、过氧化物酶体增殖物激活受体α(peroxisome proliferator-activated receptor alpha,PPARα)、低密度脂蛋白受体(low-density lipoprotein receptor,LDL-R)免疫组化采用美国R&D公司试剂盒(批号:AF3059)。LIBOR AEL200型电子分析天平为日本岛津产品,Motic生物显微图像采集分析系统为厦门麦迪奥克仪器公司产品。
1.3 方法
1.3.1 脏器分离 大鼠喂养至满13周,7%水合氯醛1 ml/100g腹腔麻醉后,分离肝脏。
1.3.2 免 疫 组 化 检 测 TRβ1、AMPK、PPARα、LDL-R的表达 肝脏组织切片样本以含H2O2的甲醇溶液(1∶50)灭活过氧化物酶,PBS液充分淋洗,1.5%封闭血清孵育0.5h后,滴加一抗鼠抗TRβ1、AMPK、PPARα(1∶100)孵育过夜,次日 PBS液充分淋洗,二抗孵育0.5 h,PBS液淋洗后滴加AB酶孵育0.5 h,PBS液充分淋洗后加入过氧化物酶底物显色,蒸馏水冲洗后,镜下观察。以95%乙醇10 s×2次,100%乙醇10 s×2次,二甲苯10 s×3次,进行脱水封片,擦去多余二甲苯。阴性对照以PBS液代替一抗,其余步骤同前,显微镜摄片。利用ImageJ软件半定量分析免疫组化图片中TRβ1、AMPK、PPARα、LDL-R表达水平。
1.4 统计学处理 采用SPSS19.0统计软件,计量资料以表示,多组比较采用方差分析,组间两两比较采用LSD-t法。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠肝脏TRβ1免疫组化结果 见图1。
由图1可见,TRβ1多集中于血管周围肝脏细胞上。3组TRβ1面积分数分别为NC组10.75±2.03,AM 组 10.64±2.13,DR 组 10.25±6.63,3 组比较差异无统计学意义(P>0.05)。
2.2 各组大鼠肝脏AMPK免疫组化结果 见图2。
由图2可见,AMPK表达部分位于细胞胞浆中。3组AMPK面积分数分别为NC组26.48±1.23,AM组11.39±6.63,DR组16.06±6.70,虽然 AM组及DR组表达水平低于NC组,但3组比较差异无统计学意义(P>0.05)。
2.3 各组大鼠肝脏PPARα免疫组化结果 见图3。
由图3可见,对照组门管区域胞浆区域可见散在棕色部分,3组PPARα面积分数分别为NC组15.22±2.34,AM 组 13.56±6.72,DR 组 10.45±7.08,3组比较差异无统计学意义(P>0.05)。

图1 各组大鼠肝脏TRβ1免疫组化结果(A:对照组,B:胺碘酮组,C:决奈达隆组;×200)
2.4 各组大鼠肝脏LDL-R免疫组化结果 见图4。
由图4可见,肝脏LDL-R明显表达于胞膜上,其中以NC组最为明显,DR组次之,而AM组表达最低。3组LDL-R面积分数分别为NC组40.53±6.13,AM 组 18.70±10.56,DR 组 26.92±1.84,3 组比较差异有统计学意义(P<0.05),其中NC组高于AM组,差异有统计学意义(P<0.05)。
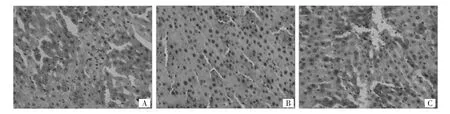
图2 各组大鼠肝脏AMPK免疫组化结果(A:对照组,B:胺碘酮组,C:决奈达隆组;×200)
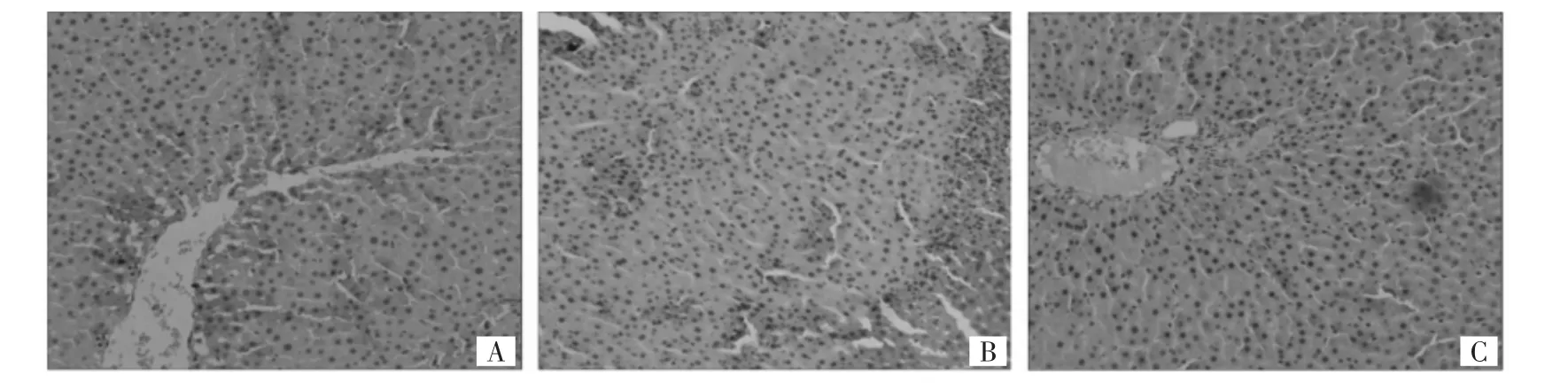
图3 各组大鼠肝脏PPARα免疫组化结果(A:对照组,B:胺碘酮组,C:决奈达隆组;×200)

图4 各组大鼠肝脏LDL-R免疫组化结果(A:对照组,B:胺碘酮组,C:决奈达隆组;×200)
3 讨论
心律失常抑制试验(cardiac arrhythmia suppression trial,CAST)结果发布以后,传统抗心律失常药物治疗观念发生了明显改变,Ⅰ类抗心律失常药物的重要性逐渐降低。胺碘酮作为广谱的Ⅲ类抗心律失常药物,具有低致心律失常和弱负性肌力的特性,所以临床应用更加普遍[1-3]。决奈达隆为胺碘酮的去碘衍生物,两者分子结构均类似甲状腺激素[4-5]。
临床研究及动物基础研究均提示胺碘酮可导致脂质代谢紊乱。Pollak等[6]对服用胺碘酮患者(血脂及甲状腺功能正常)随访18个月观察血脂变化,得出胺碘酮可引起TC、HDL-C、LDL-C以及磷脂水平升高。为进一步分析其机制,可能为胺碘酮干扰胆固醇合成和脂质代谢途径。具体表现为胺碘酮可与甲状腺激素竞争性结合肝脏TRβ1,下调编码肝脏LDL-R的mRNA转录和蛋白表达水平,抑制TG转化为极低密度脂蛋白,抑制脂肪酸β氧化,抑制微粒体转运蛋白等,最终导致以TG、LDL-C、TC等水平升高为主的脂质代谢紊乱[7-9]。而补充甲状腺激素后能减轻胺碘酮导致的脂质代谢紊乱程度,并且胺碘酮导致的肝脏LDL-R下调现象也得到逆转[7]。其他实验同样得出胺碘酮显著升高TG、磷脂酰胆碱和磷脂酰乙醇胺水平,其机制可能与抑制脂肪酸氧化,促进脂质和脂滴形成相关基因和蛋白表达水平有关,导致TG在肝脏细胞内积聚[11-12]。本实验也得出胺碘酮和决奈达隆可降低肝脏LDL-R表达密度,其中胺碘酮影响更为显著,与前述研究相似,解释了课题组前期研究得出胺碘酮和决奈达隆诱发LDL-C水平升高的现象[1]。决奈达隆组肝脏LDL-R表达受影响程度弱于胺碘酮组,其机制可能与胺碘酮诱发甲状腺功能障碍发生率高有关。
胺碘酮本身可导致甲状腺功能障碍,同时由于其分子结构类似甲状腺激素,所以可与甲状腺激素竞争性结合肝脏TRβ1。因此胺碘酮可引起类似甲状腺功能减退特征性的血脂谱变化(TC及LDL-C水平升高等)[10-13]。目前认为甲状腺功能减退患者出现血脂代谢改变的机制可能由于偏低的甲状腺激素水平结合肝脏TRβ受体的能力下降,进而激活TRβ受体下游的AMPK及后续分子的能力下降,如乙酰辅酶A羧化酶、羟甲基戊二酸、p38丝裂原活化蛋白激酶和PPARα等,从而引起糖脂代谢紊乱[13-15]。本实验得出胺碘酮和决奈达隆对肝脏TRβ1表达没有影响,其原理为胺碘酮及决奈达隆只与甲状腺受体β1结合,而不引起受体降解或表达受损[4]。由于干扰了甲状腺激素与TRβ1结合,所以可引起下游AMPK激活障碍。所以本研究显示胺碘酮组及决奈达隆组AMPK表达下降,但对于AMPK下游PPARα未见明显改变的原因可能为PPARα为核受体,具体机制较为复杂,也有可能本研究采用免疫组化方法,技术较为粗糙,出现假阴性。所以需进一步的探讨。
本研究得出胺碘酮及决奈达隆对TRβ1的表达未见明显改变,但对LDL-R影响较大,支持胺碘酮和决奈达隆诱发脂质代谢紊乱现象。但由于本研究仅用了免疫组化一种方法,需要从基因和蛋白角度进一步分析研究结论,所以后期将对胺碘酮与甲状腺激素竞争性结合TRβ1、AMPK、LDL-R蛋白和基因表达水平进一步探讨。
