As2O3对小鼠雄性生殖系统的毒性作用
2020-10-14钟高龙宁芷君伍少峰蒋璇璇唐兆新潘家强胡莲美
万 方,钟高龙,宁芷君,伍少峰,蒋璇璇,唐兆新,李 英,潘家强,胡莲美
(华南农业大学 兽医学院,广东 广州 510642 )
砷(As)是一种普遍存在于自然界的类金属元素,主要以无机砷和有机砷形式存在。随着工业排放量增多,砷污染日渐严重,尤其是水体污染。与此同时,砷及其化合物在日常生产中的应用越来越广泛,在畜牧行业主要用于饲料添加剂和兽药方面[1]。砷可通过消化道、呼吸道和皮肤等途径侵入人体和动物体内,其中摄入含砷的饮用水是砷进入机体的主要来源[2-3]。砷虽然是一种微量元素,但是如果机体摄入过多,就会产生毒性反应[4]。有研究表明早期砷中毒可能会导致掌跖部皮肤角化、色素代谢异常等。高浓度砷还可导致家禽肝肾毒性以及水生动物免疫毒性等[5-7]。目前对于砷生殖毒性的研究也得到了广泛的重视,但砷对雄性生殖系统毒性分子机制还不清楚。本试验应用As2O3建立小鼠砷中毒模型,观察睾丸及附睾组织形态、检测精子活力、体内抗氧化指标、睾酮以及生殖相关基因表达,旨在研究As2O3对雄性小鼠生殖系统的作用机制,为砷中毒防控提供参考。
1 材料与方法
1.1 实验动物和处理实验动物主要采用CD-1 品系小鼠,所有小鼠在试验开始前适应环境2周并保持在受控环境中(14 h光照和10 h黑暗循环),养至6周龄。将40只6周龄雄性小鼠随机分为4组,每组10只。将As2O3粉末溶于10 mol/LNaOH,并用浓HCl调节,使溶液pH值为7.4,试验前用生理盐水分别稀释成所需浓度。4组老鼠分别按照0,3,6,9 mg/kg皮下注射As2O3溶液,连续注射5 d,休息2 d,持续4周。
1.2 试剂和仪器多聚甲醛(paraformaldehyde)购自Sigma公司;切片石蜡、中性树胶购自国药集团公司;TRIzol、PrimeScript Master Mix 购自宝生物工程(大连)有限公司;ChamQ SYBR Color qPCR MasterMix 购自 Vazyme 公司;其他试剂均为国产分析纯。
1.3 组织称质量试验结束后,所有小鼠称质量并处死。快速取出睾丸和附睾并称质量,并如下计算睾丸和附睾系数:睾丸和附睾系数=睾丸和附睾质量(g)×100%/体质量(g)。
1.4 血浆和睾丸砷含量的测定麻醉小鼠后从腹主动脉采血,离心后取血浆,处死后取出睾丸。在分析之前,将血浆和睾丸于-80℃储存。通过电感耦合等离子体质谱(ICP-MS)测定血浆和睾丸中的砷含量。
1.5 睾丸和附睾组织病理学分析用4%多聚甲醛固定睾丸和附睾组织 24 h 后,流水冲洗过夜,依此进行脱水、透明、浸蜡、包埋处理,将组织切片(5 μm)后固定在载玻片上,于37℃展片台过夜,并用苏木精和伊红(HE)染液染色,最后用中性树脂封片,用光学显微镜观察组织病理学变化。
1.6 睾丸和血浆中睾酮的检测将睾丸组织加入适量生理盐水捣碎。血液和睾丸组织3 000 r/min离心10 min后取上清。采用小鼠睾酮ELISA检测试剂盒检测,测定过程严格按照说明书进行(购自江莱生物)。
1.7 精子活力分析将小鼠处死,取出附睾,从附睾尾部将精子挤出,置于精子稀释液中。加入1 μL SYBR-14,37℃孵化培养5 min,再加入5 μL PI,37℃孵化培养5 min。准备载玻片和盖玻片,贴片,在荧光显微镜下观察,拍照。
1.8 睾丸抗氧化指标的检测取质量约30 mg的睾丸组织,加入3 mL的PBS 后在匀浆器中匀浆,在4℃离心机中 1 000 ×g离心10 min,取上清液检测 MDA 含量和GSH-Px水平。测定过程严格按照说明书进行。
1.9 实时荧光定量PCR使用TaKaRa试剂盒进行总RNA提取。利用NanaDrop-2000 微量核酸测定仪检测 RNA 的总浓度和纯度。选用管家基因β-actin基因作为内参基因。引物序列由Primer Express5.0软件设计所得,由生工生物工程(上海)股份有限公司合成。引物序列见表1。
RNA反转录严格按照诺唯赞试剂盒说明书进行。将反转后的cDNA采用染料法进行RT-qPCR反应,反应体系为10 μL:cDNA 1 μL,SYBR premix Ex TaqTM 5 μL,引物F/R均为0.4 μL。反应条件:预变性95℃ 5 min;95℃ 30 s,60℃ 30 s;40个循环,检测β-actin、AR、Miwi和Gpx-5的mRNA转录水平。
1.10 原位杂交从-80℃冰箱中取出睾丸组织块,迅速放入冰冻切片机里,-25℃平衡30 min以上,用冷冻包埋机包埋组织块,切成10 μm厚度的切片,贴于处理过的载玻片上,放在切片盒中于-80℃冰箱保存备用。将切片迅速取出,55℃展片台上烘烤2 min,画好蜡圈,放置在PBS配制的4%多聚甲醛(pH 9.5)中,室温固定1 h,用PBS 漂洗3遍,每遍5 min。用PBS配置的1% Triton-X 100 室温透膜处理 20 min,PBS 漂洗3遍,每遍 5 min。每张切片加400 μL预杂交液,放置于等渗的湿盒中室温预杂交 15 min。

表1 引物序列
将探针从-80℃取出,PCR仪上85℃变性 3 min,快速放入冰上避免复性。按1∶100 的比例将探针加入到杂交液中,充分混匀,然后在每张片子上加入400 μL的杂交液,55℃杂交过夜。将切片放置于55℃水浴摇床中依次用不同浓度的SSC洗涤,用1%封闭液室温封闭1 h。将碱性磷酸酶标记的地高辛抗体(Anti Digo)按照 1∶5 000的比例加到1%的封闭液中,混匀后滴加在切片上,4℃放置过夜。过夜后,缓冲液Ⅰ 洗3遍,每遍5 min。缓冲液Ⅲ中平衡5 min。每张切片上加入400 μL显色液,4℃显色。用甲基绿对染,封片后拍照。

2 结果
2.1 As2O3对小鼠体质量、睾丸质量和附睾质量的影响结果显示,小鼠体质量、睾丸质量和附睾质量在各组之间没有明显的差异(P>0.05)(表2)。
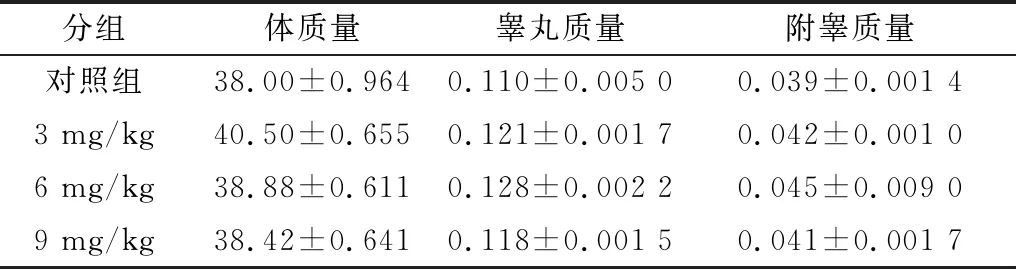
表2 As2O3对小鼠体质量、睾丸质量和附睾重量的影响(n=10) g
2.2 小鼠血浆和睾丸砷含量的测定为了评估As2O3在小鼠体内蓄积的情况,检测小鼠血浆和睾丸中的砷含量。在As2O3处理组中,血浆和睾丸中的砷含量与对照组相比均呈增加趋势,睾丸中所有As2O3处理组差异均显著(P<0.05)。血浆中砷含量在6和9 mg/kg时与对照组相比,差异性显著(P<0.05)(图1)。
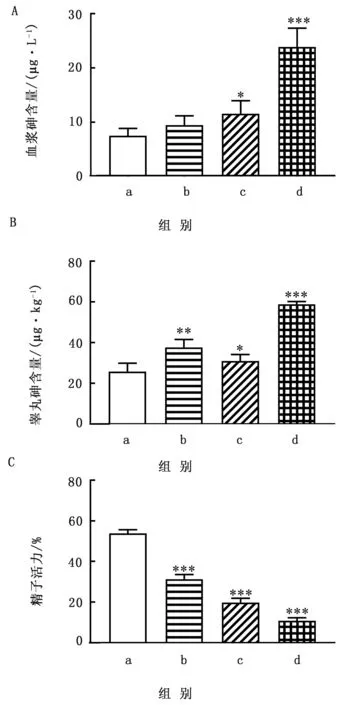
图1 血浆砷含量(A)、睾丸砷含量(B)和As2O3(C)对精子活力的影响 a.对照组;b.3 mg/kg As2O3组;c.6 mg/kg As2O3组;d.9 mg/kgAs2O3组。注:与对照组相比 *P< 0.05;**P<0.01;***P<0.001;n =10。下图同
2.3 As2O3对精子活力的影响使用SYBR-14/PI分析精子活力,结果如图1C所示,随着As2O3剂量的增加,精子活力明显降低,且与对照组相比差异显著(P<0.05)。
2.4 小鼠睾丸组织病理学观察睾丸组织病理学变化如图 2A所示,对照组和3 mg/kg剂量组小鼠睾丸形态正常,6 mg/kg剂量组则出现明显病变,生精小管形态扭曲异常,生精小管内部各级生精细胞排列混乱,9 mg/kg剂量组可以观察到生精小管扩张,紧密排列,生精细胞与外膜出现断层现象。
附睾组织病理学变化如图 2B所示,附睾对照组和3 mg/kg剂量组并未出现明显的变化,6和9 mg/kg 剂量组则出现明显病变,可观察到附睾管内精子和生精细胞显著减少,9 mg/kg剂量组则基本上见不到精子和生精细胞。
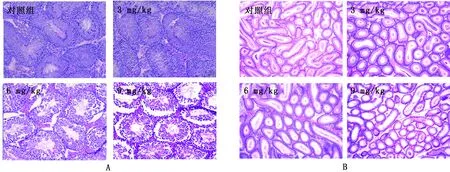
图2 睾丸和附睾的病理学观察 A.不同剂量组As2O3对睾丸形态学的影响;B.不同剂量组As2O3对附睾形态的影响
2.5 血浆睾酮和睾丸睾酮含量为了研究As2O3是否影响睾酮水平,测量血浆和睾丸中的睾酮水平(图3A、B)。可观察到血浆中睾酮随着As2O3剂量的增大,睾酮产生逐渐减少,As2O3处理组与对照组相比差异极显著(P<0.05)。而睾丸中的睾酮,也呈下降趋势,但差异并不显著。
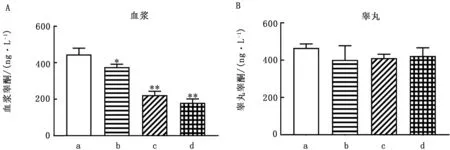
图3 血浆中睾酮 (A)和睾丸中睾酮(B)含量
2.6 As2O3对睾丸抗氧化指标的影响用不同剂量的As2O3处理小鼠后,可见在血浆中,As2O3处理组的MDA含量明显高于对照组(P<0.05)(图4A);在睾丸中,3 mg/kg As2O3剂量组MDA含量下降,随后随着剂量的升高,MDA呈现上升趋势,且差异显著(P<0.01)(图4B)。血浆中的GSH-Px活性与对照组相比,As2O3处理组GSH-Px活性均显著升高(P<0.01)(图4C)。在睾丸中,GSH-Px活性先降低后升高(图4D)。
2.7 原位杂交结果分析MiWi在小鼠睾丸内mRNA定位情况显示,随着As2O3剂量的增大,MiWi在初级精母细胞中的表达显著减少(P<0.05)(图5A)。
2.8 As2O3对生殖相关基因表达的影响为了证实As2O3对AR、GPx5和Miwi表达的影响,采用RT-qPCR的方法检测睾丸中AR和Miwi的mRNA表达以及附睾中GPx5的mRNA表达,结果所示,与对照组相比,As2O3处理组中AR,GPx5和Miwi基因的表达均降低,且差异显著(P<0.05)(图5)。
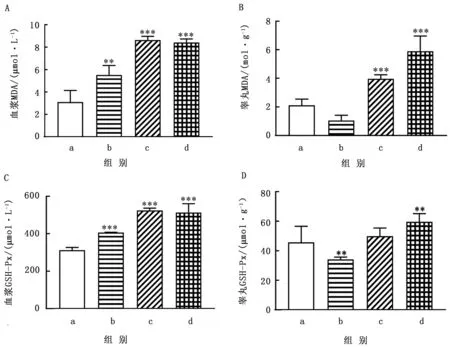
图4 As2O3对血浆和睾丸内抗氧化指标影响 A.血浆MDA;B.睾丸MDA;C.血浆GSH-Px;D.睾丸GSH-Px

图5 Miwi的原位杂交(A)、As2O3对小鼠雄性生殖相关基因AR、GPX-5和Miwi(B,C,D)相对表达量的影响
3 讨论
随着砷污染的日渐严重,关于砷毒性的研究成为一大热点[8]。本研究主要研究As2O3对小鼠雄性生殖系统的毒性作用。睾丸和附睾是雄性动物重要的生殖器官,其中睾丸的主要功能包括精子生成和雄性激素的分泌。附睾主要由输出小管和附睾管组成,它不仅是精子运输通道,还是精子浓缩,获得运动能力和受精能力以及储存精子的部位[9-10]。本试验发现,不论是小鼠的体质量,还是睾丸及附睾的质量与对照组相比均没有明显差异,但血浆和睾丸内的砷含量随着As2O3剂量的升高而显著升高,这表明As2O3在小鼠体内蓄积,但不影响其组织质量。组织病理学观察也可看到As2O3处理组中生精小管形态扭曲异常,生精小管内部各级生精细胞排列混乱,同时附睾管内精子和生精细胞显著减少,而且As2O3剂量越高,病变越严重。这说明As2O3可导致小鼠睾丸、附睾形态和生精功能受损。雄激素和雄激素受体(AR)在雄性生殖系统中十分重要,与生殖系统功能密切相关。睾酮是雄性小鼠中最主要的雄激素,它由睾丸间质细胞分泌,主要作用是促进精子的产生,而精子活力也是评价雄性生殖水平一个重要的指标[11-12]。AR是类固醇激素受体家族成员,属于受配体激活的细胞内转录因子,它与雄激素结合才能发挥雄激素的生理功能[13]。本研究结果显示As2O3会导致机体睾酮含量降低,精子活力随着As2O3剂量的升高而降低,而AR 的mRNA表达量也随着As2O3含量的升高而降低。这表明As2O3可导致雄性小鼠生殖能力下降。
大量研究发现,一些重金属会导致机体内活性氧增多从而使得脂质过氧化,最终导致氧化应激,如果机体内的活性氧在体内蓄积过多则会导致严重的氧化损伤[14-15]。丙二醛(MDA)是脂质过氧化的最终产物,它被广泛用作评价氧化损伤的生物标志物。在抗氧化的防御机制中,GSH-Px是一种能清除活性氧过多生成的脂质过氧化物的一种重要的抗氧化酶[16-17]。而在研究中发现血浆中的MDA含量在As2O3浓度升高时显著升高,而睾丸中的MDA在3 mg/kg As2O3剂量组下降后随着As2O3剂量的升高而升高。血浆和睾丸中的GSH-Px含量变化趋势和MDA是相互对应的。这表明高浓度As2O3会导致机体发生氧化应激,但是在睾丸中低浓度的As2O3未造成MDA和GSH-Px升高的原因很有可能是睾丸中的氧化还原系统可抵抗低浓度As2O3引起的氧化应激。除此之外还发现另外一种抗氧化酶GPx5,它是一种重要的过氧化物分解酶。与大部分过氧化物分解酶不同的是,GPx5只在睾丸和附睾中表达,其在附睾中表达率为90%,在睾丸中表达率为10%。GPx5可保护精子、DNA及脂质体等敏感的生物分子免受活性氧的损伤[18-19],显示As2O3处理组的GPx5表达量与对照组相比显著降低,这表明As2O3可导致小鼠附睾发生氧化损伤,这与附睾的组织病理学观察结果一致。表明As2O3会导致小鼠雄性生殖系统受损。
Miwi是生殖系细胞特异性蛋白,它存在于睾丸曲细精管中的精母细胞和发育阶段的精子细胞中,在粗线期精母细胞高表达,一直持续直到减数分裂后的球形精子细胞中也可检测到,在延长形精子细胞和长形精子细胞中则逐渐减少,在成熟精子中则完全消失[20-21]。如果该基因被敲除,小鼠精子会出现明显的缺陷,导致雄性不育现象[22]。因此研究Miwi对精子发生很有意义。通过原位杂交检测Miwi表达,发现随着As2O3剂量的增加,Miwi在睾丸初级精母细胞中的表达显著降低,而Miwi与精子发生有着密切的关系,表明As2O3可影响小鼠睾丸正常生理功能。综上所述,高浓度As2O3会引起小鼠发生氧化应激,损伤雄性生殖器官,影响正常雄性生殖功能。
