水溶液中展现出的内在美和外在美
———以探究“弱电解质的电离平衡”实验为例
2020-10-14王晓丽
◇ 王晓丽
高中化学反应原理知识理论性强、难度大,这无疑增加了学生理解的难度,笔者在教学过程中不断研究如何让抽象的问题形象化,如何培养学生科学探究的态度,如何更好地展现化学学科的魅力.事实证明把实验引进课堂既能让学生宏观上观察到实验现象又能让学生感受到化学反应的内在变化.实验是化学的灵魂,也是开启智慧大门的钥匙.
1 教学思路
本节课选自鲁科版《化学反应原理》第三章第2节“弱电解质的电离 盐类的水解”的第1课时“弱电解质的电离平衡”,其内容比较抽象.为使理论知识具体化,笔者通过对比实验,定性和定量地测量浓度均为0.1mol·L-1的醋酸和盐酸溶液的pH,让学生了解弱电解质在水溶液中不能完全电离,存在电离平衡.那么弱电解质电离平衡的限度怎样,如何衡量呢?教师应引导学生从化学平衡思想的角度学习电离平衡常数和电离度.
2 基于学科素养的教学目标
1)通过对比实验,能从宏观辨识强、弱电解质溶液与金属反应的实验现象到微观辨析强、弱电解质在水溶液中离子浓度差异现象,发现弱电解质溶液中存在电离平衡.
2)能运用变化观念和平衡思想认识弱电解质电离平衡的平衡常数和电离度,可以衡量弱电解质电离程度的大小.
3)能通过运用证据推理和模型认知学会从本质上分析温度、浓度、外加物质等因素对电离平衡的影响.
3 教学流程及情境设计
探究1认识弱电解质的电离平衡
【问题】 0.1mol·L-1的盐酸和0.1mol·L-1的醋酸分别与Zn粒反应,现象有什么不同?主要是什么原因引起的?
【生】锌与醋酸反应较慢,是H+浓度不同引起的.
【师】如何通过实验证明0.1mol·L-1醋酸中H+浓度比0.1mol·L-1盐酸中H+浓度小,引导学生讨论实验方案.
【动手实验】
实验1:定性对比.锌粒分别与同浓度的盐酸和醋酸反应.
步骤1:取Zn粒1~2粒,分别加入两支试管中;
步骤2:分别加入0.1 mol·L-1HCl溶液和0.1 mol·L-1CH3COOH溶液于两试管中(液面约2cm高),并将两试管放入盛有热水的小烧杯中,对比观察实验现象.
实验2:定量检测.用pH计 测0.1 mol·L-1CH3COOH溶液的pH.
具体操作:打开pH计的电源开关,把黑色冒盖取下,将探头浸入醋酸溶液液面以下,静置1~2秒,读数.实验结束关闭开关.
【现象及结论】Zn粒与0.1 mol·L-1CH3COOH溶液反应比较慢;0.1 mol·L-1CH3COOH溶液的pH大于1.说明CH3COOH在水溶液中不能完全电离,是弱电解质.
【师】引导学生通过观察辨识宏观现象,运用多种方法验证预测.
探究2认识衡量弱电解质电离程度的量
【问题】弱电解质在水溶液中的电离程度有多大?哪些量可以衡量其电离程度?引导学生写出醋酸的电离方程式,列出平衡常数表达式.
【展示】资料数据:室温下,
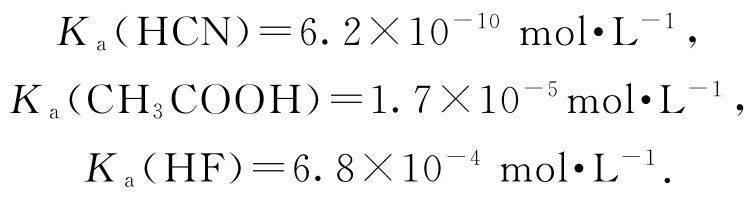
【师】引导学生分析,弱电解质电离程度与电离平衡常数有何关系?
【生】温度一定时,电离常数Ka越大,该弱酸的电离程度越大,其酸性越强.
【师】当温度相同时,如何比较0.10mol·L-1的醋酸和1mol·L-1醋酸的电离程度呢?
【生】当温度相同时,平衡常数Ka大小一定.可从醋酸的电离度(转化率)方面考虑.转化率越大,其电离程度就越大.
【师】引导学生以化学平衡思想解决弱电解质的电离平衡问题.
【结论】电离平衡常数和电离度均可在一定环境下衡量弱电解质电离程度.但当外界条件改变时,会引起电离平衡的移动.
探究3认识弱电解质电离平衡移动的本质原因
【师】以“CH3COOH⇌CH3COO-+H+”为例分析,当温度和浓度改变时,醋酸的电离程度如何改变呢?
【思考交流】分析表格,同一种醋酸溶液随温度升高,Ka如何变化?平衡如何移动?其电离程度如何变化?这说明什么问题?
【展示】资料数据:不同温度下醋酸的电离常数如表1所示.

表1
【生】通过以上数据说明弱电解质电离的过程吸热.升高温度,Ka增大,醋酸的电离程度增大.
【思考交流】室温下,将0.1 mol·L-1的醋酸溶液中加入醋酸钠固体,醋酸的电离程度如何变化?
【生】温度没有发生改变,肯定不能从平衡常数的角度来判断醋酸的电离程度,那就尝试从电离度的角度进行判断,首先根据当c(CH3COO-)增大时,Qc>Ka可判断醋酸的电离平衡向左移动,电离程度减小.
【师】引导学生注重证据推理的能力,用变化观念与平衡思想解决弱电解质电离平衡发生移动的本质原因.
【实验验证】设计实验验证浓度改变对电离平衡的影响.
【设计方案】取少量稀氨水于试管中,加一滴酚酞,再加NH4Cl固体,观察溶液颜色变化.
【现象与结论】取少量稀氨水于试管中,加一滴酚酞,溶液变成粉红色.再加NH4Cl固体,溶液颜色逐渐变浅直至消失.说明c(OH-)减小,NH3·H2O的电离平衡向左移动,电离程度减弱.
实验结果和理论推导结果统一,学生通过实验可以直观感受到弱电解质在水溶液中的平衡移动.
【结论】温度改变时,Ka发生改变,电离平衡发生移动.升温,Ka增大,电离平衡向右移动;降温,Ka减小,电离平衡向左移动.改变浓度时,Qc<Ka时电离平衡向右移动;Qc>Ka时电离平衡向左移动.
探究4捉住本质,构建模型
【师】引导学生构建思维模型(如图1),学会从本质上理解弱电解质电离平衡移动的原因.
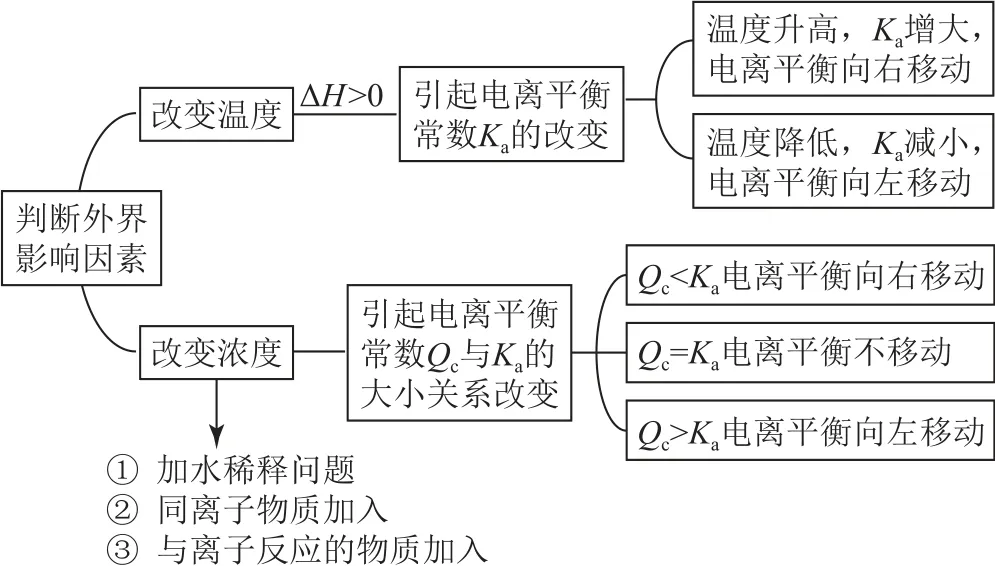
图1 思维模型
【学以致用】试分析室温下,将0.1 mol·L-1的醋酸溶液中加入等体积的蒸馏水(忽略体积变化),醋酸的电离程度如何变化?
【结语】要判断弱电解质的电离平衡如何移动,首先应明确外界因素的改变影响到哪些量的变化.从本质上理解,如温度的改变实质上是改变了电离平衡常数而引起平衡移动,大多数弱电解质的电离过程是吸热的,所以温度越高越促进电离.如浓度的改变(包含单一组分浓度的改变、多个组分浓度的改变)实质是改变了Qc与Ka的相对大小关系.利用Qc<Ka电离平衡向右移动,Qc=Ka电离平衡不移动,Qc>Ka电离平衡向左移动进行判断.
4 教学反思
理解弱电解质的电离平衡对于大部分学生来说都需要一段时间,如果从本质上揭示原因,能便于学生建立模型.本节课以“认识弱电解质的电离平衡—认识衡量弱电解质电离程度的量—认识弱电解质电离平衡移动的本质原因”为主线促进学生化学学科核心素养的发展.
将化学实验引进课堂激发了学生的学习兴趣和认知渴望.从视觉直观地感受科学的魅力,让枯燥的原理知识变得如此美妙与深奥.在备课过程中,从设计实验到药品准备都要考虑到细处,虽然给教师增大了难度,但在实施过程中,不仅在自主、合作、探究新知识的过程中提高了学生的学科素养,还激发了他们学习化学的兴趣与热情.
