CalliSpheres 载药微球治疗原发性肝癌并发肝脓肿4 例分析
2020-10-14朱孟超张庆桥刘洪涛崔艳峰祖茂衡
朱孟超, 张庆桥, 徐 浩, 刘洪涛, 魏 宁, 崔艳峰, 祖茂衡
原发性肝癌是临床常见疾病, TACE 是目前首选的非手术治疗方法,文献报道传统TACE 术后肝脓肿的发生率为0.2%~4.5%[1-2]。近年来CalliSpheres药物洗脱微球(drug-eluting beads, DEB)TACE 治疗原发性肝癌的临床应用逐渐增多[3]。 2018 年1 月至10 月徐州医科大学附属医院收治的167 例原发性肝癌患者施行了CalliSpheres DEB-TACE 治疗,对其中4 例(2.3%)术后并发肝脓肿患者的临床资料进行了回顾性分析,以助于该疾病的诊断和治疗。
1 材料与方法
1.1 临床资料
本组4 例,其中肝细胞肝癌3 例,胆管细胞癌1例。3 例患者为首次行TACE 治疗,1 例患者曾行2 次传统TACE 治疗。 4 例患者术中均使用CalliSpheres载药微球1 g(表1)。 1 例患者(例1)术中使用碘油10 mL 及PVA 颗粒(350~560 μm)100 mg 补充栓塞。1 例(例2)患者术后9 d 联合经皮微波消融(功率50 W,时间8 min)治疗。该例患者于微波消融后2 d,其余3 例分别于TACE 术后6、8、18 d,开始出现高热(39.5℃以上),伴寒战、右上腹痛。4 例患者行实验室检查: 白细胞计数分别为8.0×109/L、13.9×109/L、30.7×109/L、41.2×109/L;中性粒细胞比值升高,分别为78.4%、92.3%、93.6%、96.8%;降钙素原(PCT)升高,分别为5.08 ng/mL、13.76 ng/mL、15.41 ng/mL 和29 ng/mL;C 反应蛋白(CRP)升高,分别为87 mg/L、144 mg/L、165.1 mg/L 和192 mg/L;血沉升高,分别为45 mm/h、62 mm/h、70 mm/h 和90 mm/h。 4 例患者行CT 平扫检查:3 例肝脏病灶可见气液平面影(其中1 例为大小2 个脓腔),1 例病灶内见大量气体密度影。
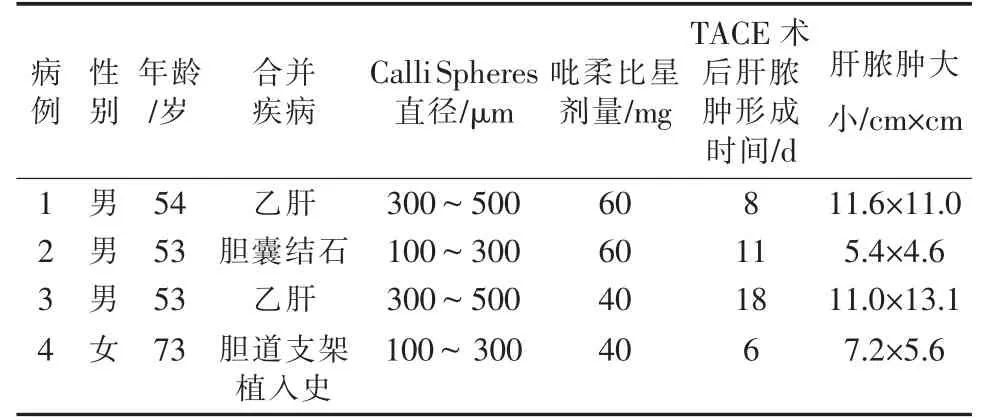
表1 4 例原发性肝癌患者CalliSpheres 载药微球TACE 并发肝脓肿情况
1.2 方法
1.2.1 治疗方法 患者取左侧卧位,彩超定位选择穿刺点,常规聚维酮碘消毒铺巾。 2%盐酸利多卡因5 mL 局麻皮肤穿刺点, 彩超引导下将18 G 穿刺针送入肝脓肿内,退出针芯,回抽见脓液流出,交换进入8.5 F 猪尾引流管(美国COOK 公司),皮肤固定引流管,外接引流袋,引流出脓液后进行细菌培养及药敏试验, 随后用甲硝唑注射液反复冲洗脓腔,直至冲洗液变清。4 例患者留置引流管后,每天经引流管给予甲硝唑注射液(1.25 g∶250 mL)冲洗1 次。根据药敏试验结果,1 例改用利福霉素钠注射液(500 mg/d,6 d) 进行冲洗,3 例仍采用甲硝唑注射液冲洗,同时静脉滴注抗菌药物治疗。 符合下列条件时拔出引流管:①脓腔冲洗液清亮,未见明显浑浊及脓性液体;②每日引流液<10 mL,③患者体温连续3 d 正常,腹痛、寒战等症状消失;④实验室检查示白细胞、 中性粒细胞、PCT、CRP 等相关感染指标恢复正常;⑤CT 检查示脓腔明显缩小或消失。
1.2.2 术后随访 患者引流管拔除后1、3、6 个月及以后每6 个月进行随访, 随访内容包括: 血常规、PCT、CRP 等实验室检查及上腹部CT 检查。
2 结果
4 例患者肝脓肿经穿刺引流后均治疗成功,细菌培养结果及敏感抗菌药物应用等情况见表2。 3例患者引流管拔除后分别随访6、6 和12 个月,均存活,均未再次发生肝脓肿;1 例(例4)患者术后3个月因脑梗死死亡。
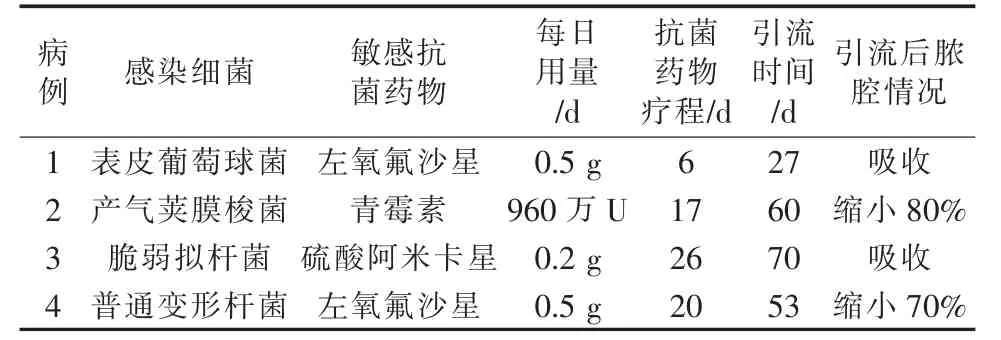
表2 4 例原发性肝癌患者肝脓肿治疗情况
3 讨论
近年来,载药微球在原发性肝癌介入治疗中发展迅速, 治疗原发性肝癌的近期疗效较好[4]。CalliSpheres 载药微球是由聚乙烯醇为原料,具有栓塞时间长、可持续释放化疗药物等特点。 本组4 例患者TACE 术中均使用CalliSpheres 载药微球及吡柔比星后形成肝脓肿,分析基本原因主要为:①肝内胆管的血供来自于伴行的肝动脉分支,载药微球栓塞损伤了胆管血管网, 导致肝内胆管部分坏死,肠道内细菌经胆道进入坏死区域, 进而形成肝脓肿;②肿瘤周围门脉血供内带来的肠道细菌侵入肿瘤坏死区域内, 使肝脓肿形成的风险进一步加大。文献报道过度栓塞可导致肿瘤及周围组织(胆管等)缺血坏死加重,从而加重肝脓肿形成的风险[5]。本组1 例患者TACE 术中CalliSpheres 载药微球栓塞后继续追加碘油及PVA 颗粒进行补充栓塞,导致“过度”栓塞,加大了肿瘤组织的坏死程度,进而诱发肝脓肿形成。 此外,文献报道胆道系统相关疾病为TACE 术后形成肝脓肿的极高危因素[6],可能与胆道疾病或手术易引起胆管损伤导致胆道致病菌感染有关。 本研究中2 例患者分别有胆囊结石病史和胆管支架植入史,脓肿形成原因与上述文献报道相类似。 TACE 联合微波消融引起肝脓肿的发生率较低, 文献报道126 例原发性肝癌患者行传统TACE 联合MWA 治疗,其中1 例形成胆脂瘤,提示肝内胆道损伤[7]。 本组1 例患者CalliSpheres DEBTACE 联合微波消融治疗后出现肝脓肿, 其原因可能与这一方法致肿瘤及周围胆道坏死、损伤程度加重有关。
传统TACE 术后肝脓肿形成的主要致病菌包括大肠埃希菌、奇异变形杆菌、表皮葡萄球菌、肠球菌和消化链球菌等, 其中以大肠埃希菌感染最多见[1,5,8]。与上述文献报道的主要致病菌不同,本组3 例患者脓液分别培养出产气荚膜梭菌、 普通变形杆菌和脆弱拟杆菌, 此3 种菌落均为条件致病菌,普遍存在于肠道中,为人体肠道内正常菌群,肝脓肿形成原因可能是CalliSpheres DEB-TACE 术后,人体抵抗力下降,肠道菌落平衡被破坏,上述菌群易位成为条件致病菌导致肝脓肿形成。 产气荚膜梭菌是一种革兰阳性厌氧芽胞杆菌,是导致气性坏疽的主要致病菌,既可以产生强烈的外毒素,又有多种侵袭性酶,产气荚膜梭菌所致肝脓肿的主要特性是气性坏疽和菌血症[9]。 与既往传统TACE 术后主要致病菌引起的肝脓肿表现不同,本研究中1 例患者肝脓肿由产气荚膜梭菌引起,CT 表现为病灶内大量的气体密度影, 考虑原因主要为CalliSpheres DEB-TACE 术后,病灶及周围肝组织局部微循环缺血、灌注不足,乏氧状态使产气菌易于扩增和气体形成。 文献报道2 例产气荚膜梭菌引起肝脓肿患者均行外科切开引流治疗, 其中1 例成功、1 例死亡[10]。与上述文献不同,本组1 例CalliSpheres DEB-TACE后产气荚膜梭菌感染引起的肝脓肿,采用经皮肝穿刺引流治疗成功。 文献报道传统TACE 术后肝脓肿引流治疗时间2~30 d[11]。 本组4 例患者脓肿引流时间为27~70 d, 高于上述文献报道, 可能与CalliSpheres 载药微球栓塞时间长且缓慢释放化疗药物致肿瘤组织在脓肿引流期间仍有坏死有关。
国产CalliSpheres DEB-TACE 治疗原发性肝癌后可形成肝脓肿且因素较多,经皮肝穿刺引流及应用敏感抗菌药物可获得较好疗效。
