抑制石榴枯萎病菌的化学农药和木霉菌株筛选
2020-10-14马丽婷鲁海菊罗玉端李昱贤
马丽婷,鲁海菊,罗玉端,胡 婕,李昱贤
(1.红河学院生命科学与技术学院,云南蒙自 661199;2.蒙自海关综合技术中心,云南蒙自 661199)
石榴(Punica granatum)是云南重要的经济林果之一。蒙自万亩石榴园享有“中国石榴之乡”的美誉。近年来,由于石榴栽培越来越集中,树龄越来越大,石榴病害日渐严重,石榴枯萎病是其中最严重且最难防的病害之一。石榴枯萎病是一种毁灭性土传植物真菌病害,其病原菌是甘薯长喙壳(Ceratocystis fimbriata)。[1,2]每年4—5月、8—9月为两次发病高峰期,植株感病后叶片黄化、萎蔫,植株从根到主干木质部横切面变为褐色,1周后整个植株萎蔫死亡。[2-3]该病害在中国由刘云龙[2]等首次报道云南蒙自发生石榴枯萎病以来,日益加重,至今仍未找到有效的防治措施。根据文献记载,2004年发病率上升至15.0%,经济损失达1500万以上。[4]且发生石榴枯萎病的石榴园再植健壮的石榴苗也很难成活,石榴枯萎病可导致整个果园的毁灭,[5]严重影响了蒙自石榴产业的可持续发展。目前许多学者针对石榴枯萎病进行研究,据报道,毛忠顺等研究26种化学农药对石榴枯萎病菌的抑制作用,认为枯萎必克、倍得丰、万霉灵、大佳托、果病灵和20%三唑酮 6 种化学农药可作为田间防效研究的备选农药。[6]经袁阳等研究表明,氟菌·氟环唑-大蒜复配对石榴枯萎病有很好的防治效果。[5]诸多研究者对生防菌进行研究发现,枯草芽孢杆菌(Bacillus subtilis)[7]、公牛链霉菌(Streptomyces tauricus)[8]、萎缩芽孢杆菌(Bacillus atrophaeus)[1]、壮观链霉菌(Streptomyces spectabilis)[9]均对石榴枯萎病菌有拮抗作用。大蓟石油醚提取物,[10]木姜子乙醇提取物,[11]苦参、黄连、细辛、板蓝根、芦荟等的提取物,[12]枯草芽孢杆菌YZS-B15和HB菌株及荧光假单胞杆菌YZS-Ph02菌株[13]均对石榴枯萎病菌具有很好的抑制作用。
木霉(Trichodermaspp.)菌是一种普遍存在的真菌,是重要的生防因子。木霉菌通过分泌产生细胞壁降解酶类和次级代谢物、营养竞争等方式,进行重寄生等作用,[14]拮抗其他植物病原菌。经鲁海菊等研究表明,枇杷内生木霉P3.9菌株对枇杷根腐病病菌(Pestalotiopsissp.)、辣椒黄萎病病菌(Verticilliumdahliae.)、辣椒黑斑病病菌(Alternariasp.)、万寿菊叶斑病病菌(Alternariasp.)、康乃馨根腐病病菌(Fusariumsp.)和仙客来根腐病菌(Fusariumsp.)等6种植物病原菌有不同程度的抑菌作用。[15]综上,木霉P3.9等菌株对石榴枯萎病菌是否有抑菌作用,值得我们去探讨。石榴枯萎病危害面积不断扩大,至今仍然没有明确有效地田间防治措施。由于化学农药易产生抗药性,更新换代较快,有必要筛选抑菌效果较好的新农药。此外,石榴枯萎病生物防治仅限于原核微生物及植物提取物,木霉是否对石榴枯萎病菌有抑制作用,至今未见报道。鉴于此,本试验筛选抑制石榴枯萎病菌的化学农药和木霉菌株,为石榴枯萎病的田间防治提供有效的化学农药及生防菌种资源。
1 材料与方法
1.1 材料
1.1.1 供试菌株
石榴枯萎病病原菌甘薯长喙壳(Ceratocystis fimbriata)、木霉(Trichodermaspp.)菌株:J1、PJ1-1、PJ1-2、J2、PJ3、GD1、GM6、PZ1、抗氟硅唑PZ1、J3、抗三唑酮GD1、Y2、抗三唑酮Y2、抗三唑酮GM6、抗氟硅唑GM6、抗三唑酮PZ1、J5、PY2、J4、JD3、GD3、GD5,库存于红河学院生命科学与技术学院植物病理学实验室。
1.1.2 供试化学农药
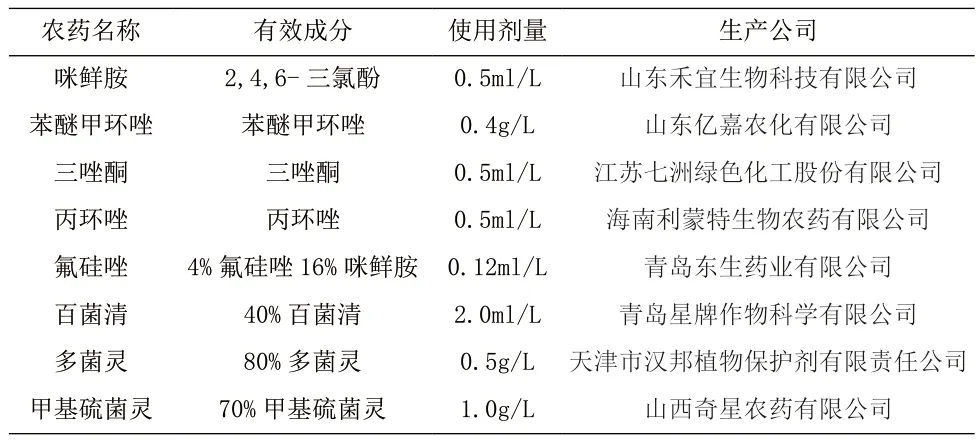
表1 供试化学农药相关信息
1.1.3 供试培养基
PDA:马铃薯 200 g、葡萄糖16 g、琼脂粉20 g、蒸馏水1000 mL。以上培养基配好后在121℃高压灭菌30分钟。材料均购自农贸市场及试剂公司,试剂均为分析纯。
1.2 方法
1.2.1 菌株的扩繁
将库存的供试菌株接种到PDA平板上,石榴枯萎病菌于25℃恒温培养14d,木霉菌于25℃恒温培养7d。用直径5mm打孔器取菌块备用。
1.2.2 测定不同化学农药对菌丝生长的抑制率
采用菌丝生长速率法,[5]将化学农药按照使用说明的浓度加到PDA培养液中,摇匀后倒入灭过菌的培养皿中备用。又将供试活化后的石榴枯萎病菌菌块接种到含化学农药的培养基平板中央,以石榴枯萎病菌菌块接种到不含化学农药的PDA培养基平板中央为对照。每个处理重复3次,28℃下恒温培养7d后,用十字交叉法[5]测量菌落直径,记录菌落扩展情况,并用以下公式计算抑菌率:抑菌率(%)=(对照菌落增长直径-含药培养基上菌落增长直径)/对照增长菌落直径×100。
1.2.3 测定木霉菌株对石榴枯萎病菌的抑制率
采用对峙培养法,[15]将木霉菌块与石榴枯萎病菌菌块两两组合,接种到距离平板中央相等的两个点上,以不接种木霉菌块作为对照,重复3次,于28℃恒温培养7d,测定菌落直径,计算抑制率:抑菌率(%)=(对照菌落增长直径-含药培养基上菌落增长直径)/对照增长菌落直径×100
1.2.4 数据统计
所得数据用Excel进行汇总,计算平均值和作图,所有试验数据均采用 SPSS19.0统计软件Duncan氏多重比较法进行统计分析,计算处理间的差异显著性。
2 结果与分析
2.1 不同化学农药对石榴枯萎病菌的抑制作用
由图1可知,经Duncana多重比较发现,咪鲜胺、丙环唑、多菌灵3种化学农药对石榴枯萎病菌菌落生长差异不显著,但与其余处理间的差异极显著,病原菌菌落直径为0.00mm,抑菌率达100%,抑制效果最好。甲基硫菌灵对石榴枯萎病菌生长的影响与其余处理间差异极显著,病原菌菌落直径为7.00mm,抑菌率为63.79%。苯醚甲环唑、氟硅唑、三唑酮、百菌清4种化学农药抑菌率均小于50%。其中:氟硅唑和三唑酮抑菌差异不显著,而苯醚甲环唑和百菌清抑菌差异极显著。综上,咪鲜胺、丙环唑和多菌灵可作为田间防治石榴枯萎病的首选化学农药。
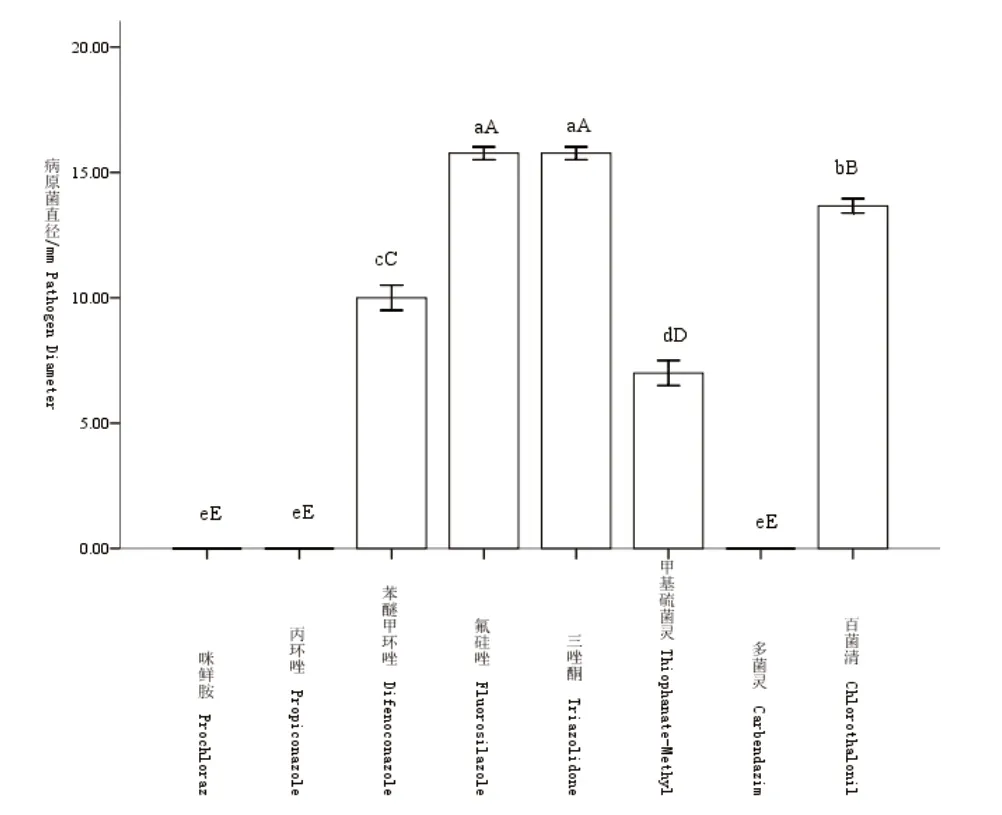
图1 不同化学农药对石榴枯萎病菌的抑制作用
2.2 不同木霉菌株对石榴枯萎病菌的抑制作用
由图2可知,经Duncana多重比较发现,PJ1-1、PJ1-2、J2和PJ3 4个木霉菌株对石榴枯萎病菌菌落生长影响差异不显著,但与其余菌株间的差异极显著,病菌菌落直径分别为8.83mm、9.00mm、8.67mm和8.83mm,抑菌率均达70%以上。J1木霉菌株对石榴枯萎病菌菌落生长的影响,与PJ1-1、PJ1-2、J2、PJ3 4个菌株间的差异极显著,病菌菌落直径为7.67mm,抑菌率为76%,抑制效果最好。PZ1木霉菌株对石榴枯萎病菌菌落生长的影响,与其余菌株间的差异极显著,病菌菌落平均直径为10.83mm,抑菌率为66%。GM6、抗氟硅唑PZ1和J3 3个菌株对病菌生长影响差异不显著,但与其余菌株间的差异极显著,病菌菌落直径分别为11.77mm、12.00mm和11.88mm,抑菌率为63%。GD1与其余菌株间的影响差异极显著,病菌菌落直径为12.5mm,抑菌率为61%。综上,J1、PJ1-1、PJ1-2、J2、PJ3 5个木霉菌株对石榴枯萎病菌抑菌率70%以上,可作为开发生防菌剂的菌种资源。
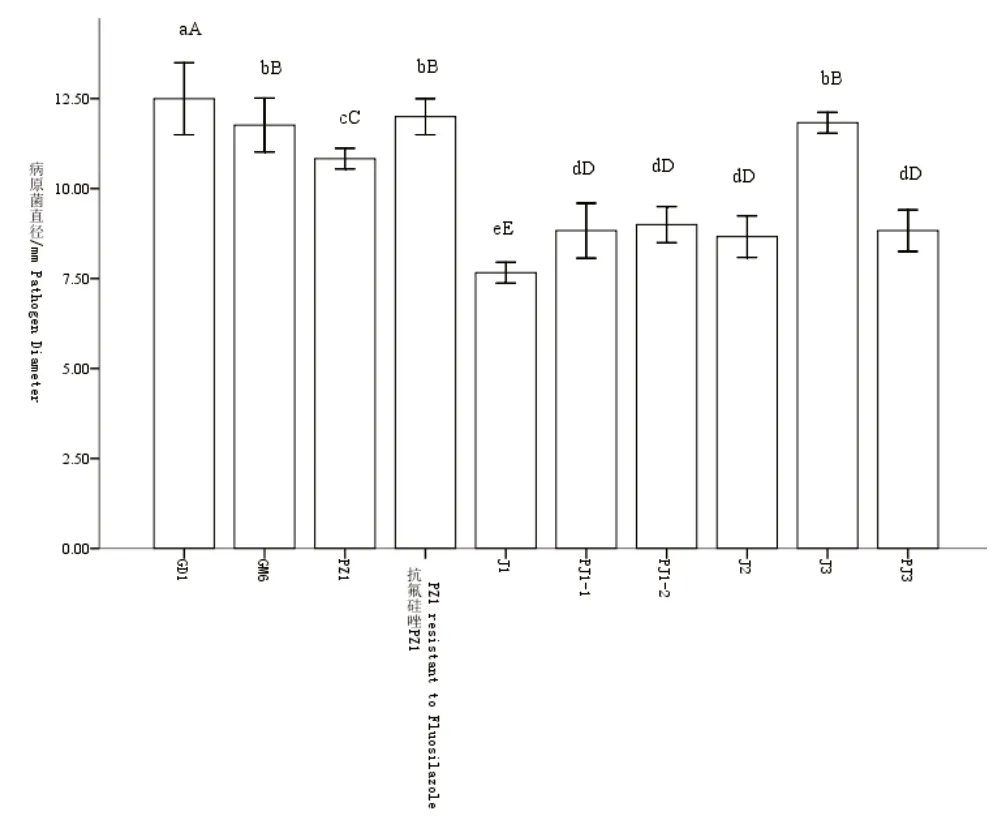
图2 抑菌率在60%以上木霉菌株对石榴枯萎病菌的抑制作用
由图3可知,经Duncana多重比较发现,Y2、抗三唑酮PZ1和J4 3个木霉菌株对石榴枯萎病菌菌落生长的影响,与其余菌株差异极显著,病菌菌落直径分别为13.17mm、13.67mm和17.33mm,抑菌率分别为59%、57%和46%。抗三唑酮Y2和抗三唑酮GM6 2个菌株对石榴枯萎病菌生长的影响差异不显著,但与其余菌株间的差异极显著,病原菌菌落直径分别为14.67mm、14.50mm,抑菌率为55%。J5和抗氟硅唑GM6对石榴枯萎病菌生长的影响差异不显著,但与其余菌株间的差异极显著,病菌菌落直径均为15.83mm,抑菌率为51%。JD3、GD3和GD5 3个菌株对石榴枯萎病菌生长的影响差异不显著,但与其余菌株间的差异极显著,病菌菌落直径分别为20.00mm、19.83mm和19.33mm,抑菌率在38%-40%之间。

图3 抑菌率在60%以下木霉菌株对石榴枯萎病菌的抑制作用
3 讨论
8种化学农药均对石榴枯萎病菌有抑制作用。其中:首先是咪鲜胺、丙环唑、多菌灵3种农药的抑菌效果最好,抑菌率高达100%,这与何平[16]等试验结果相符。其次是甲基硫菌灵,抑菌率为63.79%。苯醚甲环唑、氟硅唑、三唑酮、百菌清4种农药抑菌作用差且均小于50%。其中:多菌灵对石榴枯萎病菌室内抑菌率为100%与毛忠顺[5]等试验研究结果不一致,二者相差两倍多。苯醚甲环唑抑制效果差与何平[16]试验结果一致。三唑酮和百菌清对石榴枯萎病抑制率低与毛忠顺[5]等的试验结果,二者抑菌率相差四倍多,这可能病原菌发生突变、药剂升级等原因有关。因此,在投入大田使用前应做室内抑菌率检测。另外,根据张德胜等报载,苦参碱与甲基硫菌灵、百菌清和异菌脲混配使用对甘薯长喙壳的抑制作用均优于单独使用。[17]今后,防治石榴枯萎病应选择使用混配剂。
22个木霉菌株均对石榴枯萎病菌具有抑菌作用。抑菌率在22%~76%之间。其中:效果最好的是J1、PJ1-1、PJ1-2、J2和PJ3 5个木霉菌株,抑菌率均达70%以上。根据鲁海菊等研究,PJ1-1、PJ1-2、PJ3抗药性木霉菌株对病原菌的抑菌率高于原始菌株,[18]其中:此次检测PJ1-1、PJ1-2抑菌率与鲁海菊等试验结果不一致,可能与菌株退化酶活性降低等原因有关。萎缩芽孢杆菌(Bacillus atrophaeus)[1],板蓝根、芦荟的提取物[12]对石榴枯萎病菌的抑菌作用比此次检验表现最好的木霉菌株低5%-20%。枯草芽孢杆菌(Bacillus subtilis)[7]、公牛链霉菌(Streptomyces tauricus)[8]、壮观链霉菌(Streptomyces spectabilis)[9]、大蓟石油醚提取物[10],木姜子乙醇提取物,[11]苦参、黄连、细辛的提取物,[12]枯草芽孢杆菌菌株YZS-B15 和HB 及荧光假单胞杆菌菌株YZS-Ph02[13]对石榴枯萎病菌的抑制率比此次检验表现最好的木霉菌株高5%-30%。但是,木霉菌和病原菌的相互作用机制在分子水平上有明显的优势,木霉菌具有延迟干旱胁迫和抵御病原菌侵害等功能,[19]提高农作物的抗逆性。同时,木霉菌及其代谢产物还能促进植物生长,增加植物对营养物质的吸收利用,提高农产品产量,而且其广泛存在于大自然,取材方便,成本低。综上,利用木霉菌株防治石榴枯萎病的方案是可行的。根据文献记载,木霉菌对黄瓜枯萎病[20]、香蕉枯萎病[21]、蔬菜土传病害[22]等多种土传真菌性病害均表现出很好的防治效果,说明木霉菌对土传真菌病害的抑制具有广谱性,进一步说明了从22个供试木霉菌株中筛选抑菌率高的木霉菌株来防治石榴枯萎病是可行的。此外,木霉与化学农药协同防治苹果轮纹病,[23]木霉菌与三唑酮混配对西瓜枯萎病的防效,[24]木霉菌与多菌灵协同防治灰霉病[25]等试验表明,菌-药复配表现出明显的增效作用,且降低了化学农药的用量。此次检验抗药性木霉菌株PJ3抑菌率高于原始菌株,且本身的抗药性可弥补木霉菌株缺乏抗药能力的缺陷,保证其更好地发挥药效。但抗药性木霉菌株PJ3与咪鲜胺、丙环唑、多菌灵3种农药复配是否具有协同增效作用,有待进一步研究。因此,课题组后期将进一步试验研究抗药性木霉菌株PJ3与咪鲜胺、丙环唑、多菌灵等3种化学农药复配对石榴枯萎病菌的抑制作用。
通过生物防治的方法来抑制石榴枯萎病菌,不仅能达到抗病增产的效果,减少化学农药的使用,还能减轻农药残留。我国化学农药和肥料过度使用导致生态环境受污染,耕地面积减少、质量退化,农产品农药残留量高等现象较为严重,社会需要更多无毒无污染的生物农药来缓解这些问题。木霉菌是较为广谱且普遍存在的生防菌株,且可防治部分土传真菌病害,[26]是当前具有较大开发价值及潜力的生防菌株,且其对石榴枯萎病菌的防治作用筛选尚属首次,有进一步研发利用的价值。
