基于网络药理学的半夏泻心汤对治疗胃癌的作用机制
2020-10-14黄李冰雪徐文华陈远能
钟 婵,张 涛,黄李冰雪,徐文华,陈远能*
(1.广西中医药大学,广西 南宁 530000;2.广西中医药大学附属瑞康医院消化内科,广西 南宁 530000)
半夏泻心汤出自东汉著名医学家张仲景所撰《伤寒论》,由半夏、黄芩、黄连、炙甘草、干姜、人参、大枣七味药组成,方中重用半夏和胃降逆止呕,为全方之君药;黄芩、黄连苦寒泄热;干姜、半夏辛温散寒,寒热并用,辛开苦降;更佐人参、大枣、炙甘草补益脾胃,共达调和中焦脾胃升降之功;本方为少阳误下成痞所设,是辛开苦降、寒温并用、攻补兼施、调和脾胃的代表方剂[1]。因其配伍精当,效专力宏,故后世广泛应用于各种消化系统疾病的治疗。胃癌(gastric cancer)系指源于胃黏膜上皮细胞的恶性肿瘤,以胃腺癌居多,居全球恶性肿瘤发病率、死亡率前列。胃癌起病隐匿,其发病是多基因、多因素、多步骤参与的复杂病理过程。诸多研究证实半夏泻心汤不仅抑制胃癌细胞的增殖、促进胃癌细胞凋亡,还能治疗胃癌前病变、缓解化疗胃肠道反应的疗效[2-4]。由于胃癌涉及多基因的突变,不能通过干预单一靶点而奏效,而中药复方具有多成分、多靶点、多途径的特性,遵从“君、臣、佐、使”的配伍原则。因此开展中药复方防治胃癌的研究显得尤为重要。由于网络药理学的兴起,使近年来现代生物医药研究的发展飞跃,且在分子生物学水平中引领潮流。如今从单靶点、单药物研究模式进展为多靶点、多成分体系。网络药理学是是基于“疾病-基因-靶点-药物”的相互作用网络,善于多向,侧重整体,全方位识别内外刺激信号的应答,使研发的新药的有效成分能增加靶向疾病作用的机会,进而到达抑制肿瘤的作用。本研究通过网络药理学技术,分析半夏泻心汤对治疗胃癌的作用机制,深入开展半夏泻心汤防治胃癌必将为中医现代化提供坚实的证据和实验支持。
1 材料与方法
1.1 半夏泻心汤化合物的收集 在中药系统药理学分析平台(Traditional Chinese Medicine Systems Pharmacology TCMSP)平台(http://ibts.hkbu.edu.hk/LSP/tcmsp.php)搜索半夏泻心汤7 味全方的所有化合物,共取得1 058 个化合物,包括大枣133 个、人参190 个、干姜148 个、黄连48 个、黄芩143 个、半夏116 个、甘草280 个,为研究该中药方的活性成分奠定基础。
1.2 半夏泻心汤活性成分的筛选 根据筛选阈值口服利用度(Oral bioavailability,OB)≥30% 和类药性(druglikeness,DL)≥0.18,从半夏泻心汤7 味全方中的1 058个化合物中筛选出211 个候选化合物,说明这些候选化合物具有较高的活性成分。
1.3 化合物-靶点网络的构建及拓扑学性质分析 将收集的中药化合物和靶点通过Cytoscape 3.4.0 软件(http://www.cytoscape.org/)构建化合物-靶点网络。在该网络中筛选自由度(degree centrality,DC)较高的节点和相应的介数(closeness centrality,CC)进行拓扑分析,以明确关键的化合物或者靶点。
1.4 交集靶点的获取 结合Comparative Toxicogenomics Database(CTD)、GeneCards、Online Mendelian Inheritance in Man(OMIM)3 个数据库建立的疾病靶点,应用Venny2.1.0(http://bioinfogp.cnb.csic.es/tools/venny/index.html)软件获取中药有效成分与疾病的交集靶点,以探究半夏泻心汤的有效成分对胃癌靶点的靶向作用。
1.5 构建半夏泻心汤靶点蛋白相互作用(PPI)网络 将获得的交集靶基因导入String10.0 软件(http://string-db.org),选取置信度高于0.9 的数据,再将文本数据导入Cytoscape 中进行节点大小和颜色的调整,完整构建半夏泻心汤的作用靶点PPI 网络,从而知晓哪些关键蛋白在网络中起调控作用。
1.6 基因本体(gene ontology,GO)功能与KEGG 通路富集分析 采用David v 6.7 数据库(https://david.ncifcrf.gov/)对交集靶点进行GO 功能富集分析和KEGG 通路富集分析,通过Omicshare 云平台(http://www.omicshare.com/)从KEGG 通路富集分析中筛选出Top20 相关信号通路。以阐明半夏泻心汤的化学成分对胃癌靶点具有一定的生物功能,以及在相关信号通路中的起调控作用。
2 结果
2.1 活性化合物的筛选 根据TCMSP 平台中OB 和DL 的界定值和去重处理,本研究共纳入164 个活性化合物(表1)。
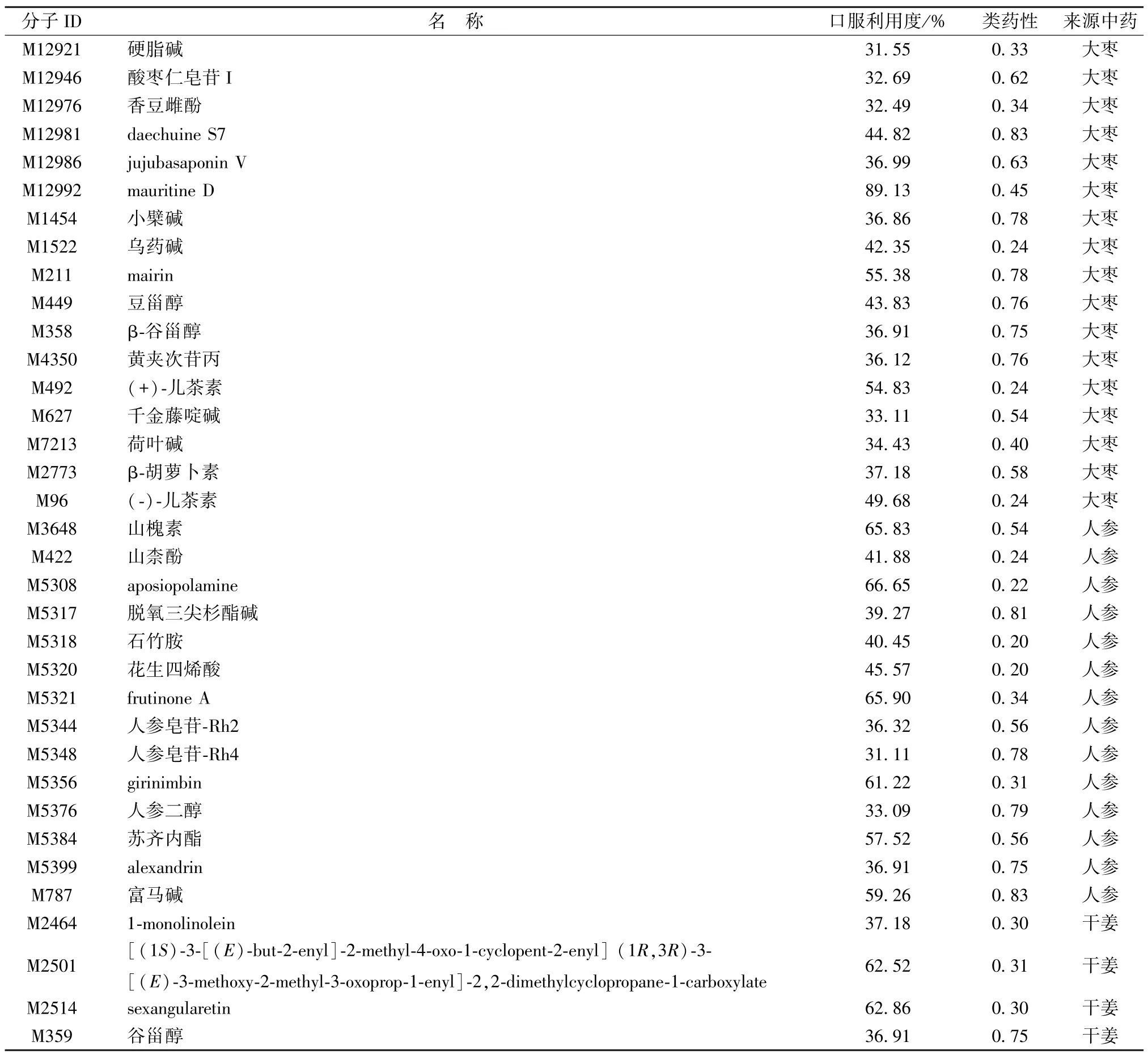
表1 半夏泻心汤中含有的164 个活性化合物基本信息

续表1

续表1

续表1
2.2 半夏泻心化合物-靶点调控网络 由309 个节点(164个化合物节点和145 个靶点节点)和2 156 条边构建的化合物-靶点网络(图1)。在该网络中,蓝色节点表示化合物分子,黄色节点表示药物靶点,每条边代表化合物与靶点之间的靶向作用关系。网络中和节点相连的边数代表一个节点的度值(Degree)。根据Degree 值较高的节点及对应的介数值进行拓扑学性质分析,连接条数最多和集中较密集的化合物和靶点在该网络中起主导作用,即最核心的化合物或者靶点(表2)。分析数据表明,每个化合物的平均靶点数目为13 个,每个靶点平均与15 个化合物相互作用,由此说明半夏泻心汤具有多成分、多靶点的作用,同时也符合中药复方的特性。从化合物来看,有60%的化合物的作用靶点≥15 个,其中有39 个化合物的靶点≥20 个。甘草中的槲皮苷(M98)的作用靶点数最高,能与70 个靶点蛋白发生相互作用;人参中的山柰酚(M422),含有靶点蛋白38 个;大枣中的Stepholidine(M627)和黄连中的(R)-四氢小檗碱(M2903)都与27 个靶点蛋白发生相互作用。其次半夏中的Cavidine(M2670)和黄芩中的汉黄芩素(M173)皆作用于26 个靶点蛋白。从靶点角度来看,连接度最高的为前列腺素内过氧化物合酶2(prostaglandin G/H synthase 2,PTGS2),靶向137 个化合物。紧邻的是钙调蛋白2(Calmodulin 2,CALM2)靶向100 个化合物。而凝血因子VII(Coagulation factor VII,F7)靶向97 个化合物。
2.3 中药有效成分与疾病靶点的Venny 分析 从CTD、Genecards、OMIM 3 个数据库筛选出的911 个胃癌相关靶点,与半夏泻心汤的143 个作用靶点取交集,获得84 个交集靶点(图2)。

图1 半夏泻心汤化合物-靶点调控网络
2.4 半夏泻心汤靶点PPI 网络的构建与分析 运用String数据库和Cytoscape 软件共同建立了半夏泻心汤靶点PPI 网络(图3)。该网络涉及84 个蛋白质节点和192 条连线。用节点的大小和颜色表示Degree 值的大小,节点越大对应的Degree 值越大,颜色由红变蓝对应的Degree 值越大。用边的粗细表示Combine score 值的大小,边越粗Combine score 值越大。根据Degree≥10 的节点制作出前10 个关键蛋白质节点的条形图(图4),其中关键节点包括JUN、TP53、MAPK1、MAPK14、MAPK3、VEGFA、IL6、ESR1、PTGS2、TNF。这进一步说明这些关键蛋白是该网络的核心,掌控着整个网络的重要节点。

表2 化合物-靶点网络的关键节点及其拓扑学性质

图2 中药有效成分与疾病的交集靶点
2.5 GO 富集与KEGG 通路富集分析 将84 个交集靶基因导入DAVID 数据平台进行GO 和PATHWAY 富集分析(图5~7)。该富集分析过程中,共获取213 个GO 条目,生物过程占143 个,分子功能占41 个,细胞组成占29 个。根据P<0.01,取排名前10 的条目分别建立饼状图、折线图、条形图。其中生物过程涉及RNA 聚合酶II 启动子、药物级联反应、缺氧诱导、一氧化氮生物合成过程、DNA 结合转录因子活性的调控、DNA 模板、MAPK 信号激活、氧化还原过程、细胞转录的调控、基因表达的调控、毒性物质应答等方面;分子功能涉及酶结合、类固醇结合、药物结合、血红素结合、MAP 激酶活性、类固醇激素受体活性、蛋白质同源二聚体活性等方面;细胞组成涉及胞外间隙、线粒体、细胞膜表面、溶酶体等方面。采用Omicshare 软件构建PATHWAY 富集分析气泡图(图8),共筛选出75 条通路,根据P<0.01,取排名前20 的通路,主要涉及癌症信号通路、TNF-α 信号通路、HIF-1 信号通路、PI3K-Akt 信号通路、FoxO 信号通路等,由此说明半夏泻心汤的化学成分可干预与这些通路来达到防治胃癌的效用。
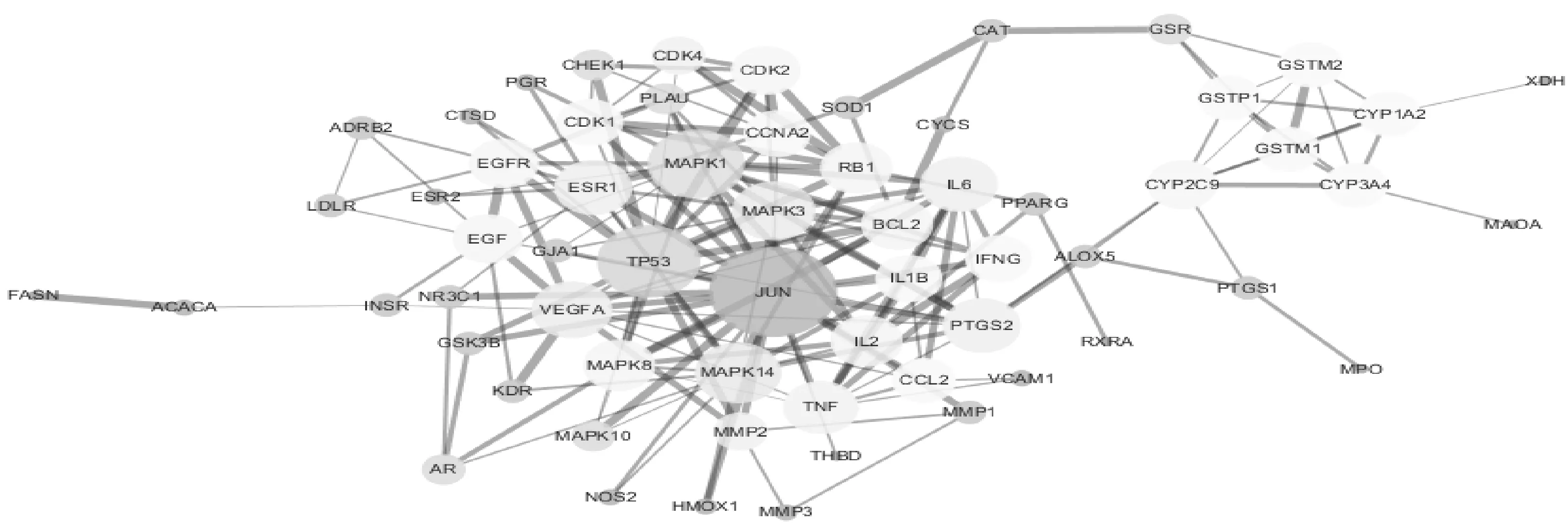
图3 半夏泻心汤靶点PPI 网络
3 讨论
历代医家认为胃癌病机当责之于虚、郁、痰、瘀、毒,以痰瘀郁毒,阴伤气耗,虚实夹杂以及气郁为主要病机,与体质内虚、六淫邪毒、七情内、血瘀、痰结、湿聚、热毒等多种病理产物相互纠结,导致机体阴阳失调,脏腑、经络、气血功能障碍,日久引起病理产物聚结,留滞不去,聚而成癥而发生质的改变,伤、饮食失调、素有旧疾等因素相关;在正虚的基础上,气郁形成有形之肿块[5]。半夏泻心汤由半夏、黄芩、干姜、人参、黄连、大枣、炙甘草7味药组成,方中以辛温之半夏为君,散结除痞,又善降逆止呕;臣以辛热之干姜以温中散寒,苦寒之黄芩、黄连以泄热开痞;又以人参、大枣甘温益气,以补脾虚,为佐药;使以甘草补脾和中而调诸药。全方寒热互用以和其阴阳,苦辛并进以调其升降,补泻兼施以顾其虚实。使寒去热清,升降复常。则痞满可除,呕利自愈[6]。

图4 PPI 网络的关键蛋白节点
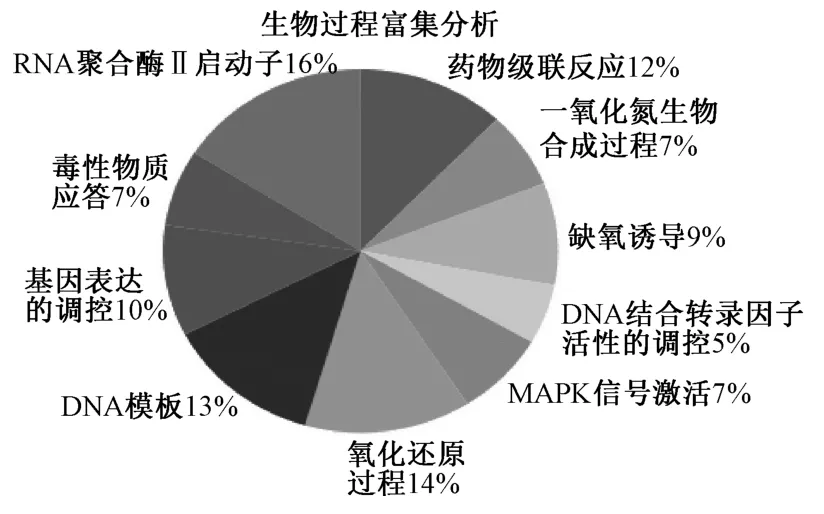
图5 生物过程富集分析

图6 分子功能富集分析
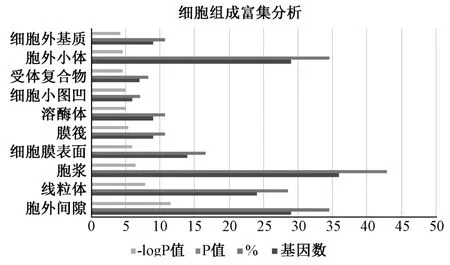
图7 细胞组成富集分析

图8 Pathway 富集分析
通过本研究PPI 网络结果提示作用于胃癌细胞的关键靶点涉及 JUN、TP53、MAPK1、MAPK14、MAPK3、VEGFA、IL6、ESR1、PTGS2、TNF。c-JUN 是原癌基因(其蛋白为JUN),是病毒癌蛋白v-jun 的细胞同源物,JUN是第一个被发现的致癌转录因子。c-JUN 对紫外线诱导的细胞凋亡有保护作用,并与NF-κB 协同作用抑制了TNF-α 诱导的细胞凋亡[7]。肿瘤抑制基因P53(Tumor protein P53,TP53)被称为“基因组的守护者”,是人类癌症中最常见的突变基因(>50%)。当DNA 发生持续损伤时,TP53 可以激活DNA 修复蛋白,若无法修复,即可引发细胞凋亡(即程序性细胞死亡);TP53 还能将细胞周期保持在DNA损伤识别的G1/S 调控点而停止生长,说明TP53 在维持基因稳定和预防癌症形成方面起着重要的作用[8]。丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)是一组能被不同的细胞外刺激,如细胞因子、神经递质、激素、细胞应激及细胞黏附等激活的丝氨酸-苏氨酸蛋白激酶,调节着细胞的生长、分化、对环境的应激适应、炎症反应等多种重要的细胞生理病理过程[8]。实验表明,MAPK14 和MAPK3/1 通路具有控制恶性肿瘤的迁移和增殖[9]。前列腺素合成酶(PTGS2)的表达通常被称为环氧化酶2(COX2),其表达受MAPK3/1 的调节[9]。PTGS2 是前列腺素生物合成过程中的关键酶,与炎症和有丝分裂有关的前列腺素生物合成有关,与PTGS2 相关的疾病涉及消化性溃疡疾病,PTGS2 的上调与细胞黏附增加、表型改变、抗凋亡和肿瘤血管生成有关[10]。在肿瘤细胞中,PTGS2 是前列腺素E2(PGE2)产生的关键步骤,在调节细胞的运动、增殖和抗凋亡等方面起着重要的作用[11]。血管内皮生长因子A(VEGFA)被认为是参与肿瘤血管生成和肿瘤形成的最强有力的细胞因子,肿瘤血管生成通过调节氧气、营养物质和生长因子向肿瘤细胞的输送,在实体肿瘤的生长、侵袭和转移扩散中发挥至关重要的作用[12]。研究阐明VEGFA 存在于不同的人胃癌细胞系上清液中,VEGFA 信号通路的激活促进了胃癌的生长和转移[13]。据报道,胃肿瘤及血液循环中VEGF-A 水平与疾病程度、复发及生存密切相关[14]。雌激素受体(Estrogen Receptor,ESR1)是一种配体激活的转录因子,由激素结合、DNA 结合和转录激活有关的结构域组成,其控制许多细胞过程,包括生殖系统的生长、分化功能,骨骼的生长和维持以及心血管和神经系统的正常功能。研究发现ESR1 具有调控细胞增殖、迁移和凋亡的作用[15]。白细胞介素6(Interleukin 6,IL-6)是一种在炎症和B 细胞成熟过程中起作用的细胞因子,胃癌组织中M2 巨噬细胞的表达与IL-6 的表达呈正相关[16]。肿瘤坏死因子(Tumor Necrosis Factor,TNF)是一种多功能的促炎细胞因子,属于TNF 超家族。这种细胞因子参与调节广泛的生物学过程,包括细胞增殖、分化、凋亡、脂质代谢和凝血,TNF 与自身免疫性疾病、胰岛素抵抗和癌症等疾病相关[17]。由此说明半夏泻心汤的有效成分可与胃癌相关靶点相互作用,基于中药复方多成分、多靶点、多途径的优势,进一步发挥了防治胃癌的效用。根据KEGG 通路分析提示胃癌相关通路涉及低氧诱导因子(hypoxia-inducible factor,HIF)-1 信号通路、TNF-α 信号通路等。HIF-1 是对细胞低氧非常敏感的特意性转录因子,它是机体耐受低氧最重要的物质,可能与胃癌的发生有关[18]。在细胞水平上,低氧使细胞抑制氧化磷酸化水平,ATP 的生成主要依赖加快糖酵解速度来实现,这样可降低细胞的氧消耗,为适应这种转变,细胞上调与糖酵解有关酶和葡萄糖转运蛋白的表达;在系统水平上,局部组织细胞低氧还可提高VEGF 水平,VEGF 作用在内皮细胞上,刺激新血管的形成,以维持局部氧的供应。实验表明,HIF -1α 表达下调可显著抑制胃癌的恶性表型[19],低氧诱导胃癌细胞失活,糖原合成酶激酶-3b(GSK-3b)可能通过负性调节HIF-1a/VEGF 信号通路而抑制胃癌血管生成和肿瘤生长[20],胞核HIF-1α 阳性与胃癌患者不良预后相关[19,21]。近期的研究还发现,TNF-α 所诱导的JNK 途径和NF-κB 途径具有协同性[7],即如果抑制NF-κB 途径则可以增强JNK 的细胞凋亡反应,反之亦然。TNF-α 是主要的炎性细胞因子,其通过调节炎症,细胞增殖、分化、存活和死亡来维持内稳态。TNF 既可诱导细胞死亡,也能促使细胞存活和促炎细胞因子的产生。TNF/ TNFR1 诱导至少两种细胞信号传导复合物,其中受体相关的质膜复合物(复合物I),激活NF-κB和MAPK 以及转录和翻译;胞质复合物(复合体II),其作用是启动细胞死亡;TNFR1 被刺激后,迅速募集TRADD(TNF receptor-associated death domain),TRAF2(TNF-receptor-associatedfactor2),RIPK1(recep-tor-interacting protein)和细胞凋亡抑制剂cIAP1 和cIAP2(Inhibitor ofapoptosis)组装复合物I;RIPK1 和复合物I 的其它组分被cIAP 快速泛素化;泛素(Ub)与RIPK1 和复合物I 组分的结合引起转化生长因子激酶1(TAK1)介导的IKK2,JNK,ERK 和p38α的活化;复合物I 的形成引起NF-κB 和丝裂原活化蛋白激酶(MAPK)的激活,其最终导致细胞因子和促生存蛋白如cFLIP[Fas-associated death domain-like interleukin-1β-converting enzyme(FLICE)-like inhibitory protein]的产生,其是协调炎症反应所必需的;复合物I 形成之后,TNF 还启动基于RIPK1 的细胞质复合物的形成,即复合物II,复合物II 通过激活caspase-8 引发细胞凋亡,或通过RIPK3 和MLKL,引起细胞坏死[22]。研究发现,TNF-α-238G/A 多态性与亚洲人,特别是中国人患胃癌的风险增加有关[23]。PI3K(Phosphatidylinositide 3-kinases),是一种胞内磷脂酰肌醇激酶,由调节亚基p85 和催化亚基p110 构成。PI3K 通过两种方式激活,一种是与具有磷酸化酪氨酸残基的生长因子受体或连接蛋白相互作用,引起二聚体构象改变而被激活;另一种是通过Ras 和p110 直接结合导致PI3K 活化,活化的PI3K 产生第二信使3,4,5-三磷酸磷脂肌醇PIP3,PIP3 与细胞内含有PH 结构域的信号蛋白丝氨酸/苏氨酸激酶(Akt)和磷酸肌醇依赖激酶(PDK1)结合,改变Akt的蛋白结构,使之移位到细胞膜,可使膜上的PDK21 和PDK-2 发生蛋白磷酸化,促使PDK1 磷酸化的Ser308 导致Akt 活化。活化的Akt 通过磷酸化作用激活或抑制其下游一系列底物如Bad(Bcl-xL/Bcl-2 associated death promoter)、Caspase9、NF-κB 等改变,从而调节细胞的增殖、分化、凋亡以及迁移等。Rong Yan 等发现LRIG1 可激活EGFR/PI3K/Akt 信号通路,诱导胃癌细胞凋亡。miR-4295 上调EGFR、PI3K、Akt、p-PI3K 和p-Akt的表达,提示miR-4295通过靶向节LRIG1(leucine-rich repeats and immunoglobulinlike domains 1)的表达,激活EGFR/PI3K/Akt 信号通路,从而促进胃癌细胞增殖,诱导胃癌细胞凋亡[24]。FOXO 转录因子家族成员包括FOXO1、FOXO3、FOXO4 和FOXO6,FOXO[25]。FOXO 在增殖、凋亡、分化、抗应激和代谢反应在内的多种细胞过程中起着至关重要的作用[25]。Yang等[26],Su 等[27]分别发现FOXO3 和FOXO4 的表达缺失与胃癌的生长和转移密切相关,可能成为胃癌治疗的潜在靶点。因此,推测半夏泻心汤活性成分可能靶向作用于上述信号通路中的关键因子从而达到治疗胃癌的目的。
综上所述,本研究通过网络药理学从系统层面来揭示半夏泻心汤治疗胃癌的药理作用机制。推测该方活性成分在缺氧诱导,细胞凋亡、周期、分化、增殖、迁移、侵袭和血管生成等环境下能发挥显著的药效。中药不以消除肿瘤为终极目的,更强调人瘤共存、改善症状的特点,但中药复方防治胃癌的客观证据及科学评价还有漫长的研究之路,由此,探讨半夏泻心汤防治胃癌的研究必将为中医药现代化提供坚实的证据和实验支持。
