5 种中西药复方对昆明小鼠的肝损伤作用
2020-10-14田阳阳代敬文贾文茜刘珍妮慈雷雷吕雄文
田阳阳,代敬文,姜 滔,贾文茜,帅 陈,刘珍妮,慈雷雷,吕雄文
(安徽医科大学药学院 安徽省天然药物活性研究重点实验室 重大自身免疫性疾病安徽省重点实验室,安徽 合肥 230032)
中药是指在中医理论指导下,用于预防、治疗、诊断疾病并具有康复保健作用的物质[1]。我国的传统中药有丸、散、膏、丹等,解放以后又创制了不少新品种统称之为中成药以示与西成药有所区别[2]。近代中医张锡纯应用西药与中药配伍,用石膏阿司匹林汤,治疗温病周身壮热证[3]。到现代,目前已上市中西药复方制剂共648 个品种[4]。中西药复方制剂在中成药中所占比例大约为百分之十左右[5]。中西药复方制剂是“中药、化学药品及天然药物组成的复方制剂”[6]。在我国当前的药品注册分类中“中药、天然药物和化学药品组成的复方制剂”简称中西药复方制剂[7-8]。中西药复方制剂目的是提高疗效,但由于缺乏基础研究、临床试验,说明书不完善等使得临床上多次出现使用这类制剂的不良反应[9]。近年来,在国家发布的76 期药品不良反应信息通报当中,有四期与中西药复方制剂有关,包括维C 银翘片、感冒清片、珍菊降压片、新复方大青叶片、脑络通胶囊五种。药源性疾病一般多发肝损伤,即药物性肝损伤[10]。目前在美国、英国及欧洲,对乙酰氨基酚是导致急性肝功能衰竭的主要原因,在美国该比例为46%,在英国及欧洲该比例为40% -70%[11]。而维C 银翘片、感冒清片、新复方大青叶片都含有对乙酰氨基酚成分,且通报当中出现不同程度的肝毒性。并且,有研究表明[12]A1R、A2AR 共同参与了对乙酰氨基酚诱导的肝损伤。本研究拟通过对KM 小鼠不同给药周期,从而探讨药物对肝脏的毒性及其可能存在的机制。
1 材料
1.1 动物 KM 种小白鼠,清洁级,雄性,体质量18~22 g,购自济南鹏悦实验动物繁育有限公司(生产许可证号SCXK(鲁)2014-0007)。自由进食及饮水,普通动物饲料喂养,模拟自然光照环境12 h 光照,12 h 黑夜中饲养1周后进行实验。
1.2 药物与试剂 感冒清片(广州白云山医药集团股份有限公司,批号4180038);脑络通胶囊(广州白云山光华制药股份有限公司,批号c70040);维C 银翘片(贵州百灵企业集团制药股份有限公司,批号20180422);新复方大青叶片[荣昌制药(淄博)有限公司,批号180201078];珍菊降压片(陕西东泰制药有限公司,批号71010720067);腺苷A1R(S/N3329326)、A2AR(S/N3507839)抗体(北京博奥森生物技术有限公司);β-actin 一抗(北京博奥森生物技术有限公司,批号AH01032107);AST(批号20180307)、ALT(批号 20180306)、TBA(批号20180425)、AKP(批号20180416)试剂盒(南京建成生物工程研究所)。
2 方法
2.1 中西药复方药物性肝损伤模型的建立 将180 只18~22 g 昆明小鼠随机分为空白组、感冒清片组、脑络通胶囊组、维C 银翘片组、新复方大青叶片组以及珍菊降压片组,每组30 只。给药组每天按照体质量给人用剂量的9.1倍[13]的每日用药量,维C 银翘片460 mg/kg;感冒清片400 mg/kg;新复方大青叶片388 mg/kg;脑络通胶囊460 mg/kg;珍菊降压片114 mg/kg,空白组给予等量的生理盐水,每组都为单次灌胃给药。每两天记录1 次小鼠体质量,根据体质量计算给药浓度。分别在给药7、15、30 d后每组随机取10 只鼠眼眶取血后剖腹取肝,称定肝质量。留取血液样本测定肝功能指标,肝组织部分-80 ℃保存,部分4%多聚甲醛固定。
2.2 小鼠体质量和肝指数 根据每次记录的小鼠体质量,计算每组小鼠平均体质量,分别对比给药7、15、30 d 后给药组和空白组体质量变化。计算每组小鼠肝指数,分别对比给药7、15、30 d 后给药组和空白组肝指数变化。
2.3 肝功能生化指标的检测 取血液于1.5 mL 离心管室温放置4~6 h,能看到明显的血清分离后;于4 ℃下,4 000 r/min离心10 min 得血清,利用相应试剂盒酶标仪法测小鼠血清谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(AKP)、总胆汁酸(TBA)水平。
2.4 肝脏组织病理学 采用HE 染色法。通用型4%多聚甲醛固定液固定24 h 后,不同梯度酒精进行组织脱水,二甲苯透明处理。石蜡包埋后进行切片处理,然后展平烤片。烤片后,两次二甲苯脱蜡处理,再经脱水。在苏木精水溶液中染色后,浸在1%盐酸乙醇中片刻后,立即冲洗。酒精伊红染色液染色2~3 min,再次用无水酒精进行脱水处理,再次二甲苯透明处理。中性树脂封片,显微镜下观察。
2.5 肝组织中A1R、A2AR 蛋白表达 采用Western blot法,肝组织破碎裂后离心,取上清液进行蛋白浓度定量,加入蛋白上样缓冲液,100 ℃水浴锅内煮沸10 min。进行SDS-聚丙烯酰胺凝胶电泳(80 V 恒压30 min 浓缩,120 V恒压50~60 min 分离)。电泳结束后用湿转仪在冰水冷却中将相应蛋白转移到PVDF 膜上,膜在封闭3 h 后,TBST 清洗后,加入一抗中。放置过夜,加入二抗摇床孵育1 h,TBST 清洗,显影。
免疫组化染色(Immunohistochemistry staining,ICH)法,4%多聚甲醛固定24 h 后的肝组织制成组织蜡块后进行3~5 μm 厚度切片。经免疫组化染色染色后观察其相应蛋白表达情况。
2.6 统计学分析 采用SPSS 17.0 软件进行分析,用GraphPad Prism 软件验证绘图。以()表示,多组间比较采用单因素方差分析,两个独立样本比较采用t检验,以P≤0.05 为差异具有统计学意义。
3 结果
3.1 小鼠体质量变化 新复方大青叶片组和珍菊降压片组小鼠体质量增长较慢,且和空白组相比较,差异无统计学意义。维C 银翘组、脑络通胶囊组、感冒清片组小鼠体质量较空白组增长较快(P<0.05,P<0.01)。见图1。

图1 各组小鼠给药30 d 体质量变化曲线(n=10)
3.2 小鼠肝指数变化 给药7、15 d 后,各给药组小鼠肝指数和空白组相比,差异无统计学意义。给药30 d 后,感冒清片组、脑络通胶囊组、珍菊降压片组肝指数较空白组,差异无统计学意义。维C 银翘片组、新复方大青叶片组肝指数较空白组增加(P<0.05),见图2。说明给药30 d 后维C 银翘片组、新复方大青叶片组小鼠肝脏有明显的增大。

图2 给药30 d 后各组大鼠肝指数(n=10)
3.3 肝功能生化指标 给药7 d 后,各给药组小鼠肝功能指标AST、ALT、AKP、TBA 和空白组相比,差异无统计学意义;给药15 d 后,仅维C 银翘片组、新复方大青叶片组、珍菊降压片组小鼠肝功能指标TBA 水平较空白组增加,见图3;给药30 d 后,与空白组比较,C 银翘片组、新复方大青叶片组肝功能指标AST、ALT、AKP、TBA 水平增加(P<0.05,P<0.01),见图4。
3.4 肝组织HE 染色结果 给药7、15 d 后,各给药组小鼠肝组织HE 染色结果和空白组相比均未见明显损伤;给药30 d,空白组肝小叶结构正常,无肿胀、坏死,肝小叶及汇管区无炎细胞浸润;与空白组相比维C 银翘片组和新复方大青叶片组肝小叶肝索不规则排列,界限模糊且有炎性细胞浸润,见图5。提示小鼠肝脏有明显损伤。
3.5 维C 银翘片、新复方大青叶片对肝组织A1、A2A 受体表达影响 Western blot 结果显示,维C 银翘片组、新复方大青叶片组肝组织A1R、A2AR 蛋白表达随着给药时间的延长依次表达增高,见图6~7;给药30 d,与空白组比较,维C 银翘片组、新复方大青叶片组A1R、A2AR 蛋白表达升高(P<0.01),见图8~9。免疫组化结果显示,给药30 d 后,维C 银翘片组和新复方大青叶片组相比空白组,A1 受体表达增高(图10、12),A2A 受体表达也略有增加(图11、13)。提示其肝损伤可能与肝组织中A1、A2A 受体表达增高有关。

图3 给药15 后各组大鼠肝功能指标(n=10)
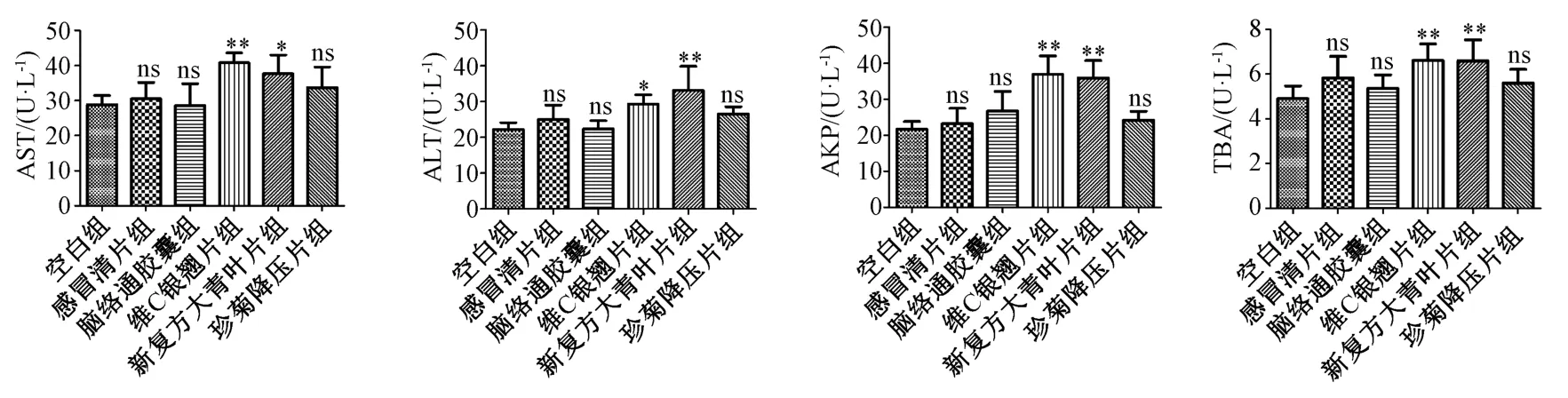
图4 给药30 d 后各组大鼠肝功能指标(n=10)
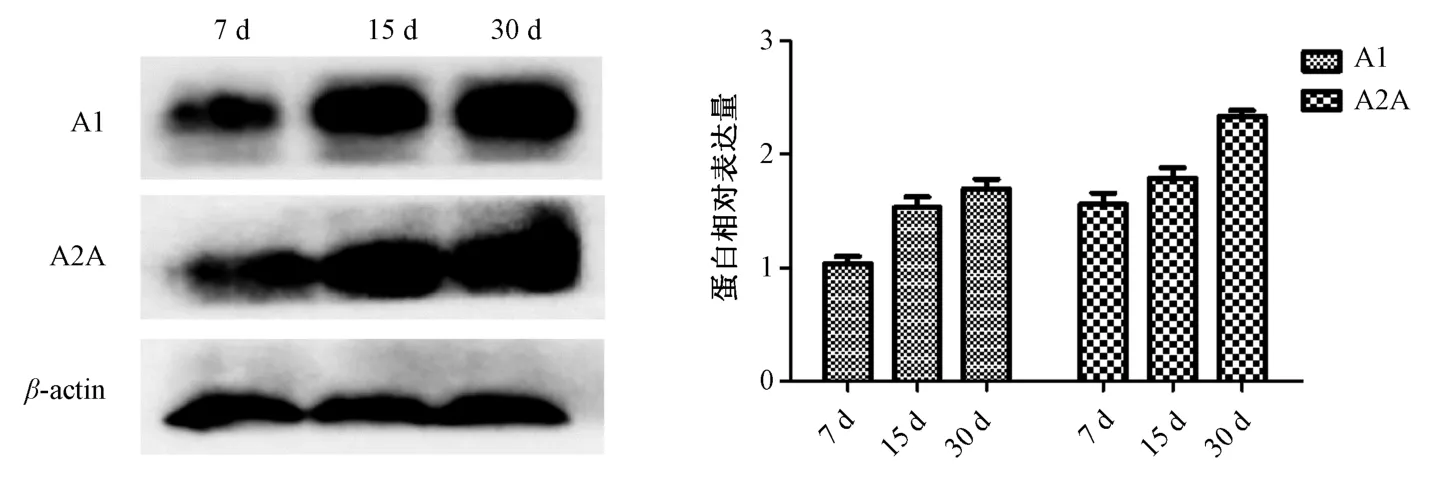
图6 不同给药时间维C 银翘片对肝组织A1R、A2AR 蛋白表达的影响(n=3)
4 讨论
药物性肝损伤(drug-induced liver injury,DILI)是最常见和最严重的药物不良反应之一,药物性肝损伤是指由各类处方或非处方的化学药物、生物制剂、传统中药(TCM)、天然药(NM)、保健品(HP)、膳食补充剂(DS)及其代谢产物乃至辅料等所诱发的肝损伤[14]。根据国家药品监督管理局2018 年4 月10 日发布的国家药品不良反应监测年度报告(2017)抗感染药严重药品不良反应/事件报告,口服制剂累及器官系统排名第1 位的是肝胆损害(26.1%)。其中也包括一些中西药复方,中西药复方制剂的组方复杂,临床使用范围较广,存在用药安全隐患[7]。本研究涉及到的中西药复方制剂给药30 d 后,给药组小鼠体质量较空白组增加明显,可能是由于其复方制剂含大量辅料所致,特别是维C 银翘片,其为糖衣片。从血清指标和病理切片判断,仅给药30 d 后维C 银翘片组和新复方大青叶片组对小鼠肝脏有明显损伤,说明给药7、15 d时对小鼠肝脏影响较小。其肝组织A1、A2A 受体的表达情况可以看出,给药时间越长A1、A2A 受体表达越多,给药30 d 后和空白组相比表达明显增高,其肝损伤可能与A1、A2A 蛋白表达增高有关。如果抑制A1、A2A 受体表达是否会改善维C 银翘片和新复方大青叶片导致的肝损伤还有待进一步研究。目前关于药物性肝损伤的发病机制的研究已经有部分成果,大多是多种机制协同作用和(或)前后作用的结果导致[15]。A1、A2A 受体表达的增多可能意味着,其上游或者下游通路在维C 银翘片和新复方大青叶片给药30 d 后导致的肝损伤中发挥着重要作用。目前,对于药物性肝损伤的治疗主要是停用可能导致肝损伤的药物,对症治疗,严重的话可能还需要肝移植[16]。从理论上讲药物对肝脏的损伤在客观上是不可避免的[17],除了在上市后严密监测药物的不良反应以外,还可以把药物警戒理念引入监测和评价过程中[18]。中西药复方由于其成分比较复杂可能会在用药的过程中导致重复用药,中西药联用更易导致不良反应[19]。对于药物性肝损伤预防是关键,要对药物副作用和不良反应有充分的了解,尽量少使用肝损伤较大的药物,避免过长期用同一种药物,不要重复用药。

图7 不同给药时间新复方大青叶片对肝组织A1R、A2AR 蛋白表达的影响(n=3)
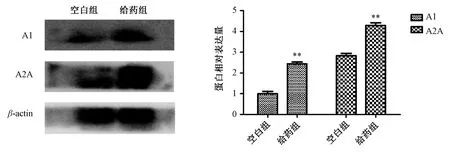
图8 给药30 d 后维C 银翘片对肝组织A1R、A2AR 蛋白表达的影响(n=3)
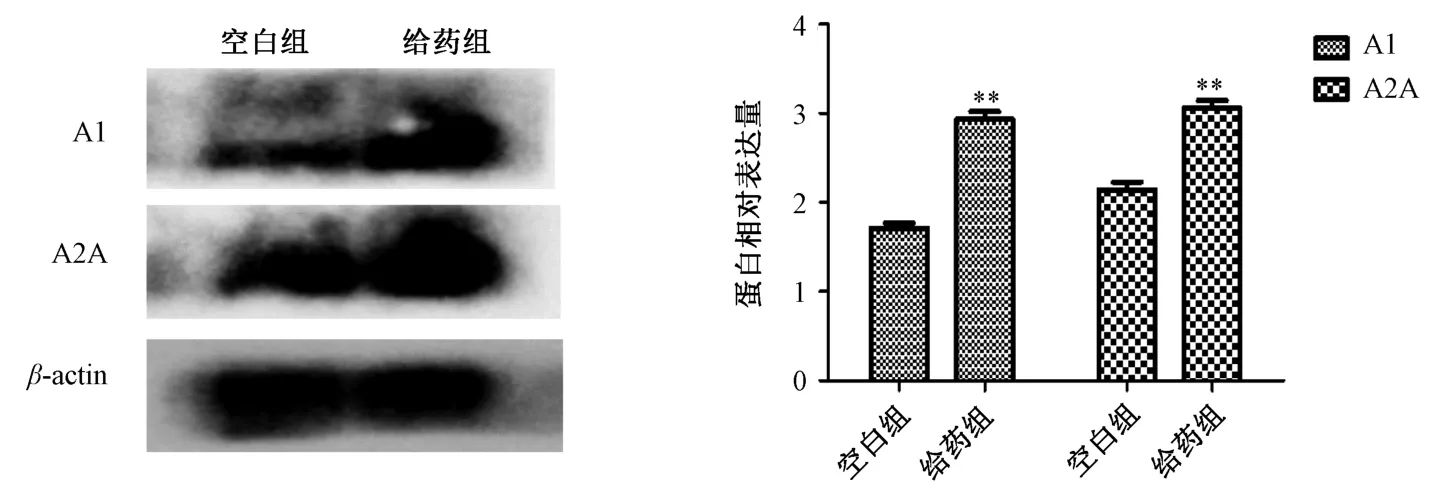
图9 给药30 d 后新复方大青叶片对肝组织A1R、A2AR 蛋白表达的影响(n=3)

图10 给药30 d 后维C 银翘片组A1R 蛋白的表达情况(×200)

图11 给药30 d 后维C 银翘片组A2AR 蛋白的表达情况(×200)

图12 给药30 d 后新复方大青叶片组A1R 蛋白的表达情况(×200)

图13 给药30 d 后新复方大青叶片组A2AR 蛋白的表达情况(×200)
