海人树茎化学成分及抗氧化活性
2020-10-14王茂媛王清隆李英英晏小霞王建荣王祝年
羊 青,王茂媛,王清隆,李英英,晏小霞,汤 欢,王建荣,王祝年
(1.中国热带农业科学院热带作物品种资源研究所,海南 海口 571101;2.农业农村部华南作物基因资源与种质创制重点开放实验室,海南 海口 571101;3.农业农村部热带农业野生植物基因资源鉴定评价中心,海南 儋州 571737)
海人树Suriana maritimaLinnaeus 为苦木科海人树属常绿灌木或小乔木[1],在我国,海人树目前仅分布于西沙群岛的少数岛屿,种群及个体数均很少,急需保护,已有学者对其保护遗传学进行了研究[2-3],但是对海人树化学成分研究的报道并不多见,其含有烷烃类、谷甾醇、木质素、芦丁、黄酮醇苷等成分[4-5],然而研究不够系统和全面,且目前国内尚无有关海人树化学成分和药理活性研究的报道。苦木科植物如鸦胆子、苦木、牛筋果、臭椿等常因具有特殊的化学成分和优异的生物活性而被报道,如鸦胆子中含有苦木素类,具有抗肿瘤、抗炎、抗寄生虫、抗病毒、抗菌、降血糖等多种药理活性[6-8];苦木中含有4,5-二甲氧基-铁屎米酮等多种生物碱,具有清热、解毒、降压、抗炎、抗氧化、抗疟疾、抗肿瘤等作用[9-11];牛筋果中含有色原酮类、苦木素类、聚酮类、三萜类等有效成分,具有抗肿瘤、抗疟、抗氧化、昆虫拒食活性等多种药理活性[12-14];臭椿中含有生物碱类、苦木苦味素类、萜类、甾醇等多种成分,在杀虫、抗病毒、抑制病原菌、除草等方面有显著作用[15-16]。因此,作为苦木科植物中的一种,海人树的化学成分及其生物活性值得深入研究。
本实验采用UPLC-Q/TOF-MS 技术对海人树茎提取物进行分析,采用电喷雾离子源(ESI),在正负离子模式下扫描采集数据,利用UNIFI 科学信息系统,结合相关文献数据,对各主要色谱峰进行归属,快速定性其主要化学成分,以期为其药效物质基础的阐明提供参考;采用DPPH 法和ABTS 法对海人树茎提取物的抗氧化活性进行研究,以期为其资源保护利用提供依据。
1 材料
1.1 仪器 Xevo G2-XS QTof 液质联用仪包括ACQUITY UPLC®I-Class 系统,Xevo G2-XS QTof 质谱仪(美国Waters 公司);ACQUITY UPLC HSS T3色谱柱(100 mm×2.1 mm 1.8 μm,美国Waters 公司);Secura513-1CN 精密天平(德国Sartorius 公司);Milli-Q 超纯水仪(德国Merck Millipore 公司);5810R 台式高速冷冻离心机(德国Eppendorf Centrifuge 公司);UV-2100 紫外-可见分光光度计(日本岛津公司);HLB 固相微萃取柱(美国Waters 公司);Pall GHPAcrodisc®Syringe 滤膜(美国Pall 公司);一次性无菌注射器带针(丰临医疗器械有限公司);Labmed 移液枪头(美国Labmed Biotech 公司);KG2 211 W 1.5 mL 离心管(美国Kirgen 公司);2 mL 透明螺口盖样品瓶(美国Waters 公司)。。
1.2 试剂与药物 甲醇、乙腈(质谱级,纯度≥99.99%,美国Fisher 公司);甲酸(质谱级,纯度98%~100%,德国Merck Millipore 公司);氢氧化钠(ACS 级,纯度≥97%,美国Sigma 公司);亮氨酸脑啡肽(美国Waters 公司);DPPH(1,1-二苯基-2-三硝基苯肼,美国Sigma 公司);ABTS(2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐,北京索莱宝科技有限公司);过硫酸钾(K2S2O8)、乙醇为分析纯,购自上海国药集团。蒸馏水(广州屈臣氏食品饮料有限公司);超纯水由Milli-Q 超纯水仪制备,其他试剂均为分析纯。
1.3 样品 供试样品于2018 年6 月采自西沙群岛,经中国热带农业科学院热带作物品种资源研究所王祝年研究员鉴定为苦木科海人树属植物海人树Suriana maritimaLinnaeus,取用海人树的茎进行分析。
2 方法
2.1 供试品溶液制备 取适量原材料自然风干,粉碎后过80 目筛,精确称取10 g 样品,用200 mL 70%乙醇回流提取1 h,提取温度70 ℃。取提取液1 mL,冷冻离心(12 000 r/min,10 min,10 ℃),静置1~2 min,取上清液300 μL 过Waters HLB 固相微萃取柱,先用600 μL 5% 甲醇洗脱,再用500 μL 90%甲醇洗脱,收集90%甲醇洗脱液,过0.2 μm 微孔滤膜,存储于2 mL 透明样品瓶,标记HRS-stem,4 ℃冰箱保存备用。所有样品现配现用,不得超过24 h 保存期。
2.2 UPLC/Q-TOF-MS 检测条件
2.2.1 色谱条件 Waters ACQUITY UPLC HSS T3色谱柱(100 mm×2.1 mm 1.8 μm);流动相0.1%甲酸水溶液(A)-0.01%甲酸乙腈溶液(B),梯度洗脱,程序见表1;体积流量0.3 mL/min;柱温40 ℃;进样量1 μL。

表1 梯度洗脱程序Tab.1 Gradient elution programs
2.2.2 质谱条件 电喷雾离子源(ESI)在正(+)、负离子(-)条件下,Continuum 模式,采集MSE数据。校正液为200 pg/μL 亮氨酸脑啡肽,0.5 mmol/mL 甲酸钠。扫描范围m/z50~1 200,扫描时间0.2 s,检测时间20 min。低能量碰撞电压(CE)6 V,高能量碰撞电压20~60 V;正离子模式的毛细管电压3.0 kV;负离子模式的毛细管电压2.0 kV;锥孔电压40 V;离子源温度100 ℃;辅助喷雾电离与去溶剂气体为高纯度N2;去溶剂化温度450 ℃;锥孔气体流量50 L/h;去溶剂化气体流量600 L/h。
2.2.3 数据处理 采用Masslynx V4.1 软件采集、管理和简单处理UPLC/Q Tof MSE数据;UNIFI 科学信息系统进行数据的浏览、存储和综合分析等。基于文献报道数据,结合 TCM Chinese[UNIFI1.7],ChemSpider 在线数据库,进行化合物成分鉴定。
2.3 抗氧化活性测试
2.3.1 海人树提取物对DPPH 自由基的清除能力 用无水乙醇将提取物配制成5 个质量浓度梯度,分别 为0.01、0.02、0.04、0.08、0.20 mg/mL。将DPPH 配制成6.5×10-5mol/L 溶液,在试管1 中加入2.95 mL DPPH 溶液及0.05 mL 无水乙醇,混匀;在试管2 中,加入2.95 mL DPPH 溶液及0.05 mL供试品溶液,混匀;在试管3 中加入2.95 mL无水乙醇及0.05 mL 供试品溶液,混匀;各试管在反应30 min 后,在517 nm 波长下测定吸光度值分别记为Ao、Ai、Aj。按上述方法配制各个梯度,每一吸光度均平行测定3 次,每一浓度梯度均测3 组,取其平均值代入下式计算相应的DPPH清除率,清除率(%)=[1-(Ai-Aj)/Ao]×100。以DPPH 清除率为纵坐标,供试样品溶液质量浓度为横坐标得到待测样品清除DPPH 自由基的关系曲线,并计算出DPPH 清除率达50% 时的样品浓度,即半数清除率(IC50)[17]。
2.3.2 海人树提取物对ABTS 自由基的清除能力 将等量的7 mmol/L ABTS 与2.45 mmol/L K2S2O8溶液混匀并于暗处反应16 h 制备得到ABTS+·。用乙醇将ABTS+·溶液稀释至波长734 nm处吸光值为(0.70+0.02)。将不同质量浓度(0.01、0.02、0.04、0.08、0.20 mg/mL)的海人树茎提取物50 μL 加入2.95 mL ABTS+·溶液中,混匀反应6 min并测其吸光值(Ax)。50 μL 乙醇与2.95 mL 的ABTS 与K2S2O8混合液反应后吸光值为A0。50 μL 不同浓度海人树茎提取物与2.95 mL 乙醇溶液混合后吸光值为Ay。每组样品重复3 次,以平均值按下列公式计算清除率,清除率(%)=[1-(Ax-Ay)/A0]×100[18]。以ABTS 清除率为纵坐标,供试品溶液质量浓度为横坐标得到待测样品清除ABTS 自由基的关系曲线,并计算出ABTS 清除率达50%时的样品浓度,即半数清除率(IC50)。
3 结果
3.1 成分分析 通过UPLC/Q-TOF-MS 对供试品化学成分的定性分析,其中(-)ESI-MS 质谱总离子流图的分离度较好,响应较高,见图1。因此,以负离子数据导入UNIFI 对海人树茎提取物进行化学成分鉴定,结果见表2,结构图见图2~3。
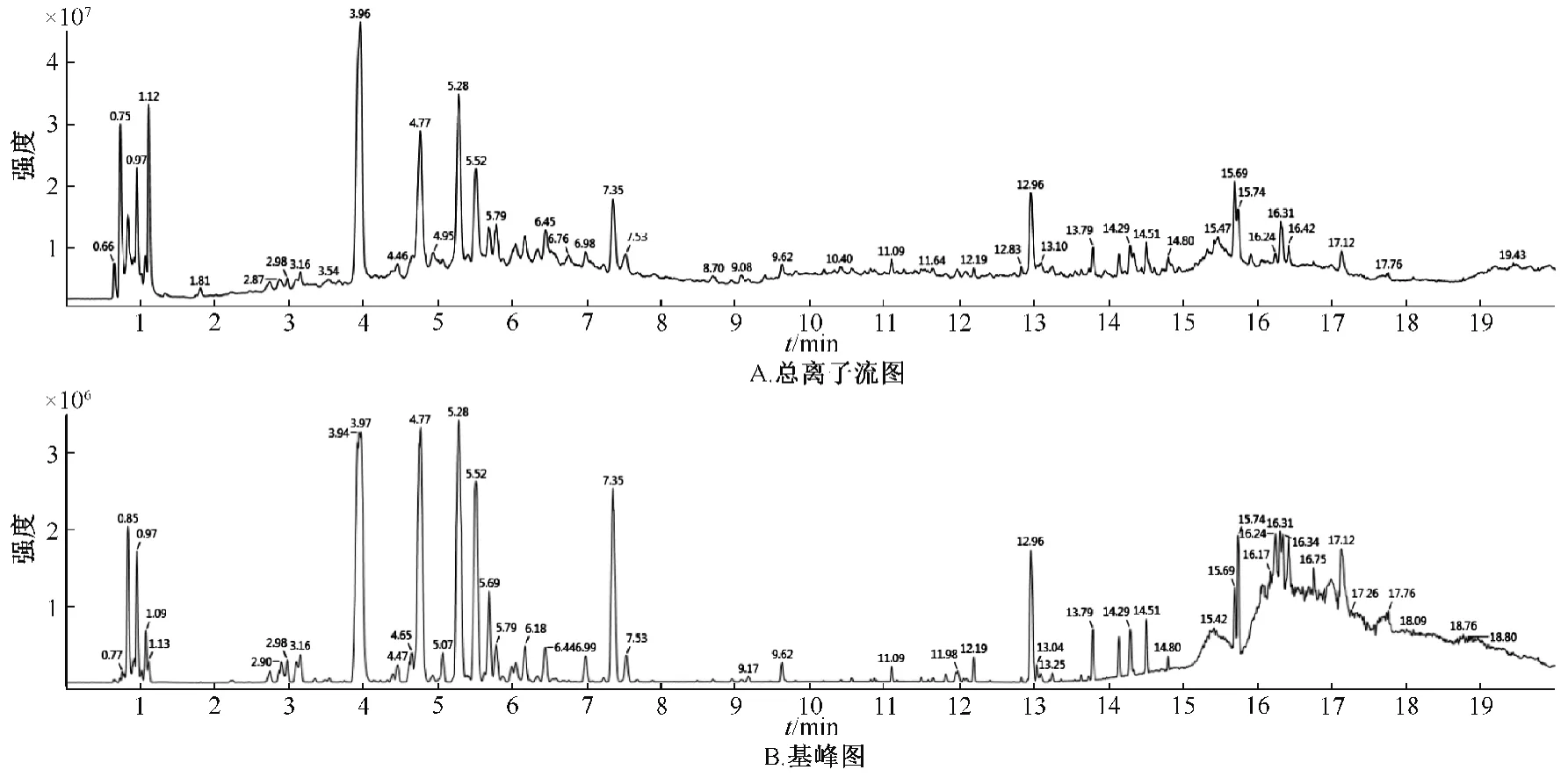
图1 海人树茎提取物负离子模式下总离子流和基峰图Fig.1 Total ion chromatogram and base peak chromatograms with negative ion mode of extraction from the stems of S.maritime
根据质谱给出的精确相对分子质量、质谱碎片,误差范围±6×10-6左右,结合文献及在线数据库匹配结果推断,鉴定了海人树茎提取物中43 种成分,包括黄酮、酚酸、花青素和三萜皂苷等。

表2 海人树茎化学成分UPLC-Q-TOF/MS 鉴定结果Tab.2 Identification of the chemical constituents from the stems of S.maritime by UPLC-Q-TOF/MS
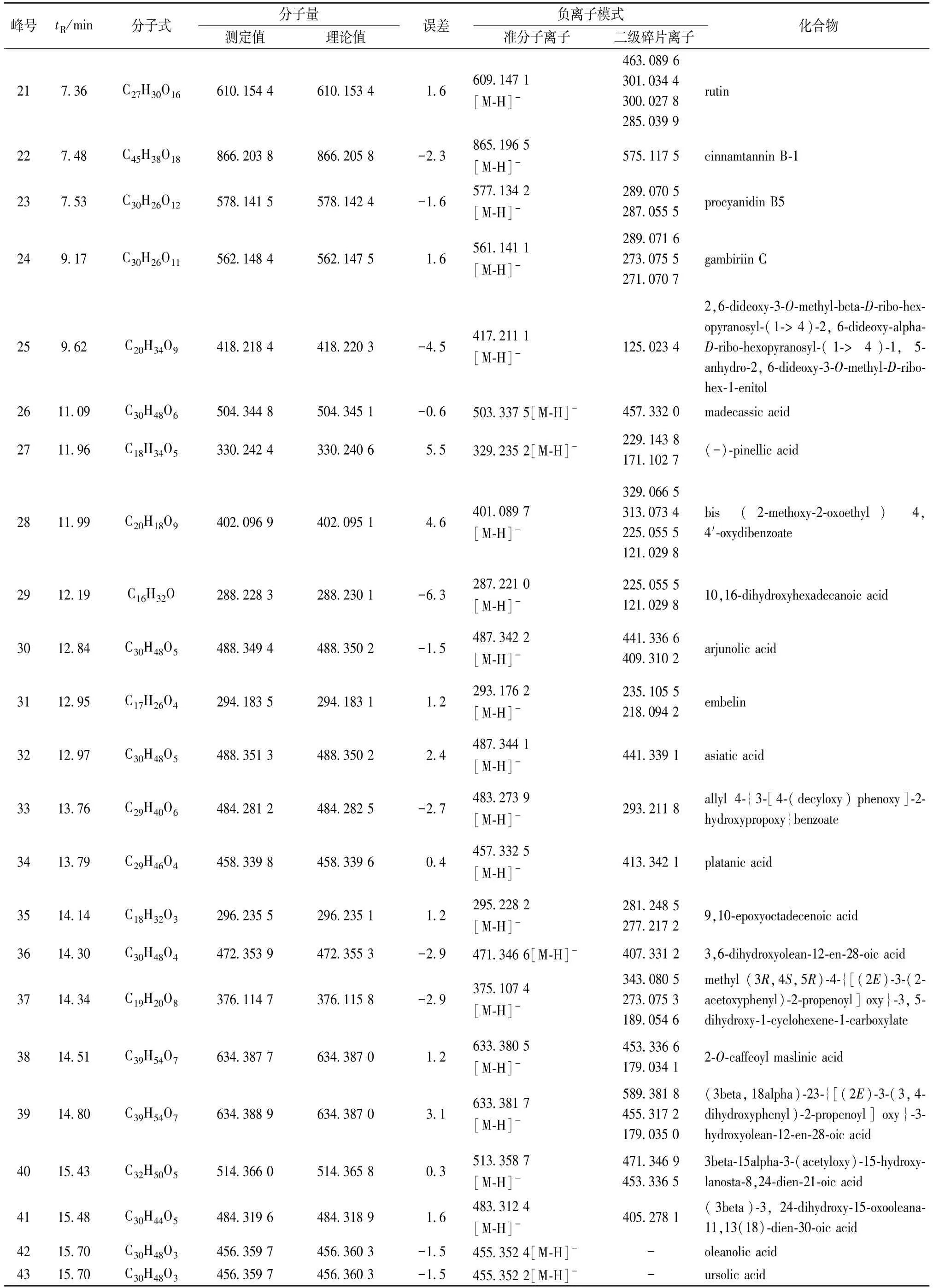
续表2
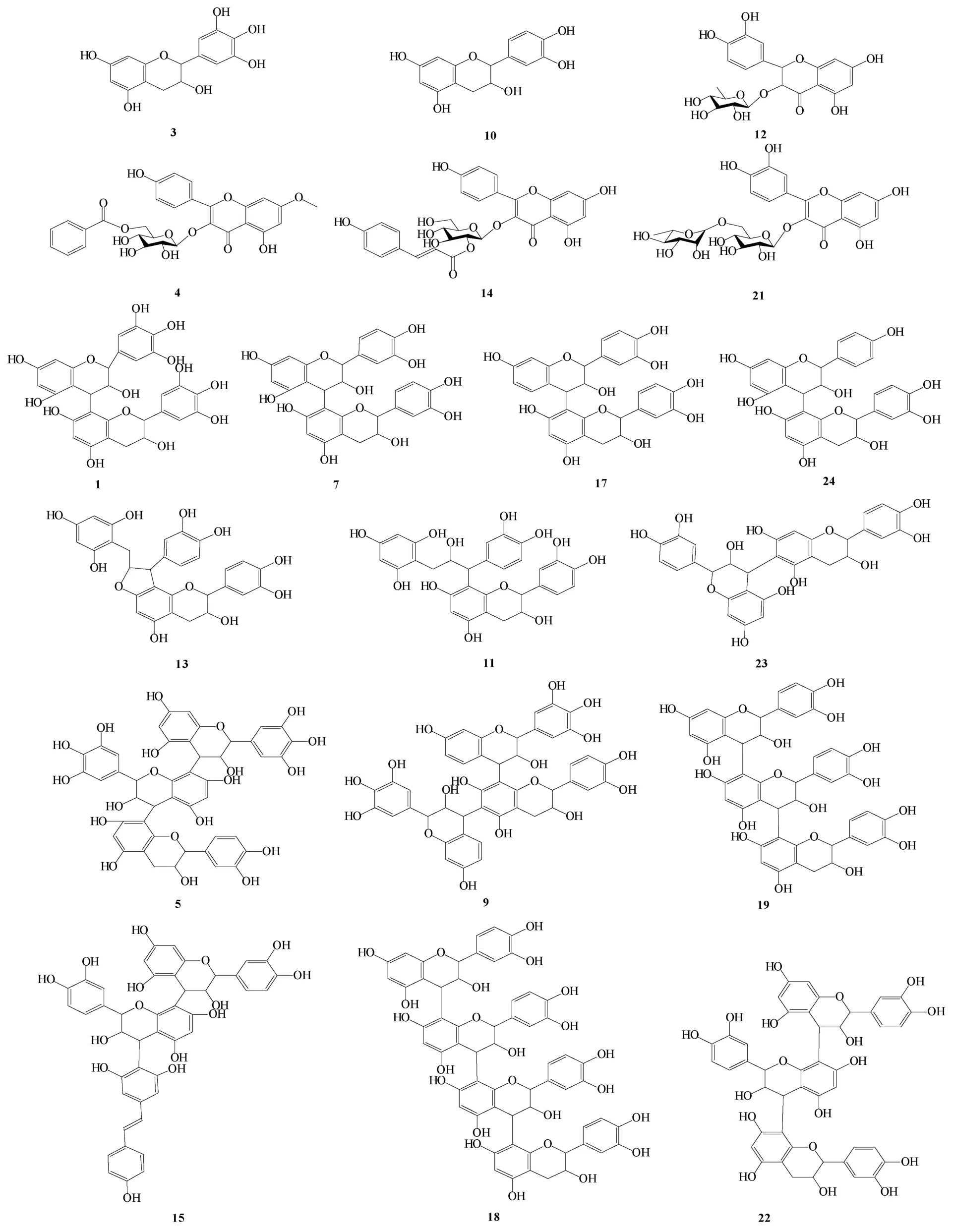
图2 海人树茎中黄酮类、酚酸类、花青素类化合物结构Fig.2 Structure of flavonoids,phenolic acids,anthocyanins,from extraction of the stems of S.maritime

图3 海人树茎提取物其他化合物结构Fig.3 Structures of other compounds from extraction of the stems of S.maritime
3.2 抗氧化活性 分别采用DPPH 法和ABTS 法测定海人树茎的抗氧化活性,以抗坏血酸为对照。从测定结果可知,海人树茎提取物对DPPH 和ABTS 自由基有明显的清除作用,且提取物浓度与清除率间呈正相关,随着提取物浓度的逐渐增大,清除率逐步增大。经线性分析可知,海人树茎提取物浓度(X)与DPPH 自由基清除率(Y)的回归方程为Y=367.23X+9.525 5(r=0.967 9),对照抗坏血酸的回归方程为Y=173.38X-1.238 5(r=0.999 8)。海人树茎和抗坏血酸对DPPH 自由基清除作用的IC50值分别为0.110 2、0.295 5 mg/mL;海人树茎提取物浓度(X)与ABTS 自由基清除率(Y)的回归方程为Y=429.65X+8.796 8(r=0.983 6),对照抗坏血酸的回归方程为Y=487.58X+4.309 2(r=0.991 3)。海人树茎和抗坏血酸对ABTS 自由基清除作用的IC50值分别为0.095 9、0.093 8 mg/mL。
4 讨论
本实验首次利用UPLC-Q-TOF-MS 技术对海人树茎提取物成分进行快速、全面地定性分析,采用电喷雾离子源(ESI),在正负离子模式下扫描采集数据,共分析鉴定得到43 个化合物,其中包括6 个黄酮类、10 个酚酸类、13 个花青素类、3 个长链脂肪酸类、11 个三萜皂苷类。研究结果表明,样品主要成分为黄酮、花青素、三萜皂苷类。各成分特征性非常强,尤其是花青素类,是原花青素的二聚体、三聚体、四聚体,也充分证实了样品属于茎类原料,因此富含鞣质类。其次,也分析鉴定出大量的三萜皂苷类成分,其皂苷苷元包括齐墩果烷型和熊果酸型,是海人树茎提取物又一类特征成分。
海人树茎提取物对DPPH 和ABTS 自由基清除能力的研究发现,提取物浓度与清除率间呈正相关,随着提取物浓度的逐渐增大,清除率逐步增大。海人树茎对DPPH 自由基的清除能力显著高于对照抗坏血酸,对ABTS 自由基的清除能力与抗坏血酸基本一样,研究结果表明海人树茎提取物具有很强的抗氧化活性,这可能与其含有丰富的黄酮类成分,尤其是花青素类成分密切相关,其他生物活性有待进一步研究。海人树茎提取物的化学成分和抗氧化活性研究,以期为其药效物质基础研究及资源利用提供参考。
