三穗鸭PRKCB基因内含子14的变异对蛋壳品质的影响
2020-10-14廖朝美游敏芳谭光辉李杰章张依裕覃媛钰刘若余
廖朝美,游敏芳,谭光辉,李杰章,张依裕,覃媛钰,刘若余
(贵州大学 动物科学学院 高原山地动物遗传育种与繁殖教育部重点实验室,贵州 贵阳 550025)
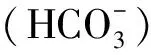
蛋白激酶C(protein kinase C,PKC)是由一系列相关的丝氨酸—苏氨酸激酶组成,能被信使Ca2+和二酰基甘油(diacylglycerol,DAG)完全激活[4]。蛋白激酶C-beta(protein kinase C-beta,PRKCB)是PKC的一种亚型,受Ca2+升高调节[5]。Zhang等[2]研究表明,PRKCB基因参与了钙离子运输和钙离子信号途径,能在一定程度上调节Ca2+的释放。PRKCB基因可能通过调控Ca2+的释放,从而直接或间接影响蛋壳的钙沉积,对蛋壳的品质产生影响。近年来,有关PRKCB基因的研究主要在人和畜禽的疾病治疗方面[6-10],在家禽蛋壳品质调控的相关研究报道极少。因此,本研究通过探究三穗鸭PRKCB基因多态性与蛋壳品质的关联性,为进一步探明该基因在三穗鸭中的生物学功能和评价其多态性的育种价值提供参考。
1 材料与方法
1.1 材料
选取贵州大学家禽研究所科研农场的同批出壳、健康无病且处于产蛋高峰期的三穗鸭120只,饲养管理、环境控制、营养水平相同,单体笼(40 cm×40 cm×45 cm)饲养。三穗鸭45周龄时,连续7 d收集120只鸭的蛋,并编号(与翅号对应),测定蛋壳品质;鸭翅静脉采血0.2 mL,-20 ℃保存,用于基因组DNA提取。
1.2 方法
1.2.1 蛋壳品质测定
蛋壳品质按照《家禽生产学》[11]方法测定,测定指标包括蛋壳厚度、蛋壳强度、蛋形指数、蛋重、蛋壳重5个指标。
1.2.2 基因组DNA提取
采用全血基因组DNA提取试剂盒(南京诺唯赞生物科技有限公司)提取三穗鸭血液样品基因组DNA,1%琼脂糖凝胶电泳和Nano Drop 2000核酸浓度检测仪检测基因组DNA,稀释成终浓度100 ng·μL-1,-20 ℃保存备用。
1.2.3 引物设计
根据鸭PRKCB基因序列(GenBank No. NC_040060.1),利用在线软件Primer Premier 3.0(http://primer3.ut.ee/)设计引物,引物信息见表1。P1引物位置在3~5内含子之间,P2引物位置在10~12内含子之间,P3引物的位置在13~15内含子之间,引物由生工生物工程(上海)股份有限公司合成。

表1 PRKCB基因扩增引物信息Table 1 Primer information for PRKCB gene amplification
1.2.4 PCR扩增与SNPs检测
PCR反应体系:RNase-Free Water 7.0 μL,2×TaqPCR Master Mix 10.0 μL,10 μmol·L-1正、反向引物各1.0 μL,基因组DNA 1.0 μL,共20 μL。PCR反应程序:94 ℃预变性8 min;94 ℃变性40 s,60 ℃退火40 s,72 ℃延伸40 s,共35个循环;72 ℃延伸8 min,4 ℃保存。PCR产物经1.2%的琼脂糖凝胶电泳检测,切胶回收纯化后送生工生物工程(上海)股份有限公司进行双向直接测序,采用DNAStar软件(ver.7.1.0)包中的Editseq和MegaAlign程序,结合Chromas软件(ver.1.6.2)筛查鉴定SNP位点,同时进行基因分型。
1.2.5 统计分析
参照文献[12]方法计算PRKCB基因功能域各位点的基因型频率、等位基因频率、有效等位基因数(number of effective alleles,Ne)、多态信息含量(polymorphism information content,PIC)、杂合度(heterozygosity,He),并进行Hardy-Weinberg平衡定律适合性检验,χ2<5.991为Hardy-Weinberg平衡,χ2>5.991为偏离Hardy-Weinberg平衡。采用SHEsis网上在线软件(http://analysis.bio-x.cn/)计算SNP位点连锁不平衡及单倍型(linkage disequilibrium,LD)。采用Excel 2019软件整理数据,利用SPSS 18.0中的一般线性模型(general linear model,GLM)分析PRKCB基因多态位点与蛋壳品质相关性,结果用平均值±标准误表示,P<0.05表示差异显著。
2 结果与分析
2.1 PCR产物鉴定
3对特异性引物扩增产物的琼脂糖凝胶电泳检测结果见图1。由图1可知,3对引物扩增所得的PCR产物条带单一且明亮,与目的片段相符合,扩增产物可用于下一步的试验研究。

M,DM 2000 DNA marker;1~6,P1引物PCR扩增产物;7~12,P2引物PCR扩增产物;13~18,P3引物PCR扩增产物。M, DM 2000 DNA Marker; 1-6, PCR products of P1 primer; 7-12, PCR products of P2 primer; 13-18, PCR products of P3 primer.图1 PRKCB基因PCR扩增结果Fig.1 PCR product of PRKCB
2.2 PRKCB基因多态位点筛查
采用DNAStar软件MegaAlign程序结合测序峰图鉴定SNPs位点,在P3引物发现3个SNP变异位点(图2),均位于第14内含子的g.1158465 C>T(S1)、g.1158519 G>A(S2)、g.1158524 G>A(S3)。3个SNP位点都产生3种基因型:S1产生CC、CT和TT,S2产生GG、AG和AA,S3产生GG、AG和AA。
2.3 PRKCB基因SNP位点遗传特性分析
对120只三穗鸭群体PRKCB基因用直接测序法对各突变位点进行遗传特性分析,结果如表2所示。S1、S2、S3的优势基因型分别为CT、GG和GG,其频率分别是0.617、0.483和0.617;优势等位基因分别为C、G和G,其频率分别是0.508、0.692和0.783;各突变位点PIC均在0.25~0.50,均属于中度多态,说明各位点遗传标记可提供一定的遗传信息。χ2<5.991为Hardy-Weinberg平衡,χ2>5.991为偏离Hardy-Weinberg平衡。卡方(χ2)适应性检验结果显示,S2、S3位点的基因型分布均符合Hardy-Weinberg平衡(P>0.05),S1位点的基因型显著(P<0.05)偏离Hardy-Weinberg平衡。

表2 三穗鸭PRKCB基因SNPs群体遗传信息Table 2 Population genetic information of PRKCB SNPs of in Sansui duck
2.4 PRKCB基因SNP位点的连锁不平衡和单倍型分析
利用在线软件SHEsis对三穗鸭PRKCB基因SNP位点进行连锁不平衡分析,结果见表3。S1、S2位点间存在强烈的连锁不平衡效应,其他突变位点两两之间的连锁不平衡系数D’和r2均小于0.75和0.33,各突变位点两两之间不存在强烈的连锁不平衡效应。
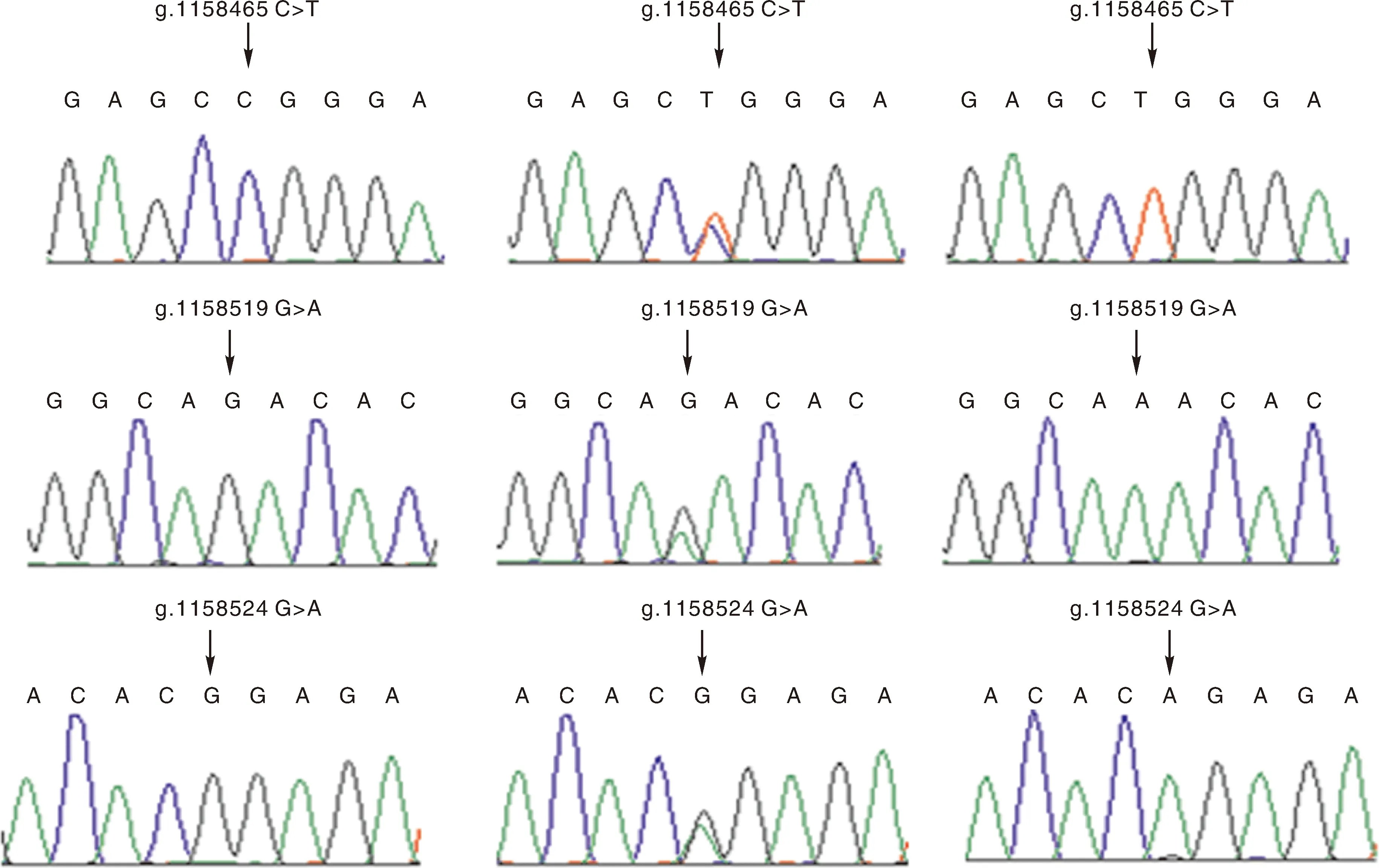
箭头表示突变位点。The arrow represented mutation site.图2 序列比对峰Fig.2 Sequence alignment peak
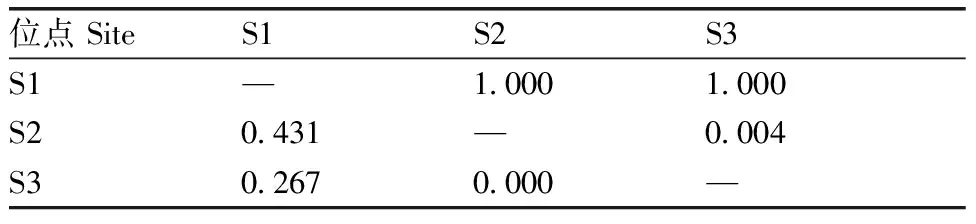
表3 3个位点连锁不平衡系数D′和r2值Table 3 Linkage disequilibrium coefficient D′ and r2 value for 3 loci
3个SNPs位点联合共产生5种单倍型(表4),优势单倍型H5(TGG)频率为0.492,劣势单倍型H4(CGG)频率为0.067。5种单倍型组合得到8种双倍型,优势双倍型H2H5(CTAGGG)频率为0.200,劣势双倍型H1H3(CCAAAG)和H1H4(CCAAGG)频率均为0.050。
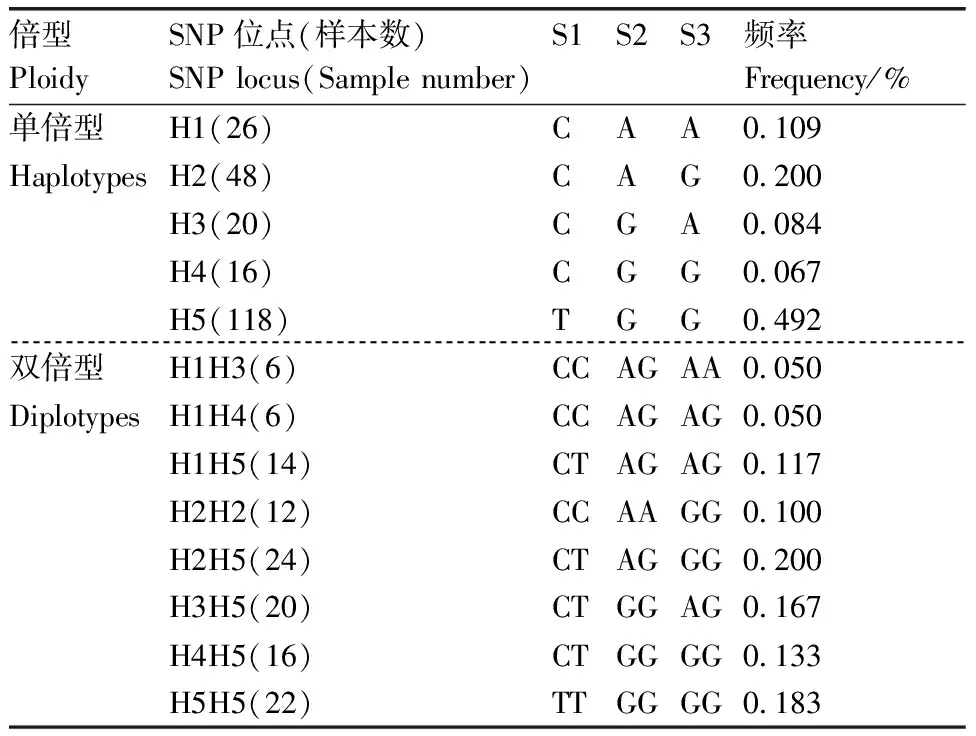
表4 PRKCB基因单倍型和双倍型分析Table 4 Analysis of haplotype and diplotype of PRKCB gene
2.5 PRKCB基因SNPs位点基因型与蛋壳品质关联分析
利用SPSS18.0软件就三穗鸭PRKCB基因3个SNP位点的不同基因型对蛋壳品质的影响做单因素方差分析,结果见表5。S2位点AG基因型的蛋壳厚度显著(P<0.05)高于GG基因型。S2位点不同基因型在蛋壳强度、蛋形指数、蛋壳质量和蛋质量上均无显著差异,S1、S3各位点的不同基因型在蛋壳强度、蛋形指数、蛋壳质量和蛋质量上均无显著差异。
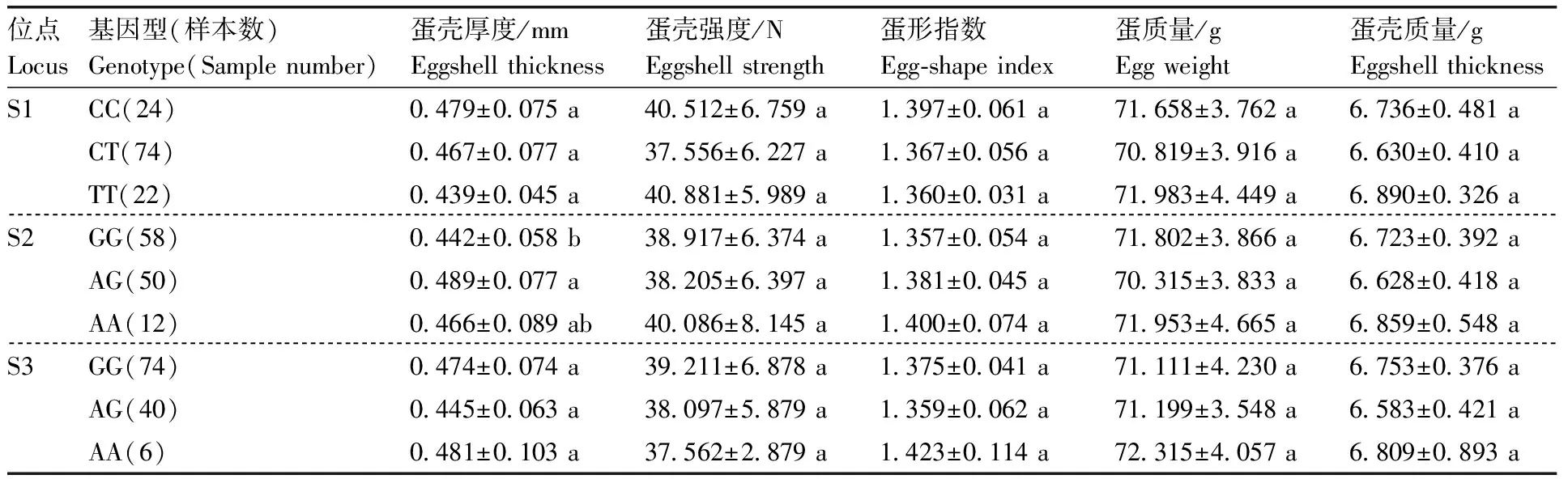
表5 三穗鸭PRKCB基因SNP位点基因型与蛋壳品质的关联性分析Table 5 Correlation analysis of PRKCB SNP loci genotype and eggshell quality in Sansui ducks
2.6 SNPs双倍型与三穗鸭蛋壳品质指标的关联性分析
对发现的8种双倍型与三穗鸭蛋壳品质指标进行关联性分析,结果见表6。双倍型H1H3(CCAGAA)个体的蛋壳厚度显著(P<0.05)高于H3H5(CTGGAG)个体的蛋壳厚度,其他双倍型之间差异不显著(P>0.05)。
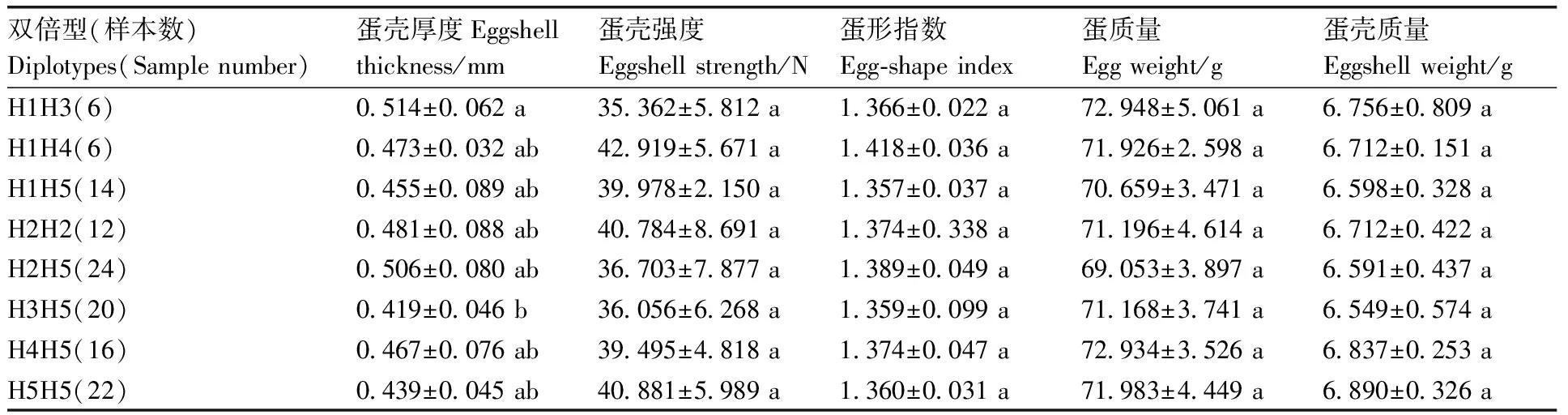
表6 PRKCB基因3个SNP位点双倍型对三穗鸭蛋壳品质关联性分析Table 6 Correlation analysis of PRKCB gene double type of 4 SNP loci on eggshell quality of Sansui duck
3 讨论
蛋壳品质受品种、营养等多种因素影响。由于常规选育手段难以获得较高的遗传进展,而从分子遗传角度发掘蛋壳品质调控基因或蛋壳品质连锁遗传标记是提高蛋壳质量的有效途径。PRKCB基因具有多种生物学功能,可增强钙信号通路[13]。Lachance等[14]研究证明,PRKCB基因单核苷酸突变(rs11074606)参与肾素—血管紧张素—醛固酮系统(RAAS)细胞内钙信号转导,与移植后肾小球滤过率显著相关。Zhang[2]等研究发现,PRKCB基因通过参与钙的转运和钙离子信号通路来调控蛋壳品质,PRKCB基因中2个非同义SNP变异与蛋壳品质显著相关。本研究中,三穗鸭PRKCB基因内含子14中发现了3个SNP位点,均属于中度多态位点。PIC作为遗传研究中标记质量的指标之一,与该标记检测群体个体多态性的能力相对应[15]。本试验中,三穗鸭群体具有持续选育提高的可能性和必要性,有较强的选择潜力,同样也揭示这3个SNP位点遗传力较稳定。卡方检验显示,g.1158465 C>T位点不属于Hardy-Weinberg平衡(P<0.05)。由于样本受到人工选择的影响,且繁殖种群为非随机交配,种群量较小,可能导致某些基因位点不属于Hardy-Weinberg平衡[16]。赵宪林等[17]研究发现,当2个位点之间的连锁不平衡系数D’>0.75且r2>0.33时,2个位点之间具有强连锁不平衡效应。本研究中,g.1158519 G>A和g.1158465 C>T位点之间存在强烈的连锁不平衡效应,趋向于整体遗传。
将内含子14中3个SNP位点产生的基因型与蛋壳品质关联分析显示,g.1158519 G>A位点中,AG基因型的蛋壳厚度显著(P<0.05)高于GG基因型。据报道,内含子虽然不编码氨基酸,其突变更不会引起氨基酸的改变,但是可能会反复改变调控剪接的外显子基序,如果这些突变位点与剪接位点相邻可能导致剪接位点失活,进而影响机体的表型[18]。因此,g.1158519 G>A突变后,可能对PRKCB蛋白的翻译过程造成一定的影响,进而对蛋壳厚度产生了影响。在分子标记选育过程中,不能只看单个的突变位点影响,多个突变位点的组合效应可能比单个的SNP位点的作用更有效,对其基因结构影响更明显[19]。3个SNPs单倍型和双倍型分析中,3个SNP位点在试验群体中具有5种单倍型和8种双倍型,与理论值存在差异。分析原因,可能是由于人工选择致使其他双倍型个体被淘汰,也有可能与本试验群体数量较少有关。8种双倍型与蛋壳品质关联性分析结果显示,H1H3(CCAGAA)个体的蛋壳厚度显著(P<0.05)高于H3H5(CTGGAG)个体的蛋壳厚度,其他双倍型之间不存在显著差异水平。因此,初步认为H1H3是有利双倍型,在选择培育过程中可作为分子标记选育的参考。但是,在实际生产中,蛋壳厚度过大并非完全有利于生产,过厚蛋壳不利于雏鸡破壳或者与外界之间的气体交换;因此,H1H3是否完全有利,还需根据实际生产所需进行选择培育。
