复方氨基酸(15)双肽(2)注射液异常毒性及降压物质方法学研究
2020-10-14肖佳音李庆忠田冰
肖佳音,李庆忠,田冰
黑龙江省药品检验研究中心,哈尔滨 150088
生化药品是指从动物器官、组织、体液、分泌物中经前处理、提取、分离、纯化等制得的安全、有效、质量可控的药品,主要包括蛋白质、多肽、氨基酸及其衍生物、多糖、核苷酸及其衍生物、脂、酶及辅酶等[1]。生化药注射剂是注射剂中较特殊的一类,按照化学药品质量控制方式很难控制其质量[2],且有关生化药不良反应的报道时有发生[3-6]。因此,完善生化药注射剂的质量标准对于保障临床用药安全具有重要意义。
1 试验材料
1.1 仪器
AL204 电子天平(METTLER TOLEDO);PL602-S电子天平(METTLER TOLEDO);RM6000 多导生理仪(日本光电工业株式会社)。
1.2 试药
复方氨基酸(15)双肽(2)注射液(生产企业:哈尔滨三联药业股份有限公司;批号:Y140528E1、Y140531E1、Y140531E2;规 格:500 mL:67 g);原研样品(生产企业:Fresenius Kabi Austria GmbH;批号16HB0093;规格:500 mL:67 g)。磷酸组胺(批号150510-200412,中国食品药品检定研究院);氯醛糖(批号:BCBK9603V,SIGMA 公司);灭菌注射用水(批号1408043,天津药业集团新郑股份有限公司);氯化钠注射液(批号140113D17,哈尔滨三联药业有限公司)。
1.3 试验动物
小鼠,80 只,昆明种,体重17~20 g,雌雄各半,购自长春亿斯实验动物技术有限责任公司,生产许可证号:SCXK(吉)2011-005;猫,4 只,体重2.7~3.5 kg,雄性。小鼠饲养环境为屏障环境,猫饲养环境为普通级环境,许可证号:SYXK(黑)2014004,温度(23±2)℃,湿度(55±10)%。
2 试验方法
2.1 异常毒性检查法限值的确定
2.1.1 设定限值前研究因本品为大输液,先以静脉注射最大剂量0.8 mL/20 g 体重给予小鼠,结果小鼠即刻死,故测定LD50。
LD50预试验:取昆明种小鼠20 只,体重17~20 g,雌雄各半,分成5 组,每组4 只,进行LD50预试验。以1∶0.7 为剂量比,按原液0.80、0.56、0.39、0.27、0.19 mL/只五个剂量分别尾静脉注射,注射速度为0.1 mL/s,观察72 h。试验结果见表1。同时比较原研样品,结果基本一致。

表1 小鼠的LD50预试验结果
LD50正式试验:在预试验的基础上,取昆明种小鼠60 只,体重17~20 g,雌雄各半,随机分成6 组,每组10 只。以1∶0.9 为剂量比,用氯化钠注射液稀释,各组剂量分别相当于原液0.40、0.36、0.32、0.29、0.26、0.24 mL/只,药物采用低比稀释法配制,给药体积为0.50 mL/只,尾静脉注射给药,给药后观察动物毒性反应及死亡情况,连续观察72 h,记录动物毒性反应状况和死亡动物分布。
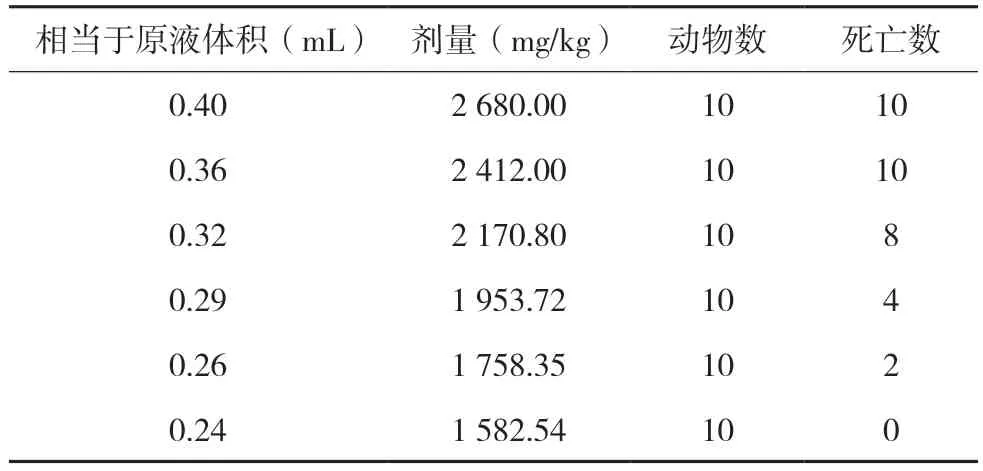
表2 小鼠的LD50正式试验结果
因为第一组和第二组死亡动物数均为10 只,故第一组不参与计算。第二至第六组实验结果用改进寇氏法计算LD50值及95%可信限,结果见表3。
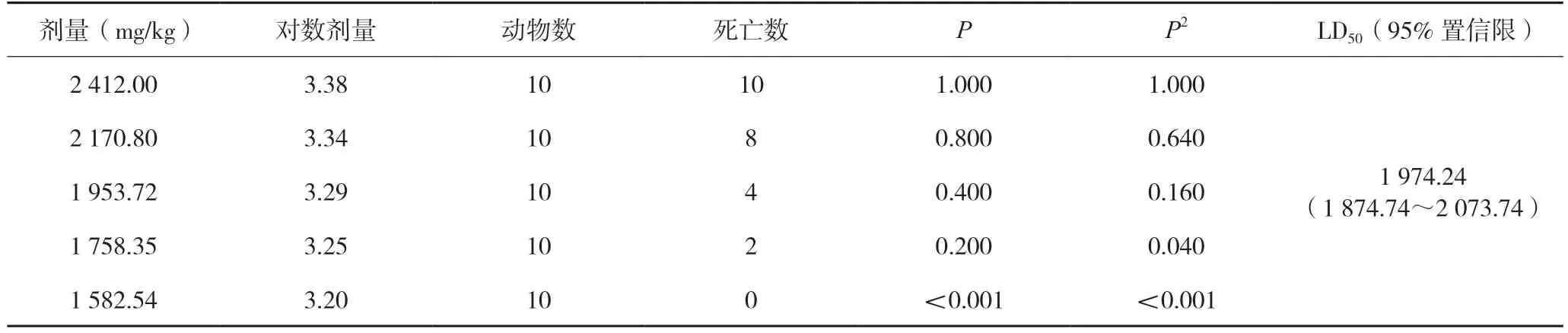
表3 小鼠的LD50测定结果
实验结果显示,复方氨基酸(15)双肽(2)注射液静脉注射LD50值为1 974.24 mg/kg,95%可信限为1 874.74~2 073.74 mg/kg。
2.1.2 限值的确定《中国药典》2015 版四部[7]通则9301 注射剂安全性检查法应用指导原则中规定,异常毒性的限值可采用小于LD50可信限下限的1/4。本品半数致死量为1 974.24 mg/kg,95%可信限为1 874.74~2 073.74 mg/kg,LD50可信限下限的1/4为468.68 mg/kg,折合小鼠体重为9.37 mg/20 g·bw,因静脉注射体积为0.50 mL,即应将本品稀释成18.74 mg/mL。综上所述,为便于计算将本品的异常毒性检查项的限值“取本品,加氯化钠注射液制备成7 倍的稀释液(1∶6 稀释),依法检查(《中国药典》2015 版四部通则1141 异常毒性检查法),静脉注射给药,应符合规定”。
2.1.3 验证以上述限值进行了3 个批次的检验,结果均符合规定。结果见表4。

表4 异常毒性检查法验证
2.2 降压物质检查法限值的确定
2.2.1 限值确定前研究选取灵敏度测试合格的猫按照《中国药典》2015 版四部通则1145 降压物质检查法进行了两次预试验,取复方氨基酸(15)双肽(2)注射液(以下简称受试样品)及原研样品以不同给药体积对猫降压作用进行了预试验,灵敏度测试及预试验结果见表5-8。

表5 灵敏度测试第一次预试验结果
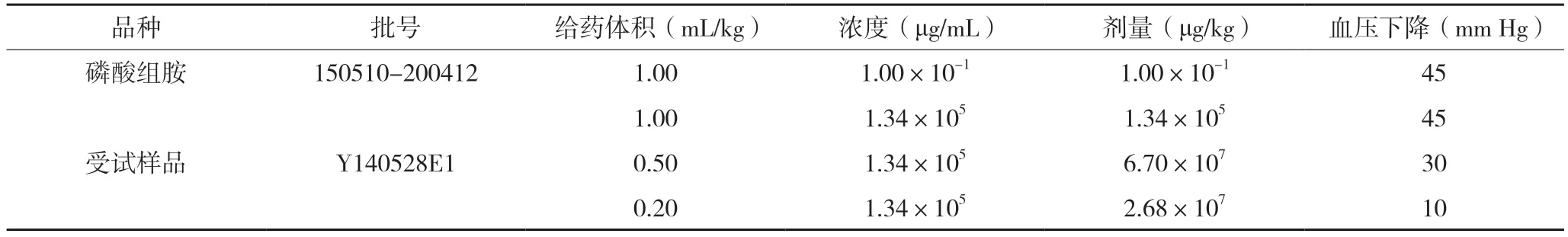
表6 降压物质检查法第一次预试验结果

表7 灵敏度测试第二次预试验结果
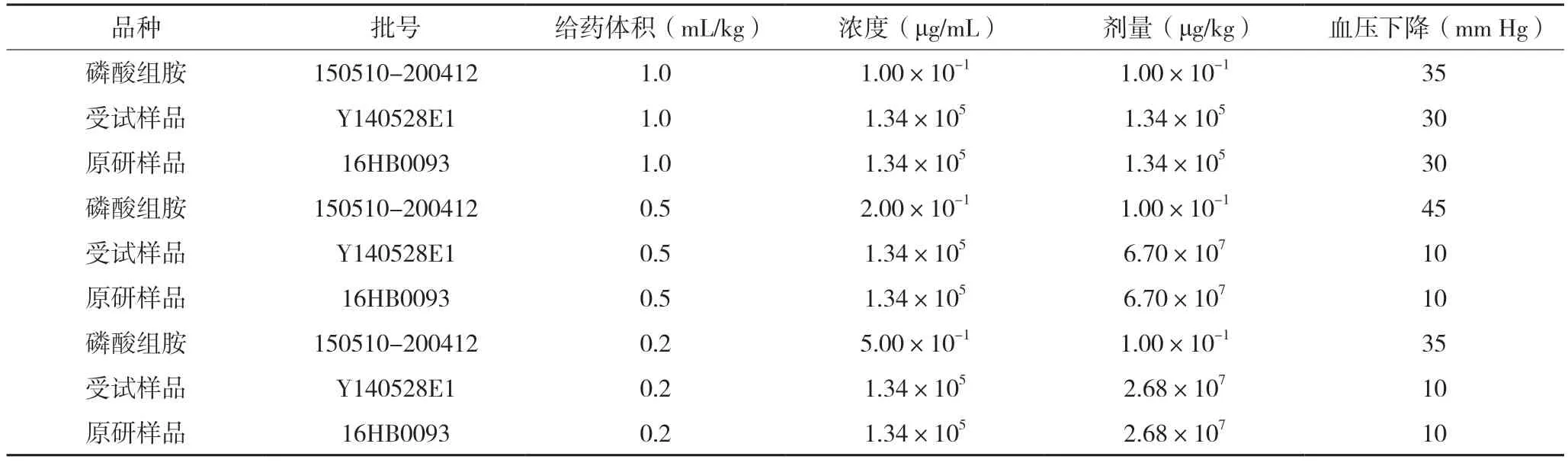
表8 降压物质检查法第二次预试验结果
2.2.2 限值的确定上述试验结果表明,该供试品本身有一定的降压作用,和原研样品基本一致,根据预试验结果,我们将猫体重每1 kg 静脉注射0.5 mL原液作为限值,同样符合指导原则[7]中“按最大无降压反应剂量的1/2~1/4 作为剂量限值”这一原则。故将降压物质检查项设定为“取本品,依法检查(《中国药典》2015 版四部通则1145 降压物质检查法),按猫体重每1 kg 静脉注射0.5 mL,应符合规定”。
2.2.3 验证以上述限值对3 个批次的样品进行了3次验证,见表9-11,结果均符合规定。
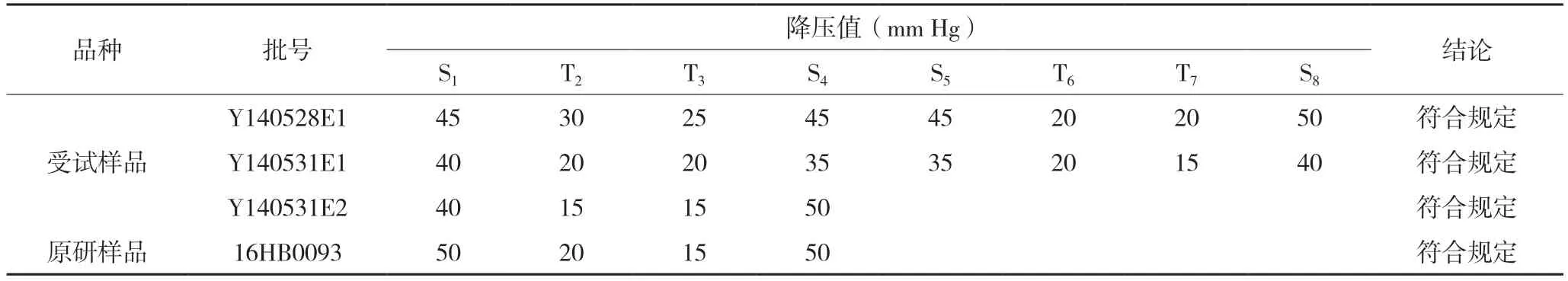
表9 降压物质检查法第一次验证试验
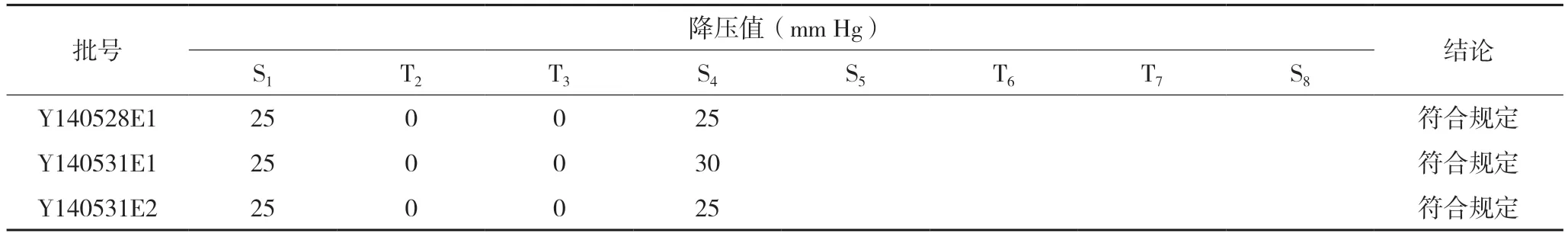
表10 降压物质检查法第二次验证试验

表11 降压物质检查法第三次验证试验
3 结论
根据以上试验结果,我们认为应在原标准安全性检查项中增加异常毒性及降压物质检查项。其中异常毒性检查项限值设定为“取本品,加氯化钠注射液制备成7 倍的稀释液(1∶6 稀释),依法检查(《中国药典》2015 版四部通则1141 异常毒性检查法),静脉注射给药,应符合规定”,降压物质检查项限值设定为“取本品,依法检查(《中国药典》2015 版四部通则1145 降压物质检查法),按猫体重每1 kg静脉注射0.5 mL,应符合规定”。
4 讨论
复方氨基酸(15)双肽(2)注射液为肠外营养制剂,适用于不能口服或经肠道补给营养,以及通过这些途径补充营养不能满足需要的患者,尤其适用于中度至重度分解代谢状况的患者。在其原标准中安全性检查项只收载了细菌内毒素检查项,不足以起到保证临床用药安全的作用。国家食品药品监督管理总局在2008 年1 月10 日发布的《关于发布化学药品注射剂和多组分生化药注射剂基本技术要求的通知》(国食药监注[2008]7 号)中提到,涉及到多组分生化药特性的安全性指标应订入标准,如过敏物质、降压物质、异常毒性等。考虑到本品种为15 种氨基酸组成的水溶液,在合成过程中存在氨基酸脱羧形成组胺或类组胺物质的可能,且用理化分析方法受到多种因素干扰[8-9],难以分析,故考虑增加降压物质检查项;同时,考虑到其在生产过程中有新生杂质或污染物的可能并引起不正常的毒性反应,故拟增加异常毒性检查项。
