低强度脉冲超声对高糖诱导人牙周膜干细胞损伤的保护作用研究
2020-10-13苏春艳童乘皓林仰东彭诚
苏春艳 童乘皓 林仰东 彭诚
1天津市职业病防治院口腔科300011;2天津市口腔医院急诊科300041;3天津市第一中心医院口腔科300192;4天津医科大学第二医院口腔科300211
0 引言
牙周炎是一种炎症性疾病,会导致牙槽骨、牙周韧带和根牙骨质等牙齿支持组织的病理改变。牙周炎与多种全身性疾病密切相关,如视网膜疾病、心血管疾病等,尤其是糖尿病。目前我国糖尿病患者人数近1.3亿,已成为威胁我国人民健康的主要疾病[1-2]。糖尿病会加重牙周炎的病情,反之亦然。在牙周炎患者中,同时伴有糖尿病的患者其发病率高、进程快、病变严重且较难治愈[3-4]。研究结果表明,糖尿病与牙周炎的多项指标存在高度相关性,这可能是由于高糖环境抑制了人牙周膜干细胞(human periodontal ligament stem cells,hPDLSCs)的增殖并促进其凋亡。hPDLSCs在受损牙周组织的重建和功能恢复进程中发挥着重要作用[5]。其被认为是牙周细胞治疗特别是骨缺损重建的最佳候选细胞。然而,研究人员发现,高糖环境可能会极大降低hPDLSCs的增殖能力、自我更新和分化能力[6]。因此,如何挽救高糖环境下hPDLSCs的增殖和成骨分化紊乱仍是一个亟需解决的医疗问题。国内外相关研究结果表明,低强度脉冲超声对高糖诱导细胞氧化应激损伤具有保护作用,且对骨髓来源细胞的增殖具有促进作用[7-9]。然而,关于低强度脉冲超声对高糖诱导hPDLSCs损伤的保护作用研究尚未见报道。本研究旨在探讨低强度脉冲超声对高糖诱导hPDLSCs损伤的保护作用及机制,为糖尿病性牙周炎的治疗提供借鉴。
1 材料与方法
1.1 主要材料与仪器
hPDLSCs(中国医学科学院上海细胞库),胎牛血清、RPMI-1640培养基、磷酸盐缓冲液(phosphate buffered saline,PBS)(美国 HyClone公司),TRIzol试剂盒(美国Invitrogen公司),总蛋白定量测定试剂盒(二喹啉甲酸法)、蛋白上样缓冲液(5×)、噻唑蓝细胞增殖检测试剂盒(南京建成生物工程研究所),小鼠抗人甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)单克隆抗体、兔抗人 Wnt1、Wnt10b、β-连环蛋白(β-catenin)多克隆抗体及辣根过氧化物酶标记的山羊抗小鼠、山羊抗兔IgG多克隆抗体[艾康生物技术(杭州)有限公司]。
F50酶标仪(瑞士Tecan公司),BD Accuri C6 Plus流式细胞仪(美国BD公司),S100梯度PCR仪(美国Bio-Rad公司),970CRT荧光分光光度计(上海精密仪器仪表有限公司)。
1.2 方法
1.2.1 hPDLSCs的复苏与培养
将冻存的hPDLSCs置于37℃的恒温水浴箱中60 s快速复苏;待细胞悬液完全融化后迅速移入离心管内,加入RPMI-1640培养基,重复小心吹打使细胞均匀分布;离心,弃上清;用RPMI-1640完全培养基重悬细胞,调整细胞浓度为1×106个/ml,于细胞培养箱中进行传代培养。
1.2.2 细胞分组与处理
取对数生长期的hPDLSCs分为5组:正常对照组、高糖模型组和低强度脉冲超声30、60、90 mW/cm2组。高糖模型组和低强度脉冲超声组细胞采用高糖培养基(葡萄糖浓度为40 mmol/L)处理48 h,建立高糖模型;正常对照组细胞采用正常培养基(葡萄糖浓度为11 mmol/L)处理。低强度脉冲超声组细胞造模后每天分别给予30、60、90 mW/cm2低频脉冲处理20 min,连续处理7 d。
1.2.3 噻唑蓝法检测细胞增殖活性
低强度脉冲超声7 d后,收集各组hPDLSCs,采用各自对应的完全培养基重悬细胞,以5×104个细胞/孔接种于96孔板中,于细胞培养箱中培养24 h;每孔加入质量浓度为5 mg/ml的噻唑蓝溶液10 μl,孵育4 h,弃上清;每孔加入100 μl二甲基亚砜,继续孵育30 min,采用酶标仪测定各孔于490 nm处的吸光度值。
1.2.4 流式细胞仪检测细胞凋亡及细胞周期分布
低强度脉冲超声7 d后,收集各组细胞悬液于离心管中,340×g离心5 min,弃上清;加入预冷的PBS 重悬细胞,每管加入 500 μl结合缓冲液、5 μl异硫氰酸荧光素标记的膜联蛋白V染液及5 μl碘化丙啶染液,室温避光染色20 min,使用流式细胞仪检测细胞凋亡。
低强度脉冲超声7 d后,收集各组hPDLSCs,加入预冷的体积分数为70%的乙醇1 ml,-20℃条件下固定过夜;4℃、340×g离心 5 min,弃上清;加入预冷的PBS 1 ml重悬细胞,4℃、340×g离心5 min,弃上清;加入500 μl碘化丙啶染液,室温避光染色20 min,使用流式细胞仪检测细胞周期分布。
1.2.5 荧光比色法检测半胱氨酸天冬氨酸蛋白酶(Caspase)-3、Caspase-6和 Caspase-9活性
低强度脉冲超声7 d后,收集各组hPDLSCs,重悬于50 ml冷裂解缓冲液中,置于冰上10 min;以400×g离心10 min,收集上清,测定上清液中的蛋白浓度;每组加入50 ml特异性的荧光报告底物,采用荧光分光光度计测定各组hPDLSCs中Caspase-3、Caspase-6和Caspase-9的活性。
1.2.6 反转录PCR检测Wnt1、Wnt10b和β-catenin的mRNA表达
低强度脉冲超声7 d后,收集各组hPDLSCs,迅速加入TRIzol试剂裂解细胞,提取细胞总RNA。按反转录试剂盒说明书合成相应的cDNA并进行扩增,Wnt1正向引物为5'-GAAACCGCCGCTGAACT-3',反向引物为 5'-CCCTGCCTCGTTATTGTGAAG-3';Wnt10b正向引物为5'-TGGAAGAATGCGGCTCTAG-3',反向引物为5'-CTCTCCAAAGTCCATGTCATGG-3';β-catenin正向引物为5'-GATTAACTATCAGGATGACGCG-3',反向引物为5'-TCCATCCCTTCCTGCTTAGTC-3';内参GAPDH正向引物为5'-ACCACAGTCCATGCCATCAC-3',反向引物为5'-TCCACCACCCTGTTGCTGTA-3'。PCR扩增条件为94℃预变性1 min,94℃变性 30 s,60℃退火 30 s,72℃延伸30 s,共40个循环。以GAPDH基因为内参,测定各组 PDLSCs中 Wnt1、Wnt10b及 β-catenin的 mRNA相对表达水平。
1.2.7 蛋白质印迹法检测Wnt1、Wnt10b以及 βcatenin的蛋白表达
低强度脉冲超声7 d后,收集各组hPDLSCs,加入细胞裂解液,提取总蛋白,并采用总蛋白定量测定试剂盒(二喹啉甲酸法)测定细胞总蛋白浓度;配制5%的浓缩胶和10%的分离胶,电泳后以90 V恒压湿转70 min将蛋白转移至聚偏二氟乙烯膜上;加入含质量浓度为50 g/L脱脂奶粉的三羟甲基氨基甲烷吐温缓冲液,室温封闭90 min;分别加入Wnt1、Wnt10b、β-catenin(均 1∶1 000)及 GAPDH(1∶2 000)一抗,4℃孵育过夜,三羟甲基氨基甲烷吐温缓冲液洗膜6次,每次5 min;加入对应的辣根过氧化物酶标记的二抗(1∶2 000),室温孵育 90 min,三羟甲基氨基甲烷吐温缓冲液洗膜6次,每次5min;采用ECL显色,曝光后扫描图像,使用Image J图像分析软件对各组条带进行灰度值分析,以GAPDH为内参,计算各组hPDLSCs中Wnt1、Wnt10b及β-catenin的蛋白相对表达水平。
1.3 统计学方法
采用SPSS19.0统计学软件处理数据,符合正态分布的计量资料采用均值±标准差(Mean±SD)表示,多组间比较采用方差分析,两两比较采用LSD法,以P<0.05为差异具有统计学意义。
2 结果
2.1 hPDLSCs增殖活性
噻唑蓝实验结果显示,低强度脉冲超声7 d后,正常对照组、高糖模型组以及低强度脉冲超声30、60、90 mW/cm2组 hPDLSCs的增殖活性(A490)分别为0.735±0.114、0.206±0.032、0.357±0.048、0.482±0.063 和0.619±0.072。与正常对照组相比,高糖模型组hPDLSCs的增殖活性明显降低(P<0.05);经不同强度(30、60、90 mW/cm2)的低强度脉冲超声处理后,hPDLSCs增殖活性较高糖模型组明显升高(均P<0.05),且90 mW/cm2组的细胞增殖活性最高(均P<0.05)。
2.2 hPDLSCs细胞凋亡及细胞周期分布
由表1可知,与正常对照组相比,高糖模型组hPDLSCs的凋亡率明显升高(P<0.05);而经不同强度(30、60、90 mW/cm2)的低强度脉冲超声处理后,hPDLSCs凋亡率较高糖模型组明显降低(均P<0.05),且90 mW/cm2组的细胞凋亡率最低(均P<0.05)。与正常对照组相比,高糖模型组和低强度脉冲超声30、60、90 mW/cm2组 hPDLSCs的 G0/G1、S 和 G2/M期细胞比例差异均无统计学意义(均P>0.05)。
2.3 hPDLSCs中 Caspase-3、Caspase-6和 Caspase-9活性
由表2可知,与正常对照组相比,高糖模型组hPDLSCs中的 Caspase-3、Caspase-6和 Caspase-9活性均明显升高(均P<0.05);经低强度脉冲超声处理后高糖模型hPDLSCs中的Caspase-3、Caspase-6和Caspase-9活性明显降低(均P<0.05),且90 mW/cm2组的Caspase-3、Caspase-6和Caspase-9活性最低(均P<0.05)。
2.4 hPDLSCs中Wnt1、Wnt10b及β-catenin的mRNA表达水平
由图1可知,与正常对照组相比,高糖模型组hPDLSCs中 Wnt1、Wnt10b及 β-catenin的 mRNA 相对表达水平均明显降低(均P<0.05);经低强度脉冲超声处理后,hPDLSCs中Wnt1、Wnt10b及β-catenin的mRNA相对表达水平较高糖模型组明显升高(均P<0.05),且超声强度为90 mW/cm2时效果最为明显(均 P<0.05)。
2.5 hPDLSCs中 Wnt1、Wnt10b及 β-catenin的蛋白表达水平
如图2所示,与正常对照组相比,高糖模型组hPDLSCs中Wnt1、Wnt10b及β-catenin的蛋白相对表达水平均明显降低(均P<0.05);而低强度脉冲超声处理可明显升高高糖模型hPDLSCs中Wnt1、Wnt10b及β-catenin的蛋白相对表达水平(均P<0.05),且超声强度为90 mW/cm2时效果最为明显(均 P<0.05)。
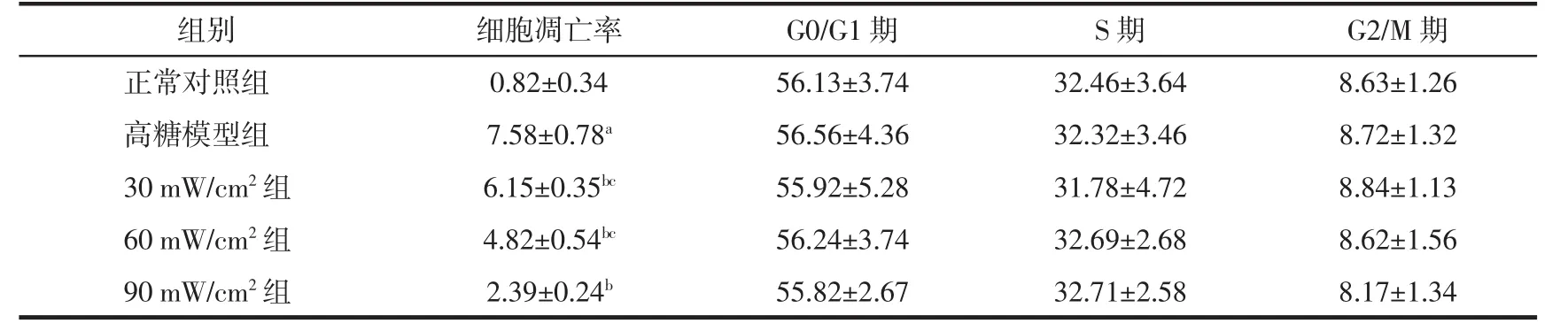
表1 流式细胞术检测各组hPDLSCs的细胞凋亡及细胞周期分布情况(%,Mean±SD,n=3)

表2 荧光比色法检测各组hPDLSCs中的Caspase-3、Caspase-6和Caspase-9活性(%,Mean±SD,n=3)

图1 反转录PCR检测各组人牙周膜干细胞中Wnt1、Wnt10b及β-catenin的mRNA表达
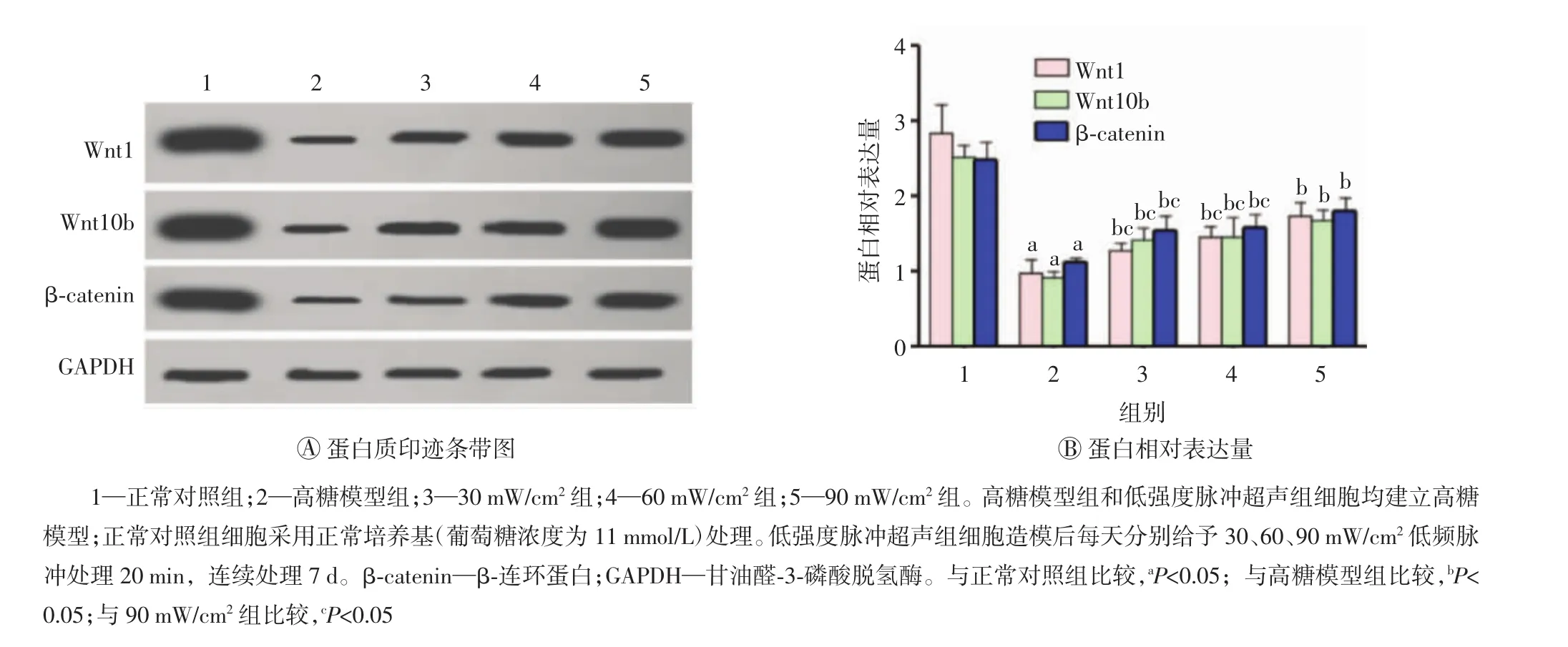
图2 蛋白质印迹法检测各组人牙周膜干细胞中Wnt1、Wnt10b及β-catenin的蛋白表达
3 讨论与结论
低强度脉冲超声可抑制炎症反应,缓解糖尿病引起的病理反应[10-12]。但目前尚缺乏关于低强度脉冲超声对高糖诱导hPDLSCs损伤的作用研究,本研究对此进行了探讨并对其机制进行了分析,以期为糖尿病性牙周炎的治疗提供借鉴。本研究中与正常对照组相比,高糖模型组hPDLSCs的增殖活性降低、细胞凋亡率升高,表明高糖诱导的细胞损伤模型建模成功;而经低强度脉冲超声处理后,高糖诱导的hPDLSCs增殖活性升高、细胞凋亡率降低,表明低强度脉冲超声处理可明显缓解高糖诱导的细胞损伤。同时,流式细胞检测结果显示,高糖诱导刺激对hPDLSCs的细胞周期分布无明显影响。
在调控细胞代谢中,Bax蛋白可激活线粒体通透性转化孔的开放,导致线粒体结构和功能紊乱,而Caspase可激活蛋白外流,导致细胞凋亡[13-14]。本研究中经高糖诱导后hPDLSCs中的Caspase-3、Caspase-6和Caspase-9活性明显升高;再经低强度脉冲超声干预后,细胞中的Caspase-3、Caspase-6和Caspase-9活性明显降低,表明低强度脉冲超声处理可减少细胞凋亡。Wnt信号通路主要由3条分支通路构成,即Wnt/平面细胞极性(PCP)信号通路、Wnt/Ca2+信号通路和经典的Wnt/β-catenin信号通路。其中经典的Wnt/β-catenin信号通路是近年来细胞生物学研究的一大热点,其在调控细胞增殖分化、功能活化及细胞凋亡等方面发挥着重要作用。本研究结果显示,高糖刺激可明显降低Wnt1、Wnt10b及β-catenin的mRNA和蛋白表达水平,由此推断高糖可能通过降低Wnt1、Wnt10b及β-catenin的表达水平抑制细胞的增殖活性;而低强度脉冲超声可提高细胞增殖活性,其可能是通过调控Wnt/β-catenin信号通路实现的,且超声强度为90 mW/cm2时对细胞生物学特性的影响最为明显。
高糖条件可促进hPDLSCs凋亡并可抑制细胞的增殖活性,对细胞周期分布无明显影响;而低强度脉冲超声可明显改善高糖诱导的hPDLSCs损伤,且超声强度为90 mW/cm2时效果最为理想,其可能是通过降低 Caspase-3、Caspase-6、Caspase-9活性和上调Wnt1、Wnt10b及β-catenin的表达来实现的,这为低强度脉冲超声用于临床治疗糖尿病性牙周炎提供了借鉴和依据。
利益冲突 所有作者均声明不存在利益冲突
