地衣芽孢杆菌的分离和鉴定
2020-10-12布帕提买木·麦麦提潘姣姣阿迪莱·卡哈曼伍麦尔·麦海提陈荟旭张秋林李莲瑞
布帕提买木·麦麦提 潘姣姣 阿迪莱·卡哈曼 伍麦尔·麦海提陈荟旭 张秋林 李莲瑞

摘 要:为了從土壤中分离得到地衣芽孢杆菌,开展后续研究,试验采集塔里木盆地的土壤进行细菌培养,采用台盼蓝平板方法,对分离培养得到的单菌落进行生物学特性研究、生理生化试验和16S rDNA鉴定。根据《伯杰细菌鉴定手册》,初步鉴定为芽孢杆菌,提取DNA进行PCR扩增并送测序。结果表明,从塔里木盆地土壤中分离得到的细菌为地衣芽孢杆菌,说明该土壤中存在地衣芽孢杆菌,并为后续进一步研究及应用奠定基础。
关键词:土壤;分离和鉴定;16S rDNA;地衣芽孢杆菌
中图分类号:S-3
文献标识码:A
DOI:10.19754/j.nyyjs.20200915005
收稿日期:2020-08-17
基金项目:大学生创新项目(项目编号:201810757029)
作者简介:布帕提买木·麦麦提(1996-),女,硕士在读。研究方向:动物性食品卫生与安全;通信作者李莲瑞(1968-),女,博士,教授。研究方向:动物性食品卫生与安全。
地衣芽孢杆菌(Bacillus licheniformis)为革兰氏阳性菌,广泛分布于微生物混合培养物中[1]。呈杆状,芽孢为椭圆形,孢囊稍膨大,为非致病性菌,细菌最适生长温度约为50℃,酶的最适生长温度为37℃。地衣芽胞杆菌耐热、含酶量多、产酶量高的优良特性被广泛应用于工业生产中,主要用来生产淀粉酶[2]及蛋白酶[3]。芽孢杆菌具有耐酸、耐盐、耐高温等特点,这使得其可以在条件不利的情况下形成芽孢,自我保护,并在环境适宜的条件下复活。地衣芽孢杆菌在代谢过程中能产生多种酶和活性物质,具有益生保健[4],降解农药[5]和净化水体[6]的作用。为了解塔里木盆地土壤中是否存在地衣芽孢杆菌,本试验从塔里木盆地的1份土壤中筛选出1株镜检有芽孢的单菌落,对该菌株进行分离纯化,经过生理生化实验鉴定、16S rDNA基因测序,最终鉴定为地衣芽孢杆菌,且为后续开展地衣芽孢杆菌的应用研究奠定基础。
1 材料
1.1 样品采集
新疆塔里木大学校园肥沃菜地距地表20~80cm土样。
1.2 主要试验仪器
恒温培养箱(型号为GHP-9080),购自上海一恒科学仪器有限公司;小型台式高速离心机(型号为Eppendorf 5453),购自北京创世云博科技发展有限公司;洁净工作台(型号为SW-CJ-2ED),购自上海五久自动化设备有限公司;显微镜(型号为尼康 ECLIPSE Ci-L),购自成贯仪器(上海)有限公司;摇床(型号为ZWY-2102C),购自济南宇晗医疗器械有限公司;加热制冷循环器(型号为JULABO Labortechnik GmbH F12),购自优莱博技术(北京)有限公司。
1.3 试验药品
盐酸、磷酸二氢钾、氢氧化钠、明胶、氯化钠、七水硫酸镁、淀粉、硫酸铵、卢哥氏碘液、硝酸钾、格里斯亚硝酸盐试剂、0.04%酚红、Ehrlish试剂、二甲苯、DL-苯丙氨酸、10%氯化铁、磷酸二氢铵、柠檬酸钠、磷酸二氢钠、0.1%酪氨酸、台盼蓝、琼脂粉、酵母粉、酵母膏、磷酸氢二钠、磷酸氢二钾、浓盐酸、可溶性淀粉,均为国产;牛肉浸粉、牛肉膏、蛋白胨,均购自Sigma公司。
2 方法
2.1 细菌的分离处理
2.1.1 制样品稀释液
取样品土壤500g置于80℃烘箱中烘烤24h,过筛,称取150g土壤放入烧杯中,加水至350mL,煮沸15min,过滤,取滤液,制成1∶10浓度的悬液。另取装有无菌水的试管6支,编号10-1、10-2、10-3、10-4,10-5、10-6进行梯度稀释,移取500μL 10-1管中土壤悬液于10-2管中混匀,然后移取500 μL 10-2管中土壤悬液于10-3管中混匀,直至稀释到10-6管,另取500μL 10-6管中液体弃去。
2.1.2 培养
从10-4、10-5、10-6管的稀释液中取150μL滴加到台盼蓝选择培养基平板上,用涂布棒均匀涂布,并将培养基倒置培养于37℃恒温箱中,培养24h。
2.1.3 分离单菌落
挑取有透明圈的单菌落,接种于灭菌的LB液体培养基中,置于37℃,180rpm摇床中培养6h。
2.1.4 纯化
采用平板涂布法,用微量移液器分别移取20μL、50μL、100μL、150μL、200μL均匀涂布于LB固体培养基上,37℃恒温培养24h,并重复此步骤多次达到纯化。
2.2 生物学特性研究
2.2.1 菌落培养特征
在台盼蓝选择培养基上进行培养,观察并记录。
2.2.2 菌体形态观察
挑取培养的单菌落,进行革兰染色与孔雀石绿染色,镜检,观察形态。
2.2.3 革兰染色[7]
用接种环挑取LB平板上生长的单菌落,在滴有蒸馏水的载玻片上均匀涂开,将涂好的玻片用酒精灯火焰固定,在涂片处用结晶紫染色液处理1min,用水冲洗干净;碘液处理1min,用水冲洗干净;95%的乙醇脱色处理30s,用水冲洗干净;沙黄复染15s,用水冲净,烘干,油镜下观察。
2.2.4 孔雀石绿染色[8]
切片用饱和的孔雀石绿水溶液染10min,蒸馏水冲洗;0.5%番红复染30s;水洗,吸干;镜检,芽孢呈绿色,菌体和芽孢囊呈微红色。
2.2.5 血平板试验
采用新疆多浪绵羊血制作血平板,将菌株接种于血平板上,观察溶血现象。
2.3 細菌的生化鉴定
地衣芽孢杆菌鉴定参考《常见细菌系统鉴定手册》[9]及《伯杰细菌鉴定手册》[10]的方法,对分离的细菌进行鉴定。
2.3.1 柠檬酸盐利用试验
无菌条件下,将单菌落接种于柠檬酸盐培养基中,37℃恒温培养3~7d,观察颜色变化。
2.3.2 丙酸盐利用试验
将菌种划线接种于丙酸盐培养基上,37℃恒温培养,连续3代移种,观察颜色变化。
2.3.3 淀粉水解试验
用接种环取菌种涂布在培养基表面,37℃恒温培养24~48h,取出后滴加碘液,观察菌落周围变化。
2.3.4 卵黄卵磷脂酶试验
接种环取少量幼龄菌种(培养18~24h)涂布于卵黄卵磷脂酶平板上,37℃恒温培养24~48h,观察菌落四周是否出现不透明区。
2.3.5 硝酸盐还原试验
取纯培养物接种于硝酸盐培养基中,37℃培养18~24h,加入试剂3~5滴,30s内出现红色为阳性。
2.3.6 吲哚试验
将菌种接种于蛋白胨水培养基中,37℃恒温培养24h后,取出加入2mL二甲苯,摇匀静置,沿试管壁缓慢加入Ehrlish试剂2mL,静置,观察颜色变化。
2.4 地衣芽孢杆菌16S rDNA的鉴定
2.4.1 基因组DNA的提取
细菌DNA提取方法按照北京全式金生物技术有限公司DNA提取试剂盒(M10208)说明书进行操作。
2.4.2 16S rDNA基因扩增
选择通用引物扩增芽孢杆菌16S rDNA的全长序列。细菌通用引物序列为27F:5′-AGAGTTTGATCCTGGCTCAG-3′和1492R:5′-CGGTTACCTTGTTACGACTT-3′,进行PCR扩增。PCR扩增体系:DNA模板1μL;上游引物和下游引物各1μL;EasyTaq Super Mix 25μL,加入ddH2O补至50μL。PCR扩增程序:94℃预变性5min;94℃变性30s,55℃退火30s;72℃延伸90s;35个循环;72℃再延伸10min。PCR产物经1%琼脂糖凝胶电泳。
2.4.3 纯化和测序
PCR产物经纯化后与pMD19-T载体连接,送由北京天一辉远有限公司测序,将测定的序列通过NCBI/BLAST工具进行序列比对,确定其具体的菌属。
3 结果与分析
3.1 细菌的培养
对菌液用无菌水分别进行6个梯度稀释,置于台盼蓝筛选平板上。结果表明,随着稀释倍数的增大平板上生长的菌落数减少,逐渐出现单菌落。
3.2 细菌形态
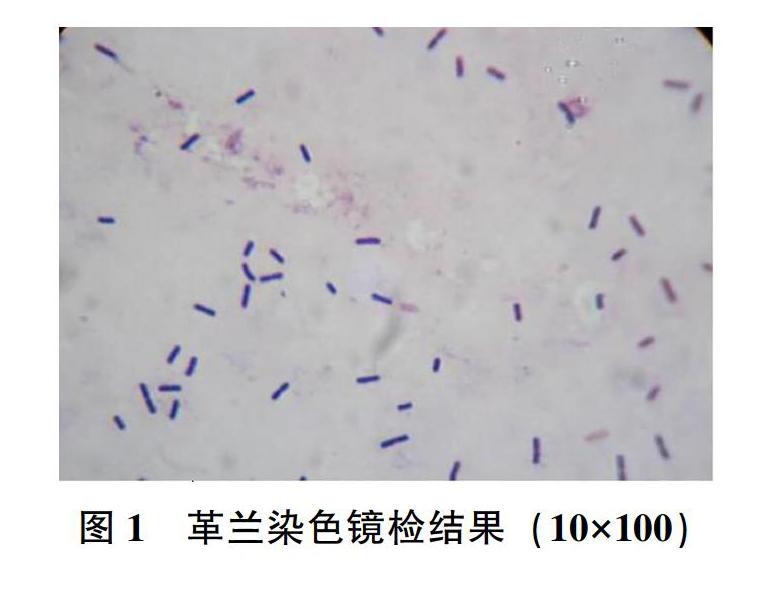
挑取白色透明圈的单菌落,进行革兰染色,镜检结果见图1,待检菌革兰染色呈阳性,菌体呈直杆状,两端钝圆。孔雀石绿染色镜检结果见图2。
3.3 菌落形态及血平板毒力测试
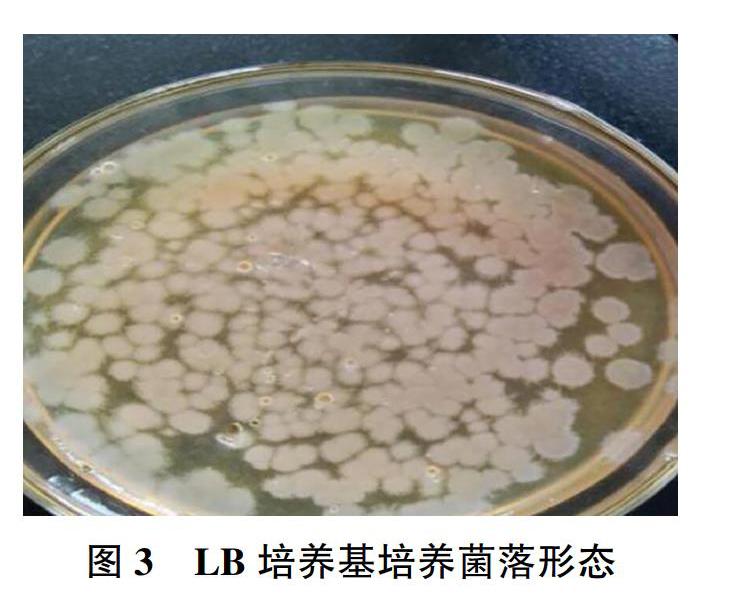
将该菌接种于LB固体培养基上,观察菌落呈圆形、扁平、表面粗糙,边缘不整齐,灰白不透明,培养24h后菌落趋于相互融合,菌苔表面出现山丘状和裂叶状(见图3);将该菌划线接种于血平板上,培养24h后,未出现溶血环,观察落菌形态边缘光滑,不规则,表面湿润,无透明或不透明的灰白色小菌落(见图4)。
3.4 生理生化实验鉴定结果
3.4.1 丙酸盐利用、柠檬酸盐利用实验结果
在丙酸盐利用试验中,将菌种划线接种于丙酸盐培养基上,培养基变蓝,实验结果为阳性;在柠檬酸盐的利用试验中,适温培养4d后,培养基对光旋转呈蓝色,实验结果为阳性。
3.4.2 淀粉、卵黄卵磷脂、硝酸盐还原试验结果
将该菌接种于淀粉培养基培养24h后,滴加碘液,菌落周围出现不变色透明圈,淀粉水解呈阳性;将该菌接种到卵黄卵磷脂培养基培养24h后,观察菌落四周有浑浊环出现,表示卵磷脂分解成脂肪,说明分离纯化的菌株中含有卵磷脂酶;将该菌接种到硝酸盐还原为亚硝酸盐培养基24h后,滴加试剂,30s内出现红色,表明该菌能将硝酸盐还原;将该菌接种到吲哚培养基中恒温培养24h后,取出加入二甲苯和Ehrlish试剂,培养基不变色,实验结果为阴性。
3.4.3 生化试验鉴定结果
淀粉水解试验、丙酸盐利用试验、卵黄卵磷脂酶试验、硝酸盐还原试验、吲哚试验、柠檬酸盐利用试验等生物化学试验鉴定结果见表1。
3.5 16S rDNA的鉴定结果
3.5.1 16S rDNA的扩增结果
由图5可以看出,成功扩增了该菌的16S rDNA的基因序列。
3.5.2 16S rDNA克隆鉴定结果
该细菌16S rDNA的基因序列与pMD19-T连接后转化DH5α,提取质粒送测序,阳性克隆鉴定如图6。
3.5.3 16S rDNA的序列进化树同源性分析结果
将测序所得序列去掉相关的载体序列后,得到该菌的全长16S rDNA序列信息。该菌株的16S rDNA长度为1500bp,将其结果提交到NCBI数据库进行核酸比对后,建立进化树。分析表明,该菌株与登录号为KU986668、CP025226、MK063874、MN493780、MG97702的地衣芽孢杆菌处于同一分支,且根据同源性分析,该菌株与登录号为KU986668、CP025226、MK063874、MN493780、MG97702的地衣芽孢杆菌同源性为100%,进化树分析结果见图7,同源性比较见表2。根据上述结果,可以确定该菌株为地衣芽孢杆菌。
4 结论与讨论
面对土壤中庞大的微生物群体,通过对一份土壤进行高温烘烤处理,培养获得单菌落,取该菌落在台盼蓝平板上培养,反复纯化,最终挑选长出白色透明圈的菌落作为实验出发用菌,进行革兰染色和孔雀石绿染色镜检后,观察细菌形态呈杆状,两端钝圆,芽孢中生,孢囊稍膨大,确定分离得到1株芽孢杆菌。通过参考《常见细菌系统鉴定手册》及《伯杰细菌鉴定手册》,又结合地衣芽孢杆菌所特有的能够利用丙酸盐的特性,初步鉴定为地衣芽孢杆菌。
同时,对该菌进行柠檬酸盐利用试验、淀粉水解试验、明胶液化试验、硝酸盐还原试验等一系列的生化鉴定试验。试验结果表明,该菌具备地衣芽孢杆菌的不可形成吲哚、不可水解酪氨酸、不具有苯丙氨酸脱氢酶的生化特征,由此可以初步断定该菌为地衣芽孢杆菌。最终通过对该菌进行DNA提取、PCR扩增、纯化及测序,将其16S rDNA基因序列信息进行建立进化树及同源性分析,进一步确定该菌为地衣芽孢杆菌。
地衣芽孢杆菌在较高温度下仍能生长繁殖,并且能够产生淀粉酶和蛋白酶,对有些有害菌如葡萄球菌、白色念珠菌具有明显的抑制作用。然而,近年来对地衣芽孢杆菌的研究进展仍报道得比较少,虽已证实其拥有良好的使用效果,但具体作用机理机制尚不明确,且其研究主要集中在抗菌特性方面,未来可利用基因工程将该菌的优良特性与其它菌结合,构建和表达出一种更优良的基因,并将其应用到更加廣泛的领域中。试验结果进一步丰富了我国地衣芽孢杆菌的研究进展,为地衣芽孢杆菌的进一步研究及应用奠定基础。
参考文献
[1] 覃建忠,邓正春,周诗彪,等.大豆施用含地衣芽孢杆菌生物活化酶磷肥试验[J].作物研究,2017,31(07):722-723.
[2]莫静燕,陈献忠,王正祥.地衣芽孢杆菌原生质体的制备、再生及转化研究[J].生物技术,2009(05):75-77.
[3]王利杰,余晓斌,方银兵,等.可抑制致病菌的益生菌筛选及抑菌物质的初步确定[J].生物技术通报,2017,33(11):123-129.
[4] Kim Y,Cho J Y,Ku K J H,et al. Identification and antimicrobial activity of phenylacetic acid produced by Bacillus Licheniformis isolated from fermented Soybean, Chnngkook-Jang[J]. Current Microbiology, 2004, 48 (4): 312-317.
[5] Mandal M D,Mandal S,Pal N K.Plasmid-mediated dimethoate degradation by Bacillus Licheniformis isolated from a fresh water fish Labeo rohita[J]. BioMed Research International, 2005, 25 (3): 280-286.
[6]李木明.降解有机质芽孢杆菌的筛选及其净化模拟污染水体的特性[D].泉州:华侨大学,2016.
[7] 黄荔丰.微课“革兰染色”的教学设计[J].课程教育研究,2017(41):19.
[8] 樊佳,韩煦,陶榆玮,等.芽孢染色实验中枯草杆菌最佳培养条件探索[J].实验技术与管理,2018,35(03):58-61.
[9] 东秀珠,蔡妙英.常见细菌鉴定手册[M].北京:北京科学教育出版社,2001.
[10] 伯杰细菌鉴定手册[M].第九版.科学出版社,1994.
(责任编辑 周康)
