铁代谢及其与骨关节炎关系的研究进展
2020-10-12郭州彭雅文孙凯林家民郭嘉超王根淳郭风劲
郭州 彭雅文 孙凯 林家民 郭嘉超 王根淳 郭风劲
铁是机体必需的微量元素,是许多重要大分子的组成部分,包括参与能量生产、呼吸、DNA 合成和新陈代谢的大分子。维持适当的“游离铁”水平是维持体内铁平衡的关键部分,然而过量的“不稳定铁”对细胞或生物体都有潜在的危害,其具有参与氧化-还原反应产生有害自由基的倾向。由于这一双重性质,一系列精密系统严格控制游离铁的浓度,铁浓度的扰动可能是细胞损伤和疾病状态的原因或结果。大量研究表明铁代谢紊乱引起各类组织器官病变,但对关节及软骨细胞中的铁代谢研究相对较少,本文总结了生理及病理状态的铁代谢过程,以及铁代谢与骨质疏松、血友病关节炎、骨关节炎(Osteoarthritis,OA)等关节疾病的关系,并讨论铁超载与OA的相关性。
一、文献检索策略
本文通过中文检索词“铁代谢”“铁超载”“软骨”“软骨细胞”“骨关节炎”以及英文检索词“iron metabolism”“iron overload”“cartilage”“chondrocytes”“osteoarthritis”在中国知网、万方数据库、PubMed、Web of Science 等平台进行检索,筛选发表时间为近十年内,共检索到文献1 108篇,根据文献纳入与排除标准,最终纳入文献53篇,其中中文文献1篇,英文文献52篇(图1)。
文献纳入标准为:①已正式发表的期刊文献;②文献内容与铁代谢、铁超载、软骨破坏、OA密切相关;③同类研究中质量、证据等级较高的文献;④语言为中文或英文的文献。文献排除标准为:①文献质量、证据等级较低的文献;②学位论文、会议类文献;③非中文及英文的文献;④无法获得全文的文献。
二、生理过程中的铁代谢
(一)铁的吸收

图1 文献筛选流程图
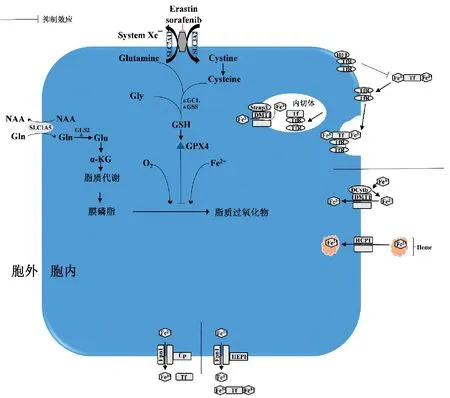
图2 铁代谢与氧化损伤(绘图作者:郭州) 血红素由HCP1摄取,而无机铁(Fe3+)通过DCytb1还原成Fe2+后,然后通过DMT1主动转运进入肠上皮细胞。Fe-Tf和TfR复合物被细胞内吞在内切体的酸性pH下,Fe3+与Tf分离并通过DMT1从内切体输出,然后Tf-TfR复合物循环回到细胞表面。HFE可以在Fe-Tf结合区与TfR相互作用,与Fe-Tf竞争性结合TfR,从而阻止Fe-Tf的摄取,负调控细胞对Tf结合铁的摄取。胱氨酸通过系统Xc-(System Xc-)输入以合成谷胱甘肽以及谷胱甘肽过氧化物酶4(Glutathione peroxidase 4, Gpx4)的正常功能是细胞存活所必需的,Gpx4活性可防止对细胞致命的脂质ROS的积累
铁是维持生物体生命的重要微量元素,参与氧的运输和储存及能量代谢,人体所有细胞都需要铁来维持正常功能。铁的正常来源为食物摄入[动物(Fe2+)或植物(Fe3+)]以及衰老红细胞中血红蛋白(Hb)释放的铁。膳食铁有两种来源,血红素铁和非血红素铁。血红素铁从肉类中获得,比从谷物和蔬菜中获得的非血红素铁更容易被吸收。在肠内,铁吸收的主要部位十二指肠肠上皮细胞的刷状缘,其上大量表达血红素载体蛋白1(Heme carrier protein, HCP1),HPC1 介导了肠细胞对血红素的吸收(图2)。HCP1对血红素的吸收是温度依赖性的,并且受机体铁水平的调节,可以饱和[1]。非血红素铁的吸收由二价金属转运体(divalent metal transporter,DMT1)介导,DMT1是一种金属离子转运体,具有一系列独特的二价底物,如Fe2+、Cd2+、Pb2+、Zn2+、Mn2+、Cu2+、Co2+等。在正常条件下,DMT1在肠道中的表达水平较低;然而,饮食缺铁导致十二指肠肠细胞DMT1显著增加[2-3]。DMT1不仅参与了铁在肠内的吸收,而且还参与了Fe-转铁蛋白(transferrin,Tf)通过转铁蛋白受体(transferrin receptor,TfR)内吞后铁的释放过程,DMT1对酸性内切体中Tf释放的铁向胞质中输出至关重要(图2)[4]。值得注意的是,非血红素铁主要是不溶性的Fe3+化合物通过DMT1 转运前必须还原。此外,在肠区与DMT1 同时表达的铁还原酶十二指肠细胞色素B(Duodenal cytochrome B,DCytb)的发现,对肠道铁吸收过程提供了一些启示[5]。DCytb 是抗坏血酸依赖性还原酶,DCytb1 可能参与了肠道中Fe3+的还原,允许它通过DMT1运输[5]。图2描述了DMT1和DCytb1在小肠肠细胞中铁吸收的功能模型。
(二)铁的入胞
在非睾丸细胞中,循环铁与Tf 结合,将铁从网织红细胞和肝脏向全身增殖细胞转运,从而控制“不稳定铁”的水平[6],并在与TfR 结合后通过受体介导的内吞作用导入细胞内[7]。所以,从这个意义上可以说Tf 不仅是铁的转运体,也是游离铁储存池,用于在细胞外隔离铁,直到需要铁,然后让它到达目标组织和细胞。Tf是一种糖蛋白,由肝细胞合成并分泌到血浆中[8]。Tf 由包含双叶的单链组成,包括N-和C-叶,每一叶都有两个结构域,称为N1、N2、C1和C2结构域,叶片由铰链连接,铰链形成一个包含铁结合区的裂口,铁的结合和释放是通过构象变化来协调的[9]。在酸性pH 下,Tf 每个叶上两个结构域之间发生54°到63°的旋转,结合铁随即被释放[10]。人体表达两种不同的TfR,TfR1和TfR2。TfR1每个多肽链有三个主要结构域:蛋白酶样结构域、顶端结构域和螺旋结构域[11],并由胞外区、跨膜区和细胞质区三部分组成,Fe-Tf 与TfR1 螺旋结构域结合,蛋白酶样结构域中的残基也参与了Fe-Tf 结合[12]。由于Tf 和TfR 在肠上皮细胞中不存在,Tf 只有在铁从十二指肠肠上皮细胞输出到血液中时,才在铁的转运中发挥重要作用。如图2 所示,一旦Fe-Tf 与TfR1 结合,刺激TfR 细胞质区的N-末端酪氨酸产生内吞信号,复合物即以酸性内切体形式被内吞到细胞中[13]。有研究发现了一种内切体铁还原酶前列腺六跨膜上皮抗原(sixtransmembrane epithelial antigen of the prostate 3, Steap3),与TfR1和DMT1存在共定位,协助铁的还原与释放[14]。酸性内切体中pH值的变化导致Fe3+与Tf分离,然后在Fe3+被Steap3还原为Fe2+后,由DMT1 将铁从内切体输出到胞浆中。TfR2主要存在于肝细胞、十二指肠和小肠的铁吸收细胞中,TfR2与TfR1 功能相似,但对Fe-Tf 的亲和力低于TfR1[15-17]。TfR1和TfR2 缺陷会产生不同的表型结果:TfR1 缺陷导致组织铁水平低,而TfR2缺陷导致血色素沉着症的发生[16]。
(三)铁的出胞
跨膜铁转运蛋白(ferroportin,FPN)是迄今为止唯一已知的铁出胞通道(图2)。人类的FPN 全长571 个氨基酸,含有一个保守的发夹环序列,在十二指肠中极化的肠细胞基底外侧膜、网状内皮细胞的胞浆中以及胎盘的合体滋养细胞的基底膜上大量表达[5,18]。FPN 也在单核巨噬细胞中特异表达,通过吞噬红细胞在铁的再利用中发挥关键作用[19]。
因为FPN将Fe2+运输到血浆中,并且铁必须被氧化以结合到Tf 中,所以认为FPN 与充当铁氧化酶的蛋白质协同作用。在肠道细胞,FPN和亚铁氧化酶(Hephaestin,Heph)协同作用控制铁流出。Heph是铜蓝蛋白(ceruloplasmin,Cp)的跨膜结合同源物,主要在肠道绒毛中表达,而Cp 在胶质瘤细胞、星形胶质细胞和巨噬细胞中表达[20]。FPN 和Heph 共定位于十二指肠和小肠的上皮细胞的基底外侧膜,描述FPN和Heph在肠源性铁从肠细胞输出到血浆中的功能和关联的模型如图2所示[21]。Cp是1948年从猪血清中分离出来的一种多铜氧化酶,具有铁氧化酶活性,并催化Fe2+被氧化为Fe3+[21](见图2)。Cp 还可起抗氧化的作用,因为它将Fe2+转化为Fe3+,从而通过减少Fenton 反应而减少活性氧自由基(reactive oxygen species,ROS)的潜在形成。
铁代谢在软骨中同样具有重要影响,随着年龄的增长,由于人体缺乏铁排泄的主要机制和关节软骨缺乏有效的血液循环,铁在软骨中持续积累,即可能造成关节软骨的铁过载环境[22]。铁过载可能破坏骨髓微环境,抑制骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)的增殖潜能,打破BMSCs 的分化平衡,从而损害软骨的损伤修复[23]。另外软骨中的铁积累将促进更多的ROS产生,激活巨噬细胞并分泌过量的基质金属蛋白酶(matrix metallo proteinases,MMPs)和促炎细胞因子,导致软骨细胞凋亡甚至破坏软骨[23-24]。
三、铁代谢的异常调节
(一)铁超载
当细胞内铁超载时,容易发生fenton 反应产生羟基自由基,促进脂质过氧化,激发细胞铁死亡途径,铁死亡属于一种调节性非凋亡细胞死亡途径[25]。不同于凋亡、典型的坏死、自噬和其他形式的细胞死亡,铁死亡是一种依赖于铁和ROS的细胞死亡形式,由细胞谷胱甘肽(GSH)依赖的抗氧化防御系统失活而触发,并以脂质过氧化为特征,最终导致毒性脂质ROS(L-ROS)积累而促进细胞死亡[26-27](图2)。游离铁从一开始就参与了铁死亡的过程,铁螯合剂、去铁胺可以抑制擦除素(Erastin)诱导的细胞致死性[26]。过量的脂质过氧化导致铁死亡,细胞中游离铁的补充和还原性谷胱甘肽的耗尽分别加重了这一表型。此外,含有花生四烯酰基和肾上腺素酰基的过氧化磷脂已被证明是铁死亡过程的直接执行者。半胱氨酸耗尽可诱导铁蛋白的降解,铁蛋白将通过核受体辅激活蛋白4(nuclear receptor coactivator 4, NCOA4)介导的自噬途径释放Fe3+[28]。因此,铁的可用性、ROS的产生、谷氨酸过量和半胱氨酸缺乏的协调同步导致铁死亡[29]。铁如何调节铁死亡信号通路中的上游或下游信号分子,及其在调节各种铁死亡诱导化合物和铁死亡信号通路中的作用仍有待明确阐明。
全身性铁超载中,原发性铁超载疾病通常是遗传性血色素沉着症的先导病例[30],继发性铁超载通常是由于体内引入过多的铁,例如铁负荷性贫血(地中海贫血、先天性促红细胞生成性贫血、铁母细胞性贫血、骨髓增生异常综合征等),以及输血或其他继发性铁超载[31-32]。在这些疾病中,循环中的铁超过转铁蛋白的缓冲能力,导致在肝脏、心脏和内分泌腺中吸收高活性形式的非转铁蛋白结合铁(non-transferrin bound iron,NTBI),过量的铁导致组织氧化损伤和器官功能障碍,导致肝硬化、心肌病、糖尿病和其他内分泌疾病。
遗传性血色素沉着症是由于编码铁调素(Hepcidin)本身的基因(HAMP)突变或Hepcidin表达的主要诱导者的基因突变,如血色素沉着症蛋白(hemochromatosis protein, HFE),TFR2,或血幼素(hemochromatosis protein 2, HFE2,也称为HJV)[33]。这导致不适当的低Hepcidin水平,不受调节的FPN活性,以及无法抑制饮食中铁的吸收和巨噬细胞的铁释放,导致铁在各组织中积累。铁负荷性贫血是以无效的红细胞生成为特征的疾病,造成Hepcidin 抑制,继而引起膳食中铁的高吸收和继发性铁超载[31]。一个典型的例子是β-地中海贫血,其中β-珠蛋白合成的异常导致成熟红细胞的毒性和凋亡,导致贫血。这刺激了促红细胞生成素的产生和未成熟红系前体的扩张,但红细胞生成仍然无效,贫血持续存在。扩大的红系前体群体分泌过量的红系调节因子,通常抑制Hepcidin以增加用于红细胞生产的铁的可用性,从而导致过量的铁吸收和铁超载。
(二)铁缺乏
铁缺乏症是指在明显缺铁性贫血之前的持续而无进展的铁储存减少。最广为人知的缺铁临床表现是贫血,缺铁性贫血是一种更严重的情况,低水平的铁与贫血和小细胞低色素红细胞的存在有关。根据世界卫生组织的数据,贫血影响着世界上近四分之一的人口,其中50%的病例可归因于缺铁[34]。缺铁性贫血的主要健康后果包括增加孕产妇和儿童死亡率的风险,损害儿童的认知和身体发育,降低成年人的体能和工作效率,以及老年人的认知下降。
慢性病贫血或炎症性贫血以循环铁水平降低为特征,尽管体内铁总量充足或更高,但限制了红细胞生成,这与许多慢性疾病相关,包括自身免疫性疾病、恶性肿瘤和慢性肾脏病[35]。在这些疾病中,炎症细胞因子如IL-6 可以通过激活JAK/STAT3途径以诱导Hepcidin的转录,从而下调FPN的表达或与Fe3+竞争性结合FPN,抑制膳食铁吸收和巨噬细胞铁循环[36]。
四、骨与软骨的铁代谢及其与软骨破坏的关系
越来越多的相关研究表明,许多骨软骨疾病与异常铁代谢密切相关。在衰老过程中,由于人体中缺乏铁排泄的主要机制,铁在各组织器官中积累。通过血清铁蛋白(SF)浓度估计的机体储存铁在女性更年期和男性青春期后迅速增加,年龄相关的铁积累已被证实是绝经后骨质疏松症的一种新的致病因素[37]。铁也参与了以铁超载为特征的疾病中骨质疏松症的发展,例如遗传性血色素沉着症和β-地中海贫血等[38]。铁超载可以通过Fenton反应产生过量的ROS,打破细胞中的抗氧化和促氧化剂平衡,导致DNA、蛋白质和脂质损伤,诱导成骨细胞凋亡,抑制成骨细胞的成骨分化[39]。此外,铁还可以促进破骨细胞分化和骨吸收,严重损害了小鼠的骨髓微环境,扰乱了BMSCs的增殖潜能和分化平衡[40]。BMSCs是位于骨髓腔内的成体干细胞。它们具有自我更新和多分化的能力,在身体的发育、衰退和疾病中起着至关重要的作用。在不同诱导因素的影响下,BMSCs 可以分化为成骨细胞、脂肪细胞、软骨细胞等。此外,它们在骨和软骨的发展和重建、损伤修复和组织再生方面具有重要的潜力。因此,BMSCs 与OA 的发生和发展密切相关[41]。此外,已有结果表明,铁过载产生ROS,阻断PI3K/AKT 和JAK/STAT3 信号通路,激活p38-MAPK通路,继而诱导成骨细胞系MC3T3-E1细胞G1期阻滞和自噬,干扰骨形成及骨与软骨的正常发育[42]。
铁在诱导几种促炎细胞因子的表达中也发挥关键作用,关节内促炎性细胞因子与抗炎细胞因子维持着动态平衡,共同维护关节软骨的生理代谢。促炎性细胞因子与抗炎细胞因子的动态失衡即引起关节软骨的代谢异常,从而导致关节软骨变形、丢失及再生异常,最终导致膝关节正常结构破坏。促炎性细胞因子也称前炎性细胞因子,是一类内源性多肽,主要由免疫系统细胞生成,具有多种强大的生物学效应,可介导多种免疫反应。目前发现的OA促炎性细胞因子主要包括白细胞介素(IL-1β)、肿瘤坏死因子-α(TNF-α)、IL-6、IL-15、IL-17 及IL-18 等[43]。这些炎症因子将促进软骨细胞凋亡,破环软骨外基质(ECM),加速OA中软骨的退行性病理改变(图3)[24]。并且铁通过参与调控c-myc 和mdm2 等关键基因的表达而参与滑膜血管翳生长的启动,这些基因负责滑膜细胞增殖,促进血管性滑膜炎的发生发展[44]。
血友病关节损伤是一种典型的铁超载导致的关节病变。同一关节(靶关节)反复出血导致关节进行性损害和血友病关节病的发展,导致疼痛、畸形和残疾。血友病关节病的发病机制是多因素的,包括退行性软骨介导的和炎性滑膜介导的病理过程,这一概念类似于OA 中发现的退行性关节损伤以及类风湿性关节炎中的炎症过程。这些过程最终导致纤维化和关节破坏。关节内出血可能首先影响正常的无血管关节软骨,因为铁催化的活性氧中间体(ROI)诱导软骨细胞凋亡,对骨转换的两个生物标志物-软骨低聚基质蛋白(一种组织特异性非胶原基质蛋白)和Ⅱ型胶原的分析证实,关节软骨是血源性关节病发展的早期目标[38,45-46]。当关节出血复发或严重时,大量含铁血黄素(一种铁储存复合物)沉积到滑膜中,超过了滑膜将其吸收分解并转移到全身循环的能力。随着铁的积累,将介导氧化应激和炎症,滑膜的正常生理代谢特性发生改变,含铁血黄素的滑膜产生炎症介质,从而产生关节内细胞因子风暴,诱导慢性滑膜炎的增殖性疾病发生,细胞因子将增加单核细胞对转铁蛋白结合铁和非转铁蛋白结合铁的摄取,并增加滑膜成纤维细胞对转铁蛋白结合的铁的摄取[47],这种增加的铁摄取加速了出血-滑膜炎-出血的恶性循环。然后增殖性滑膜炎扩展到关节软骨表面,软骨基质被从肥大的滑膜、软骨细胞和血管内组织释放的结缔组织蛋白酶降解,最终导致破坏性关节病[48]。

图3 血友病病人血液引起关节损伤机制的示意图(绘图作者:郭州) 铁(Fe2+)与过氧化氢(H2O2)的相互作用、巨噬细胞(Mo/Mφ)的激活、基质金属蛋白酶(MMP)和促炎细胞因子的作用是关节软骨破坏和滑膜炎症过程中的关键调控点
OA也被称为退行性关节疾病,常发生于中老年人,通常包括关节软骨的进行性丢失,并伴有关节软骨的修复,软骨下骨的重塑和硬化,软骨下骨囊肿和边缘骨赘的形成。病理上,该病的特征是裂隙或局灶性糜烂性软骨损伤,软骨丢失和破坏。虽然OA 被认为是一种非炎症性关节炎,但对其机制仍知之甚少。一些研究报告说,与其他年龄段相比,老年人中高铁储存的发生率更高,这一转变在老年女性中比在男性中更为明显,一定程度上是由于她们的生殖功能停止(没有与月经或怀孕相关的铁损失)[49]。目前,已有研究证实OA病人滑液铁浓度明显高于类风湿关节炎病人和健康人(P<0.05)[50]。并且发现在HFE基因敲除的遗传性血色素沉着症小鼠模型中,铁超载与其骨关节炎的加速进展有关[51]。骨关节炎是HFE型血色素沉着症病人最常见的并发症之一,但其发生和发展的机制仍不完全清楚。从新生HFE 基因敲除小鼠分离的关节软骨细胞原代培养对高铁浓度的反应的证据表明,C57BL/6野生型小鼠和HFE基因敲除小鼠来源的软骨细胞在暴露于50 μM铁时,都会发展出OA相关表型的特征,如金属蛋白酶表达增加,细胞外基质产生减少,以及软骨蛋白聚糖表达水平降低[52]。此外,HFE基因敲除小鼠软骨细胞中铁代谢标志物和MMP3的表达也增加,表明细胞内铁蓄积的易感性增加。总而言之,高浓度的铁会损害软骨细胞的新陈代谢,可促进软骨细胞建立与OA 相关的表型[22]。铁超载促进了软骨细胞的抗氧化反应,在关节损伤和/或创伤时,表现出全身铁超载的病人可能会出现关节软骨退化,伴随着OA的进展[53]。
因此可以推测铁超载直接或间接地参与OA的关节软骨破坏、滑膜破坏和软骨下骨硬化的病理变化过程。
五、总结
综上所述,铁代谢参与全身各个组织器官的生理代谢或病理生理过程,其调控机制复杂,涉及转录、翻译及蛋白质间相互作用多个水平的调节,并且需要依赖于肝脏、小肠、血液循环等多系统的协同作用。铁代谢异常可作为疾病的原因或结果见于各系统或全身性的代谢疾病、老年性疾病、慢性炎症、肿瘤等各类常见疾病。在骨关节疾病中,铁超载可以参与炎症反应、扰乱BMSCs 的增殖潜能和分化平衡、损害软骨细胞的新陈代谢、激发氧化应激反应从而促进软骨细胞的凋亡、ECM的降解等,导致骨质疏松,软骨破坏等病理改变。关于铁代谢与OA 发展过程的关联机制尚未进行明确阐述。但随着年龄的增长,由于人体缺乏铁排泄的主要机制和关节软骨缺乏有效的血液循环,铁在软骨中持续积累。我们可以推测中老年OA病人的退行性软骨改变与关节中铁超载引起的软骨破坏相关。由于铁代谢分子机制的复杂性,目前人们对铁超载引起骨软骨损伤的相关作用机制及信号分子的研究仍相对缺乏,需要进一步的研究来阐明关节损伤的确切机制,为开发新的策略来预防或扭转铁过载相关软骨破坏和OA提供新思路。
