含茚满结构二胺-E51环氧树脂固化反应动力学的研究
2020-10-12李晓雷黄慧琳
李 明,李晓雷,黄慧琳
(1.上海化工研究院有限公司,上海 200062; 2.上海华谊树脂有限公司,上海200000)
0 前言
环氧树脂是一类分子中含有2个以上—CH(O)CH—官能团的聚合物。由于—CH(O)CH—环氧基团的化学活泼性强,可用多种含有活泼氢的化合物使其开环聚合,固化交联生成网状结构。若环氧值过高,则树脂强度较大,但较脆;若环氧值中等,则树脂在高、低温度不同条件时强度都比较好;若环氧值低,则树脂在高温条件时的强度较差。这是因为强度和交联度的大小有关,环氧值高的树脂固化后交联度高,环氧值低的树脂固化后交联度低[1-2]。
含茚满结构二胺5(6)-氨基-1-(4-氨基苯基)-1,3,3-三甲基茚满(PIDA)可用作树脂、塑料的加工助剂[3-4],但其作为固化剂在环氧树脂中的应用鲜有报道。PIDA分子中含有多个苯环结构,在提高聚合物刚性的同时,可以提高树脂的耐热性能;PIDA分子中含有特殊的茚满环结构,茚满环是非对称、扭曲结构,可以提高树脂的耐热性,还可以提高树脂的可加工性能[5-6]。
笔者选用环氧值为0.51的E51环氧树脂作为树脂基体,选择PIDA作为固化剂,并对比使用4,4′-二氨基二苯甲烷(DDM)、4,4′-二氨基二苯砜(DDS)2种芳香二胺作为固化剂,研究3个体系的固化反应动力学,为进一步改进并优化E51与PIDA固化体系提供参考。
1 实验部分
1.1 主要药品
PIDA,实验室合成[5];
E51环氧树脂,工业级,常州市润翔化工有限公司;
DDM,化学纯,上海展云化工有限公司;
DDS,化学纯,国药化学试剂有限公司。
1.2 主要仪器
傅立叶红外光谱分析仪(FTIR),Spectrum Two,美国铂金埃尔默有限公司;
电热鼓风干燥箱,GF-9140A,上海实验仪器有限公司;
差示扫描量热(DSC)仪,DSC3,美国梅特勒托利多仪器有限公司;
自转公转搅拌机,ARE-310,日本Thinky公司;
三辊研磨机,ZYTR-80E,深圳中毅科技有限公司。
1.3 树脂共混体系的制备及固化
称取20.31 g PIDA置于100 mL带盖塑料杯中,再称取59.72 g E51环氧树脂,盖紧盖子并放入自转公转搅拌机中搅拌10 min,将搅拌后的混合物置于三辊研磨机上研磨至颗粒粒径在5 μm左右,反复研磨混合物3次。称取19.18 g DDM与60.51 g E51环氧树脂,17.74 g DDS与70.15 g E51环氧树脂按照上述操作制备树脂共混料。
分别称取适量的上述3种树脂共混料置于铝箔模具中,流平,然后置于鼓风干燥箱中进行程序升温热固化,固化程序为60 ℃(0.5 h)、80 ℃(0.5 h)、120 ℃(0.5 h)、160 ℃(1 h)、180 ℃(1 h),最后在烘箱内自然冷却至室温,得到固化材料。
1.4 结构与性能
红外光谱分析测试:采用Spectrum Two测定固化材料的傅立叶红外光谱图,金刚石衰减全反射(ATR)检测模块,扫描波数为500~4 500 cm-1,扫描8次。
DSC测试:采用DSC3测定固化材料的固化温度,升温速率分别为5 K/min、10 K/min、15 K/min及20 K/min,在氮气体积流量为50 mL/min条件下进行动态固化行为扫描,得到对应的DSC曲线。
2 结果与讨论
2.1 结构表征
图1为3个不同共混体系(固化前)及固化材料(固化后)的傅立叶红外光谱图。
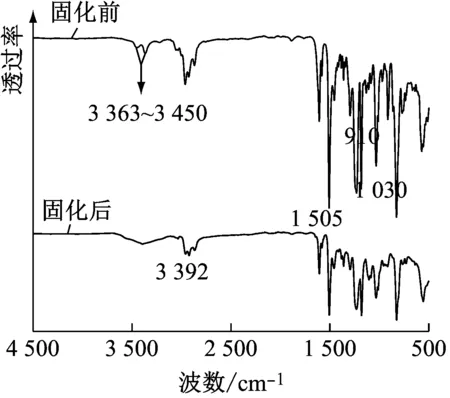
(a) E51+PIDA体系

2.2 DSC表征
图2为3个不同共混体系在不同升温速率下的DSC谱图,其对应的固化温度(峰顶温度)及相关参数见表1。由图2可以看出:3个体系的固化反应都是放热反应,且呈单一的宽峰,随着升温速率的增加,DSC曲线的峰顶温度向高温方向移动,这可能是因为随着升温速率的提高,固化反应单位时间内产生的热效应越大,产生的温差就越大,体现在曲线上就是峰顶温度向高温方向移动。
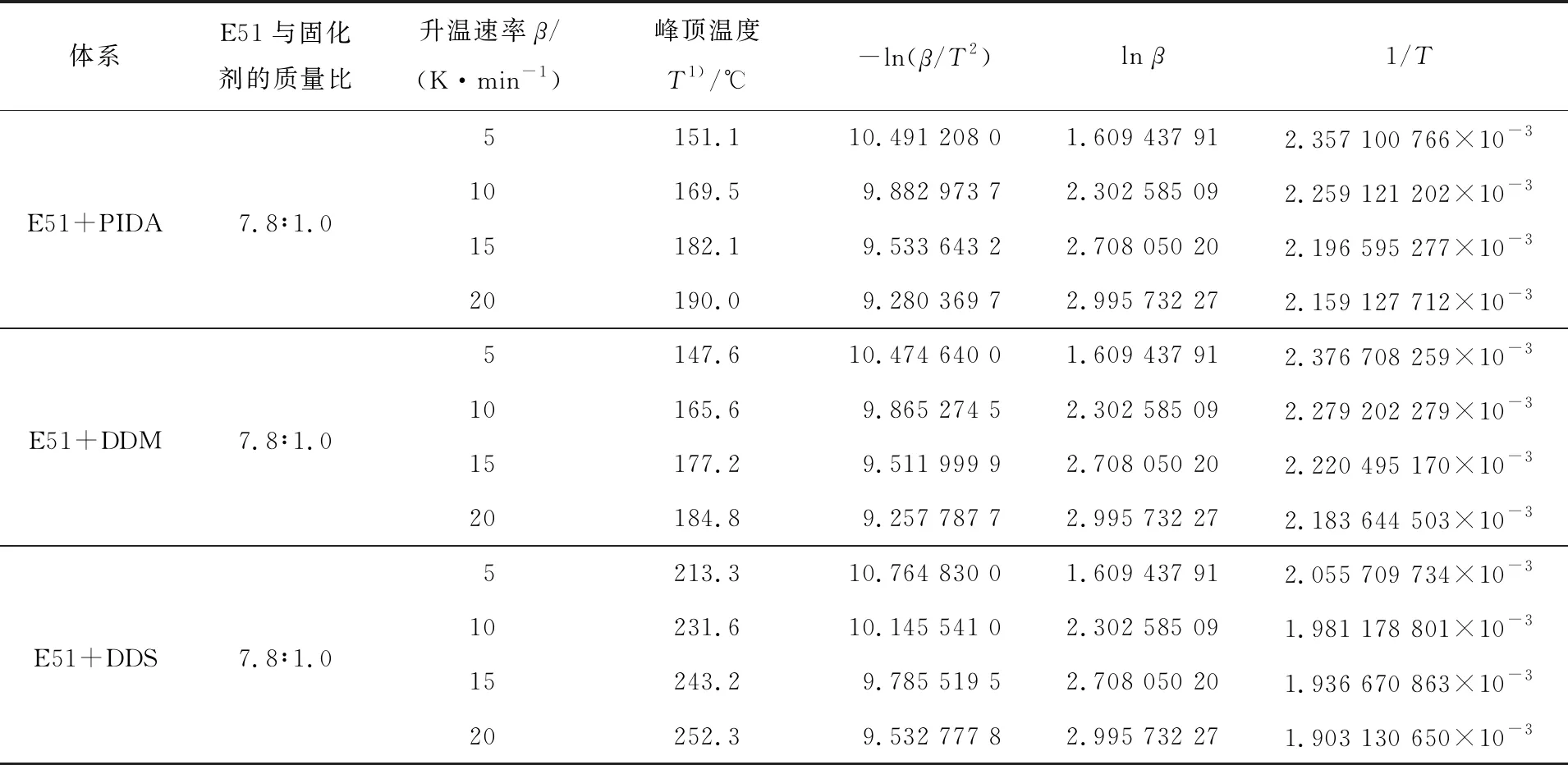
表1 不同升温速率下峰顶温度及相关参数
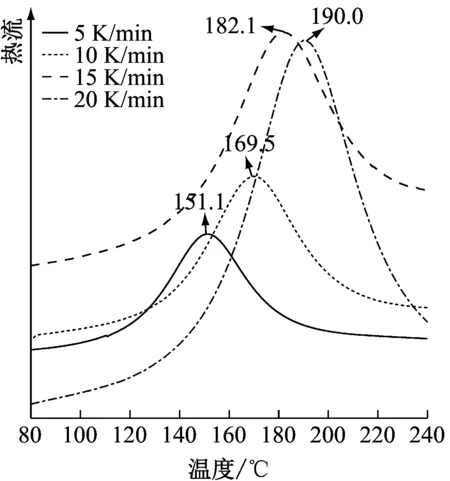
(a) E51+PIDA体系
2.3 固化反应动力学研究
2.3.1 表观活化能
环氧树脂与固化剂组成的体系固化反应能否进行由体系反应的表观活化能决定,表观活化能可以直观地反映固化反应的难易程度,表观活化能越低,反应越容易进行[7-8]。研究环氧树脂的固化反应动力学的方法有很多,主要分为三大类:等温DSC法、非等温DSC法及红外光谱法[9-11]。笔者采用非等温DSC法,通过对样品进行不同升温速率条件下的扫描,得到峰顶温度,并使用2种常用模型——Kissinger模型与Ozawa模型[12-13]计算表观活化能。2种模型的计算公式为:
(1)
(2)
式中:A为频率因子;β为升温速率,K/min;lnG(a)为反应机理函数的积分形式;R为理想气体的气体常数,取8.314 472 J/(mol·K);E为表观活化能,kJ/mol。

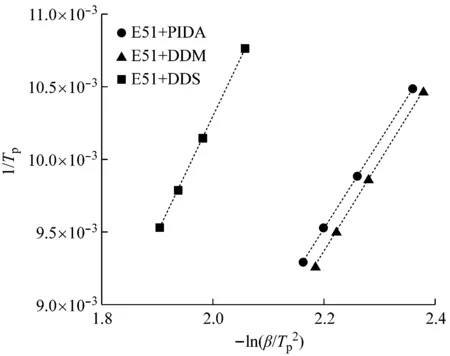
(a) Kissinger模型
由图3可见:Kissinger模型与Ozawa模型的拟合曲线的相关系数都大于0.999。通过Kissinger模型计算得到E51与PIDA、E51与DDM及E51与DDS 3个固化体系的表观活化能分别为50.39 kJ/mol、52.05 kJ/mol、67.38 kJ/mol;通过Ozawa模型计算得到E51与PIDA、E51与DDM及E51与DDS 3个固化体系的表观活化能分别为54.89 kJ/mol、56.41 kJ/mol、72.03 kJ/mol。用Kissinger模型计算的表观活化能比用Ozawa模型计算的表观活化能小,虽然2个模型的计算方法不一样,但是其计算的表观活化能大小排序是相同的。E51与PIDA固化体系反应的表观活化能最小,反应所需活化能最小;E51与DDS固化体系的反应表观活化能最大,反应所需活化能最大;说明PIDA的反应活性最大,DDS的反应活性最小,分析原因可能是DDS的对称结构增大了分子空间位阻,降低了分子间的反应活性。
2.3.2 反应级数
树脂固化体系的反应级数由Crane模型[14]求出:
(3)
式中:n为反应级数。
3个体系Crane模型的lnβ对1/Tp的线性回归曲线见图4。
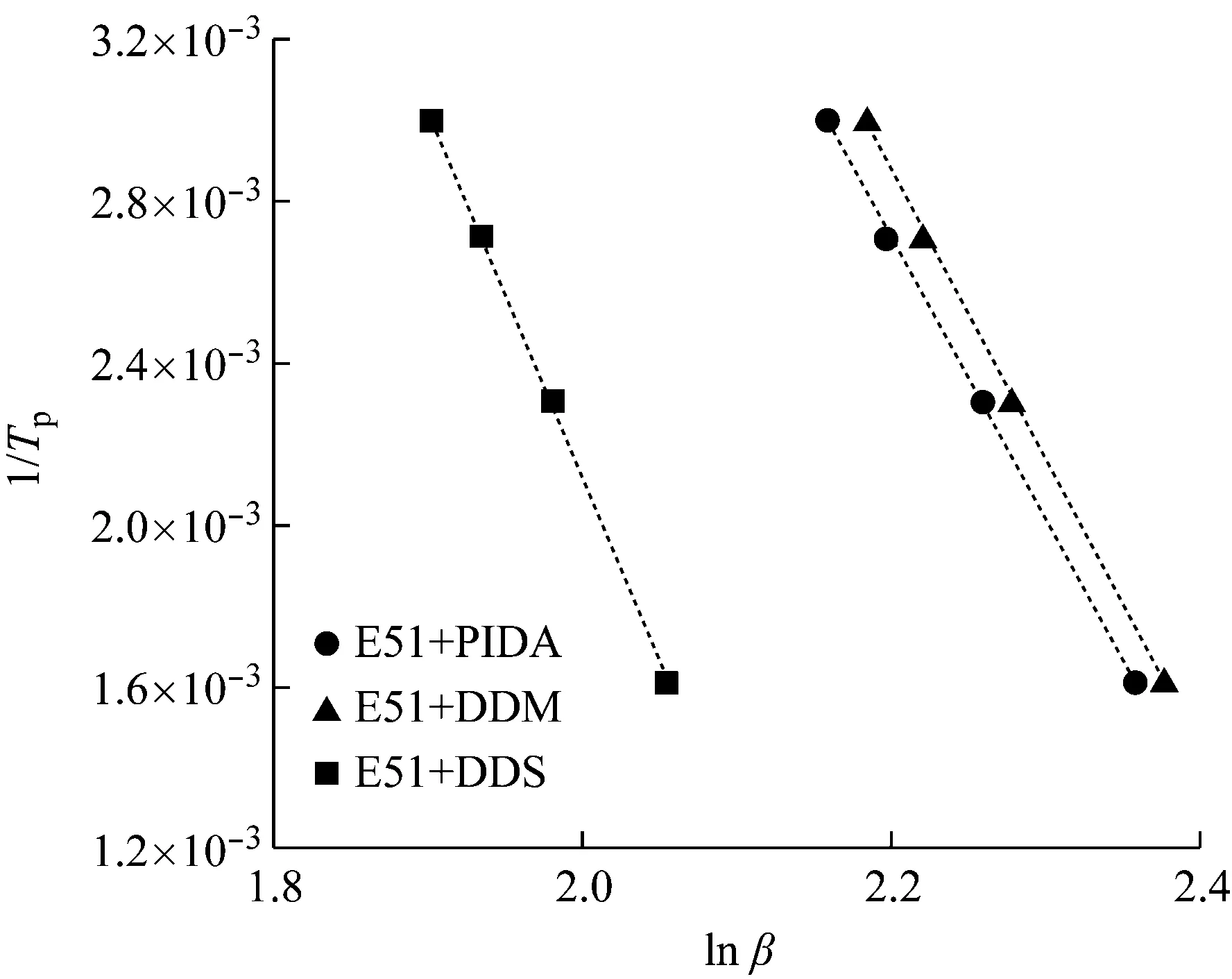
图4 3个体系Crane模型的ln β对1/Tp的线性回归曲线
由图4可得:3个体系的相关系数都大于0.999,将曲线斜率(-9.113 5、7.136 9、-6.945 1)带入式(3),计算得到E51与PIDA、E51与DDM及E51与DDS 3个固化体系的反应级数分别为0.873、0.856、0.889,3个体系都可以近似为一级反应。
3 结语
(1) E51与PIDA体系固化反应是放热反应,在5~20 K/min的升温速率条件下,随着升温速率的增加,反应峰顶温度向高温方向移动。
(2) Kissinger模型与Ozawa模型计算得出E51与PIDA固化体系的表观活化能分别为50.38 kJ/mol、54.91 kJ/mol,是3个体系中最小的,说明PIDA是3种芳香二胺固化剂中最容易反应、最活泼的固化剂。
(3) Crane模型计算得出E51与PIDA固化体系的反应级数为0.87。
