温州蜜柑成花基因保守片段克隆与生物信息学分析
2020-10-12吴韶辉温明霞柯甫志徐建国
黄 贝 王 鹏 吴韶辉 温明霞 柯甫志 徐建国
(浙江省柑橘研究所 台州 318020)
柑橘是我国栽培面积最广、经济地位最重要的果树之一。温州蜜柑是柑橘中品质优良,栽培广泛的一个品种,据国家统计局和浙江省业务部门数据显示,2017年温州蜜柑在浙江省种植面积达到4.99万hm2,占柑橘类水果种植面积的52%左右[1]。随着市场竞争压力加大,提高主栽品种温州蜜柑的产量和质量显得极为重要,而花芽分化时间、成花质量的好坏直接关系到果品的成熟和上市时间[2]。
形成花芽是植物从营养生长向生殖生长转变的重要标志[3],柑橘可以通过砧木嫁接的方式打破物候期,接穗提早进入成熟期。除此,植物花芽分化还受多种内外因子的影响,内在因子包括树体C/N代谢、内源激素,外在因子包括外施激素、多胺、多效唑,环境水份、温度和外在胁迫的控制,但究其根本,都是内外环境变化对成花基因的表达(上调或者下调)的干扰,从而出现决定性的影响。Bohlenius H.2006年提出树木中的成花是受到CO/FT(CONSTANS/FLOWERING LOCUS T)基因相互表达共同调控的[4],FT基因也被认为是成花素的一个重要组成部分;Nishikawa F.发现柑橘FT基因的表达水平与柑橘花芽分化的形成和完全具有很好的相关性[5]。而转录因子FLC(FLOWERING LOCUS C)是决定能否顺利成花的重要基因,研究发现在低温环境下,FLC抑制FT的表达,能避免温度过低造成花芽伤害,从而形成迟花现象[6]。另一个转录因子GI(GIGANTEA)对CO和FT的表达都具有促进作用,并且该因子对干旱胁迫有干旱逃避反应,应激反应使植株干旱条件下存活时间更长并促进开花的关键因子FT和CO提前表达[7]。GI,CO,FT,FLC基因主要在叶片中协同表达产生“成花素”,进而影响分生组织的SOC1(SUPPRESSOR OF OVEREXPRESSION OF CONSTANS 1),AP1(APETALA),FD,LEAFY基因表达,如图1[8]。FT产生的“成花素”蛋白与茎尖分生组织的转录因子锌指结构蛋白FD结合,形成FT-FD复合结构,在盐胁迫情况下调控植株为延迟开花[9]。FT-FD蛋白复合体进而促进SOC1的表达,同时刺激和开花直接相关的AP1基因,SOC1和AP1都促进植物花芽形成。LEAFY是另一个被证明和植物开花直接相关的转录因子,进化上保守,并在成花过程起关键性作用,也是调节逆境和植物疾病的关键因子之一[10]。因此,为促进温州蜜柑成花,提高花芽质量,克隆温州蜜柑调控成花转录因子是一个重要且迫切的分子研究基础,检测成花途径上基因的表达情况可以快速地反映促进花芽分化手段的优劣性,及时调整处理方案。本研究以温州蜜柑嫩梢为材料,集中克隆了8条成花调控因子的保守片段,片段长度较长,完整度高,可以作为定量PCR的模板设计引物,也可以作为RACE的模板,进一步获取全长片段,做下一步的功能验证。
1 材料与方法
1.1 实验材料
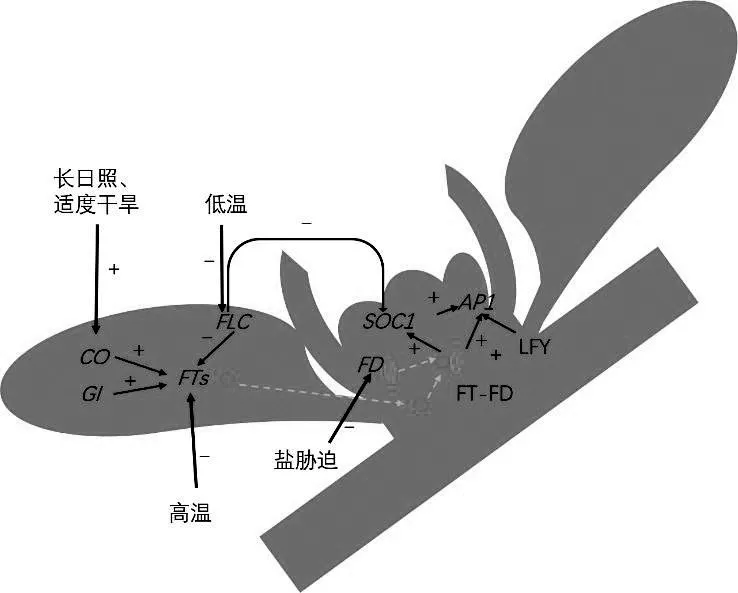
图1 温州蜜柑花芽分化模型[10-12]
以5年生温州蜜柑-由良(浙江省柑橘研究所种质资源苗圃)为实验材料,采取长势良好一致的嫩梢部位,液氮冷冻,-80℃保存备用。
1.2 实验试剂
TransZol Up Plus RNA Kit(Code#ER 501)RNA提取试剂盒(全式金生物公司,北京),TransScriptII All-in-One First-Strand cDNA Synthesis SuperMix for PCR(Code#A H321)普通反转录试剂盒(全式金生物公司,北京);DNA Marker 2000bp(艾德莱生物公司,北京)。KOD FX Neo高保真DNA聚合酶(TOYOBO株式会社,日本东京),DNA片段胶回收试剂盒(艾德莱生物公司,北京),琼脂糖(生工公司,上海),其他均来自国产分析纯试剂。
2 实验方法
2.1 RNA的提取
植物样品经液氮研磨后,用TransZolUp Plus RNA Kit进行RNA提取,使用Nanodrop 2.0测定RNA浓度,取2μL RNA使用1.5%的琼脂糖凝胶进行电泳检测。
2.2 cDNA第一条链合成
室温条件下,在200μLPCR管中加入以下组分 :1μ g 总 RNA,4μL5 x TransScript II All-in-One SuperMix for PCR,RNase-free水补足20μL。轻柔混匀,25℃孵育10min,50℃孵育30min,85℃加热5s失活TransScript II。测定反转录产物浓度,分装两管-20℃保存备用。
2.3 温州蜜柑成花基因核心序列的克隆
由于登陆的柑橘属成花基因并不丰富,因而以NCBI上登陆的柑橘属(Citrus sinensis,Citrus unshiu,Poncirus trifoliata)同源cDNA为模板,结合甜橙基因组数据库序列信息,用Premier Primer软件设计特异性引物获取核心基因,PCR产物进行凝胶电泳检测,将目的条带回收,引物见表1。采用TOYOBO公司高保真酶KOD FX Neo,PCR反应体系如下:2 x PCR Buffer for KOD FX Neo 25μL,2mM dNTPs 10 μ L,KOD FX Neo 1 μ L,Primer1 1 μ L,Primer21 μ L,cDNA 200 ng,ddH2O up to 50μL。反应条件如下:94°预变性2min,98°变性10s,退火30s,68°延伸30s/kb,30个循环,68°后延伸10min,PCR产物进行1.5%琼脂糖凝胶电泳,回收目的条带,连接到克隆载体pEASY blunt zero进行测序。
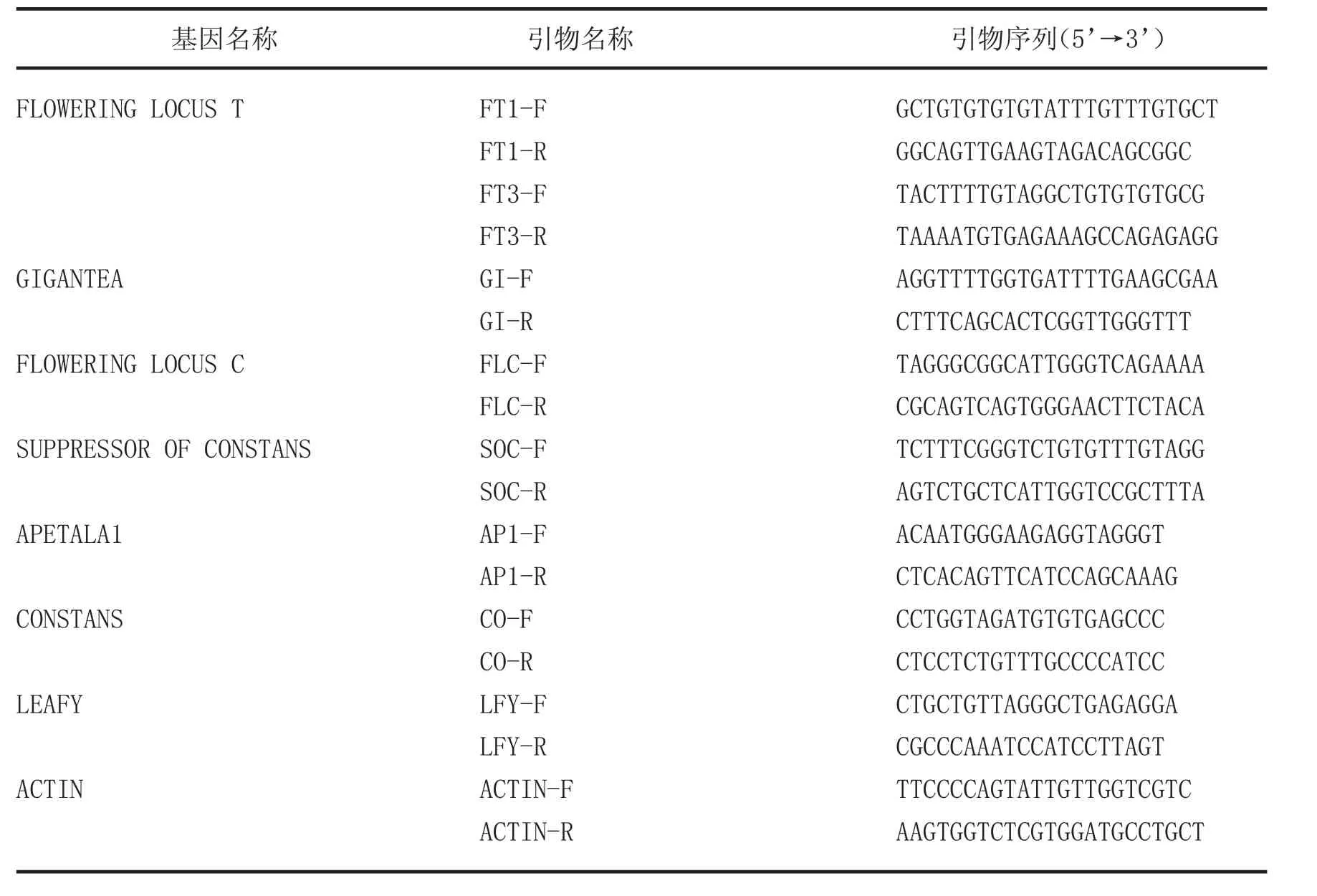
表3 温州蜜柑成花基因PCR特异性引物

图2 :温州蜜柑嫩梢RNA电泳图
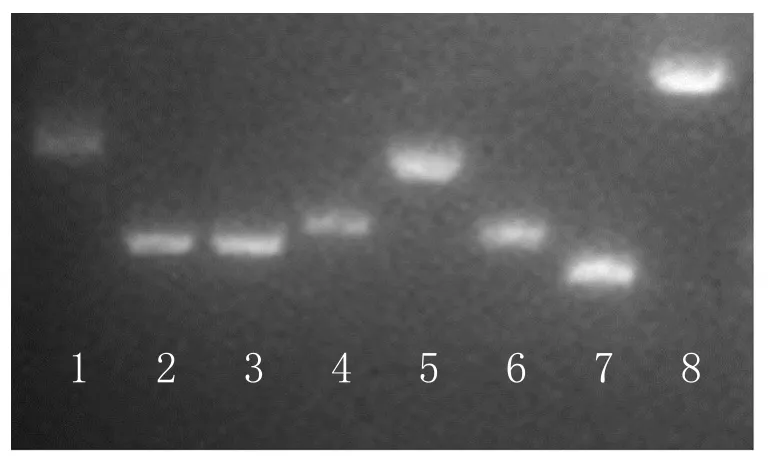
图3 CuFT1,CuFT3,CuAP1,CuSOC1,CuFLC,CuGI,CuCO,CuLEAFY电泳胶图
2.4 成花基因生物信息学分析
利用NCBI在线软件Conseyveb.Domain Seaycn Seyvice分析蛋白质的保守结构域。确定克隆的序列具有基因功能结构,结合NCBI nucleotide blast其他物种核酸序列,下载多个不同植物成花基因,利用 MEGA 6软件的Neighbor Joining(NJ)模型进行 500次Bootstrap统计学检验,并构建基因(FT1,FT3,AP1,SOC1,FLC,GI,CO,LEAFY)的系统进化树。
3 结果与分析
3.1 RNA的提取
嫩梢提取RNA28S和18S条带清晰(图2),NanoDrop2.0检验OD260/280和 OD260/230均在2.0左右,说明没有盐、巯基、胍等其他杂质污染,RNA的纯度和完整性都较好,可以满足后续实验要求。
3.2 温州蜜柑成花基因保守区克隆与序列分析
根据NCBI和甜橙基因组数据库的序列信息,设计特异性引物进行PCR扩增获取目标序列。经测序,将比对正确的序列命名为CuFT1,CuFT3,CuAP1,CuSOC1,CuFLC,CuGI,CuCO,CuLEAFY。其中,CuFT1保守区域的长度为557bp,CuFT3保守区域的长度为766bp,CuAP1保守区域的长度为699bp,CuSOC1保守区域的长度为1044bp,CuFLC保守区域的长度为805bp,CuGI保守区域的长度为981bp,CuCO保守区域的长度为1052bp,LEAFY保守区域的长度为1009bp,电泳结果如图3所示。经过NCBI保守区域结构预测(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi),预测结构如图4所示。目的基因都包含其他物种该基因的保守结构域,CuFT1和CuFT3序列包含PBP结构域;CuAP1序列包含特有的K-box结构域和MADS结构域;CuCO序列包含COTANGS基因特有的CCT superfamily结构域;CuSOC1序列包含K-box结构域和MADS结构域;克隆的成花基因片段与甜橙,莱蒙登陆的成花基因具有相同的特有结构域。CuGI与登陆的莱蒙和甜橙GI cDNA序列比对率高达99%以上,如图4所示。因此,推断克隆出来的保守序列都是具有基因功能的片段。以本研究克隆的序列为模板,设计特异性引物可以检测在不同时空处理下开花调控基因表达量的差异,可以为研究柑橘花芽分化的研究人员提供简洁序列参考,极大地缩短序列验证时间。
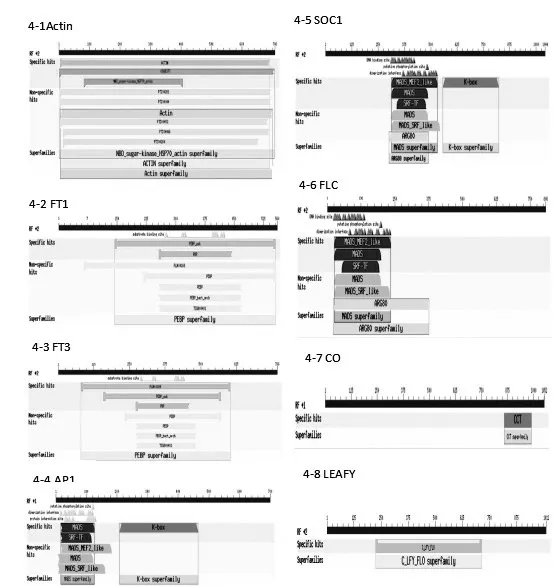
图4 克隆基因和基因家族共有保守区域
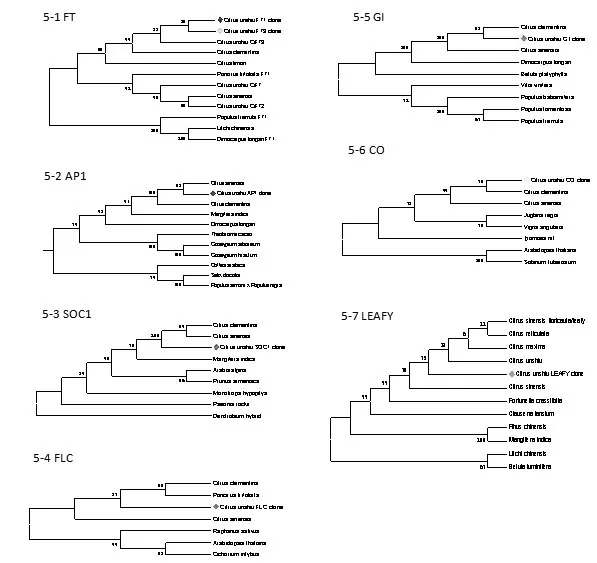
图5 温州蜜柑成花基因和其他物种成花基因进化树
3.3 温州蜜柑成花基因的系统进化分析
将通过NCBI数据库中已公布的其它物种的成花基因(https://blast.ncbi.nlm.nih.gov)与克隆序列进行同源性比对,并利用MEGA 6.0软件进行系统进化树构建。如图5所示,温州蜜柑成花基因与柑橘属植物甜橙、莱蒙、枳具有非常高的同源性,在同一个进化分支上,亲缘性最高,具体物种名称见图5注示。
4 结论与讨论
温州蜜柑品种全、质量品质优上,早中晚成熟期覆盖面,是中国占比最高的主栽品种,因而提高其产量和质量显得极为重要。花芽分化时间和成花质量是保证果品质量与成熟期的前提,因而研究温州蜜柑的开花是一项基础且重要的工作。本研究通过克隆成花基因序列以及分析发现,温州蜜柑和同属的柑橘类果树基因保守性较高,部分位点有差异。本次实验测序验证正确的温州蜜柑为后续开花调控,包括促成栽培、延后栽培、分析成花数量与质量都有重要的实际意义。
