Sophocarpine对三硝基苯磺酸诱导的小鼠结肠炎的作用及其机制
2020-10-10莫安薇黄琰菁杨生辉王燕艳
莫安薇 黄琰菁 杨生辉 王燕艳
(海南省人民医院肿瘤内科二区,海南 海口 570311)
克罗恩病(CD)是炎症性肠病(IBD)的一种,该病以慢性复发性肠道炎症为主要临床表现〔1〕。CD患者的病理学改变主要为透壁性肠炎,而这种炎症的典型特点是过度激活的Th1及Th17型免疫反应,相反Treg水平显著低下〔2〕。此外,肠屏障功能受损也是CD的主要发病机制假说之一。因此,针对肠黏膜免疫反应和屏障保护的治疗有望延缓CD疾病进程。槐果碱(Sophocarpine)是从中药苦豆子植物中提取的一种生物碱,新近的研究显示其具有抗炎、抗氧化及免疫调节作用〔3,4〕。本文观察Sophocarpine对三硝基苯磺酸(TNBS)诱导的结肠炎小鼠的作用及可能机制。
1 材料与方法
1.1实验动物 采用6~8周龄,雄性Balb/c小鼠(购于南京大学模式动物研究所),体重为(22.0±1.5)g,SPF环境饲养,控制环境温度为(23±2)℃,普通饲料喂养,自由饮水。
1.2主要试剂 Sophocarpine(货号:SML2422)、TNBS(货号:P2297)、异硫氰酸荧光素(FITC)-葡聚糖(货号:46944)购于美国Sigma公司。兔抗鼠胱冬肽酶(Caspase)-1抗体(货号:ab179515)、兔抗鼠凋亡相关斑点样蛋白(ASC)抗体(货号:ab238848)、兔抗鼠核苷酸结合寡聚化结构域样受体蛋白(NLRP)3(货号:ab232401)、兔抗鼠ZO-1抗体(货号:ab96587)及兔抗鼠claudin-1抗体(货号:ab15098)均购于英国Abcam公司。白细胞介素(IL)-10(货号:PM1000B)、肿瘤坏死因子(TNF)-α(货号:PMTA00B)及干扰素(IFN)-γ(货号:PMIF00)酶联免疫吸附试验(ELISA)试剂盒购于美国R&D公司。
1.3结肠炎模型建立及分组干预 Balb/c小鼠接受TNBS造模,采用0.7%的戊巴比妥钠腹腔注射麻醉,经肛门灌入0.1 ml TNBS 50%乙醇溶液(TNBS剂量为150 mg/kg),保持小鼠头低脚高倾斜30°体位30 min,7 d后小鼠形成稳定的肠炎〔5〕。造模后随机分为模型组及干预组,每组8只。干预组每日接受Sophocarpine腹腔注射(50 mg/kg,溶于0.1 ml生理盐水),模型组接受等量生理盐水。干预4 w后处死小鼠进行后续检测。
1.4结肠组织学炎症评分 取小鼠结肠常规进行石蜡包埋,HE染色,参照Spencer等〔6〕报道进行炎症评分,评分范围0~4分,分数高提示炎症严重。
1.5结肠黏膜炎症介质水平评估 刮取小鼠结肠黏膜组织,采用ELISA试剂盒,依据说明检测TNF-α、IFN-γ及IL-10水平。
1.6肠通透性评估 依据既往报道〔7〕,禁食4 h后,灌胃法给予每只小鼠FITC-葡聚糖600 mg/kg;灌胃后4 h处死,眼球取血0.5 ml,静置后分离提取血清,采用荧光测定法检测FITC-葡聚糖水平。
1.7脾及肠系膜淋巴结Treg细胞检测 取小鼠肠系膜淋巴结及脾脏,匀浆,用流式细胞检测法检测Treg(Foxp3+CD25+CD4+)细胞比例,采用FlowJo-V10软件分析Treg细胞在脾和淋巴结中的比例。
1.8Western印迹法检测小鼠结肠内蛋白 刮取肠黏膜组织,充分匀浆,提取总蛋白,Bradford法定量,电泳、转膜、封闭,加入Caspase-1、ASC、NLRP3、ZO-1、claudin-1或β-actin一抗稀释液(1∶1 000),4℃摇床12 h,滴加二抗,洗膜,显影并拍照,结果采用Image J软件分析。
1.9统计学方法 采用GraphPad8.0软件进行非配对t检验。
2 结 果
2.1Sophocarpine改善了结肠炎小鼠结肠组织学炎症评分 模型组结肠组织炎症评分〔(3.10±0.74)分〕显著高于干预组〔(2.10±0.74)分,P<0.01〕。见图1。
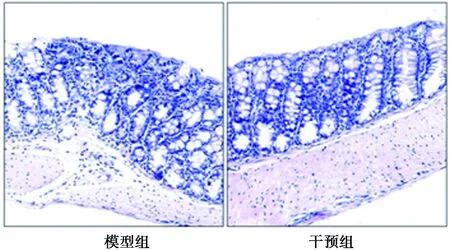
图1 两组结肠组织炎症(HE,×100)
2.2Sophocarpine抑制了结肠炎小鼠肠黏膜炎症介质水平 干预组结肠黏膜炎症介质IFN-γ〔(18.56±3.98)pg/mg〕及TNF-α水平〔(23.65±5.10)pg/ml〕显著低于模型组〔(32.69±5.90)pg/ml、(39.53±6.92)pg/ml〕,而IL-10水平〔(31.53±4.87)pg/mg〕显著高于模型组〔(23.65±5.19)pg/mg,P<0.01〕。
2.3Sophocarpine促进了结肠炎小鼠脾及肠系膜淋巴结Treg细胞比例 干预组脾及肠系膜淋巴结Treg细胞比例(7.53%±1.89%、8.95%±1.96%)均显著高于模型组(4.23%±0.79%、5.19%±1.24%,P<0.01)。两组1例样本流式分析。见图2。

图2 两组各1例样本Treg细胞比例
2.4Sophocarpine干预改善了结肠炎小鼠肠屏障功能 干预组肠黏膜紧密连接蛋白ZO-1(1.89±0.26)及claudin-1水平(2.16±0.31)均显著高于模型组(1.00±0.18、1.00±0.16,P<0.01〕;肠屏障通透性实验显示,干预组血清FITC-葡聚糖浓度〔(369.51±89.69)ng/ml〕显著低于模型组〔(852.96±125.30)ng/ml,P<0.01〕。见图3。

图3 两组肠屏障功能检测
2.5Sophocarpine干预抑制了结肠炎小鼠结肠NLRP3炎性小体信号 干预组肠黏膜NLRP3(1.00±0.13)、ASC(1.00±0.12)及Caspase-1水平(1.00±0.14)均显著低于模型组(1.68±0.21、2.16±0.36、2.35±0.38,P<0.01)。见图4。

图4 两组肠黏膜NLRP3炎性小体
3 讨 论
既往IBD属于较为罕见的疾病,而近年来其发病率的迅速攀升已成为消化系统领域的一个棘手问题。我国的IBD诊疗水平尚处于起步与发展阶段,仍然面临诸多问题。导致IBD临床治疗效果不佳的最终因素是发病机制不明确,这使得拮抗结肠炎症成为治疗的关键点〔8〕。当前的治疗药物多以免疫抑制为主,虽然具有一定疗效但却有较多的毒副作用〔9〕。青蒿素在疟疾治疗中取得的巨大成功,启发学术界从植物提取物中发掘有效的免疫调节剂用于治疗IBD。Sophocarpine是一种生物碱,来源于天然植物,具有较高的生物安全性〔3〕。既往研究显示Sophocarpine可以通过下调核转录因子(NF)-κB信号通路从而改善小鼠关节炎〔10〕。也有研究显示Sophocarpine可以通过抑制NLRP3炎症小体而改善系统性红斑狼疮小鼠的肾炎〔10〕。事实上,CD和类风湿关节炎、系统性红斑狼疮具有相似的免疫病理学改变,这些疾病的炎症反应均主要表现为Th1型免疫反应亢进,而Treg细胞比例下降〔11〕。
IFN-γ及TNF-α是Th1、Th17细胞下游重要的促炎介质,在维持IBD肠道慢性炎症及引发炎症级联放大中发挥关键促进作用;而IL-10是机体为数不多的抗炎细胞因子,在平衡局部和系统性炎症反应中发挥重要调控作用〔12,13〕。本文结果提示Sophocarpine在体治疗具有调节肠道局部炎症反应的效果。Treg是一种免疫调节细胞,可抑制过度激活的免疫/炎症反应,在IBD的免疫病理过程中发挥保护性作用;且Treg还具有调节肠道局部Th1、Th17免疫细胞平衡的作用,这一定程度解释了Sophocarpine的抗炎作用途径〔14,15〕。肠屏障功能的破坏导致IBD患者肠黏膜免疫系统直接与肠道内抗原接触,从而引发或维持急慢性肠道炎症,这是经典的IBD发病机制假说之一〔16〕。本研究显示Sophocarpine治疗可显著改善结肠炎小鼠肠屏障结构和功能,这可能是其拮抗肠炎的另一重要途径〔17〕。NLRP3炎性小体在IBD患者肠道炎症反应中扮演重要促进角色,其下游调控IL-1β等多种促炎介质表达,且其抑制Treg细胞〔18,19〕。本文结果提示,Sophocarpine可显著抑制结肠炎小鼠结肠组织内NLRP3炎症小体的水平,这可能是其发挥保护肠道的作用机制之一。由此可见,Sophocarpine可通过影响肠道局部免疫细胞亚群平衡、抑制NLRP3及炎症介质水平发挥肠道炎症保护性作用,但更深入的作用机制仍待明确。
