高糖培养人晶状体上皮细胞创伤后Cyclin D1的表达
2020-10-09赵楠楠符丽君朱振华祝家昌
陈 晨,赵楠楠,符丽君,朱振华,阎 冲,祝家昌,修 皓
0引言
糖尿病性白内障(diabetic cataract)是糖尿病常见的并发症,可导致患者视力障碍。目前我国是全球糖尿病人数最多的国家,2017年糖尿病人数为1.14亿,预计到2045年将达到约1.5亿[1]。晶状体上皮细胞的凋亡是除先天性白内障以外的所有类型白内障发生的共同细胞学基础[2]。晶状体上皮细胞是晶状体内代谢最活跃的部分,该细胞呈单层排列,为晶状体的生长、分化和损伤修复等提供基础物质及代谢能量。一旦正常生理功能被破坏,晶状体纤维排列紊乱,晶状体则出现混浊[3]。糖尿病性白内障的发生与晶状体上皮细胞的凋亡密切相关,研究表明40mmol/L葡萄糖能够显著上调晶状体上皮细胞的凋亡[4],其中细胞周期蛋白D1(Cyclin D1)的表达可影响细胞凋亡。目前认为,在细胞周期进程中,Cyclin D1是G1期细胞周期素,其含量受生长因子等因素的调控,呈周期性变化[5]。本研究在体外不同浓度的高糖条件下培养人晶状体上皮细胞,探究其在创伤后Cyclin D1的表达,揭示Cyclin D1与糖尿病性白内障之间可能存在的关系,为今后研究奠定基础。
1材料和方法
1.1材料实验细胞:人晶状体上皮细胞(HLEB3)购自北纳创联生物技术研究院。主要试剂:DMEM培养基购自Hyclone公司;胎牛血清、胰蛋白酶购自Gibco公司;二甲基亚砜(DMSO)购自Sigma公司;细胞总RNA及总蛋白提取试剂盒购自Magen公司;四甲基偶氮唑(MTT)、逆转录试剂盒、青霉素/链霉素、荧光定量PCR试剂盒、蛋白Marker购自Ferentas公司;特异性引物由天一辉远生物科技有限公司合成;兔源Cyclin D1一抗、山羊抗兔二抗购自Abcam公司;超敏ECL化学发光试剂盒、SDS-PAGE上样缓冲液购自于Biosharp公司;BCA法蛋白定量测定试剂盒购自上海碧云天生物科技有限公司。主要仪器设备:荧光定量PCR仪[(FQD-48A(A4),杭州博日科技有限公司];超微量分光光度计(N50 Touch,德国Implen);凝胶成像仪(ChemiDoc XRS,BioRad);双稳定时电泳仪(DYY-8C,北京六一仪器厂);A2生物安全柜(SG403A-HE,美国BAKER公司);连续波长酶标仪(Epoch,美国Biotek公司)。
1.2方法
1.2.1细胞培养HLEB3细胞复苏后培养于含10%胎牛血清的DMEM培养液中,放入37℃,5%CO2的培养箱中培养,定时观察细胞的生长情况,48h换液1次,当细胞生长接近90%融合时,按1∶3比例传代,取处于对数生长期的细胞用于实验。
1.2.2 MTT法检测细胞增殖活力将处于对数生长期的HLEB3细胞按1×103个/孔密度接种于96孔板,于37℃,5%CO2培养箱中培养24h。待细胞长满后,更换为含有不同终浓度葡萄糖[5.5(对照组)、10.5、15.5、25.5、30.5mmol/L]的培养液,并设空白调零孔,每组设5个复孔,继续培养24h后,在各孔中加入MTT(5mg/mL)10μL,继续培养4~6h。弃去上清液,加入DMSO溶液150μL,低速振荡10min,于全自动酶标仪570nm处读取吸光度值,记录每组调零后的吸光度值,根据每组的平均吸光度值评估细胞在不同葡萄糖浓度下的增殖活力。
1.2.3高糖预处理条件下细胞创伤刺激后Cyclin D1表达情况根据细胞增殖活力的测定结果,本研究最终选用25.5mmol/L葡萄糖浓度作为高糖模型的处理浓度。将处于对数生长期的HLEB3细胞接种于10个培养皿中培养24h,第2d换用含25.5mmol/L葡萄糖的培养基预处理细胞至细胞长满(1~3d)(高糖预处理组),预处理后的细胞分为划伤组(进行划伤处理)和对照组(不进行划伤处理),分别于划伤后0、12、24、48、72h收集细胞并提取细胞总RNA和总蛋白。
1.2.4非高糖预处理条件下细胞创伤刺激后Cyclin D1表达情况将处于对数生长期的HLEB3细胞接种于10个培养皿中培养24h,第2d继续用DMEM培养基培养至细胞长满(1~3d)(非高糖预处理组),换用含25.5mmol/L葡萄糖的培养基,同时将细胞分为划伤组(进行划伤处理)和对照组(不进行划伤处理),分别于划伤后0、12、24、48、72h收集细胞并提取细胞总RNA和总蛋白。
1.2.5 qRT-PCR法检测Cyclin D1 mRNA的表达胰蛋白酶消化细胞后按照试剂说明书提取总RNA,进行cDNA逆转录。将所得cDNA浓度稀释至250ng/μL后进行荧光定量PCR。引物序列:Cyclin D1引物F:CTCGGTGTCCTACTTCAAATGT,R:TCCTCGCACTTCTGTTCCT,该引物来自于NCBI比对结果(NM_053056.2);β-actin引物F:ACCCTGAAGTACCCCATCGAG,R:ACATGATCTGGGTCATCTTCTCG,该引物来自于参考文献[6]。反应体系为25μL:2×SYBGreen Master Mix 12.5μL,正反向引物各1μL,cDNA 1μL,ddH2O补齐至25μL。反应程序采用三步法进行扩增:50℃ 2min;95℃ 15s,58℃ 15s,72℃ 15s,40个循环,每次实验均设3个重复,每个时间点均设3次实验重复以避免偶然因素影响,采用2-ΔΔCt方法计算相对表达量。
1.2.6 Western blot法分析Cyclin D1蛋白表达情况胰蛋白酶消化细胞后按照试剂说明书逐步操作提取总蛋白,采用BCA法测定总蛋白浓度,于-80℃保存。将提取总蛋白进行SDS-PAGE凝胶电泳,转膜至PVDF膜上,5%脱脂奶粉室温封闭1~2h,加入兔抗人Cyclin D1一抗(1∶10000),4℃孵育过夜,PBST冲洗3次后加入山羊抗兔二抗(1∶10000),室温轻微震荡孵育2h,PBST冲洗3次,黑暗条件下加入ECL反应5~15min,在BioRad化学发光凝胶成像系统曝光1~15min,以β-actin为内参。
2结果
2.1不同浓度葡萄糖对细胞增殖活力的影响MTT检测结果显示,一定浓度的葡萄糖会使HLEB3细胞增殖活力增强,其中25.5mmol/L葡萄糖处理HLEB3细胞24h时细胞的增殖活力出现最大值,浓度超过25.5mmol/L葡萄糖处理HLEB3细胞24h细胞的增殖活力下降,故后续实验选择25.5mmol/L葡萄糖培养细胞(图1)。
2.2高糖预处理细胞创伤刺激后形态变化倒置显微镜下观察高糖预处理组和非高糖预处理组细胞在划伤刺激条件下不同时间点的形态变化(图2),结果显示,划伤后0h,划伤处两组细胞形态无明显差别,均呈均匀单层贴壁生长,形态规则,划伤处边缘细胞有少量细胞呈漂浮状,划痕中间无细胞生长。划伤后12、24h,两组细胞形态并无多大差别,划伤处边缘的细胞已经重新贴壁,并开始向外
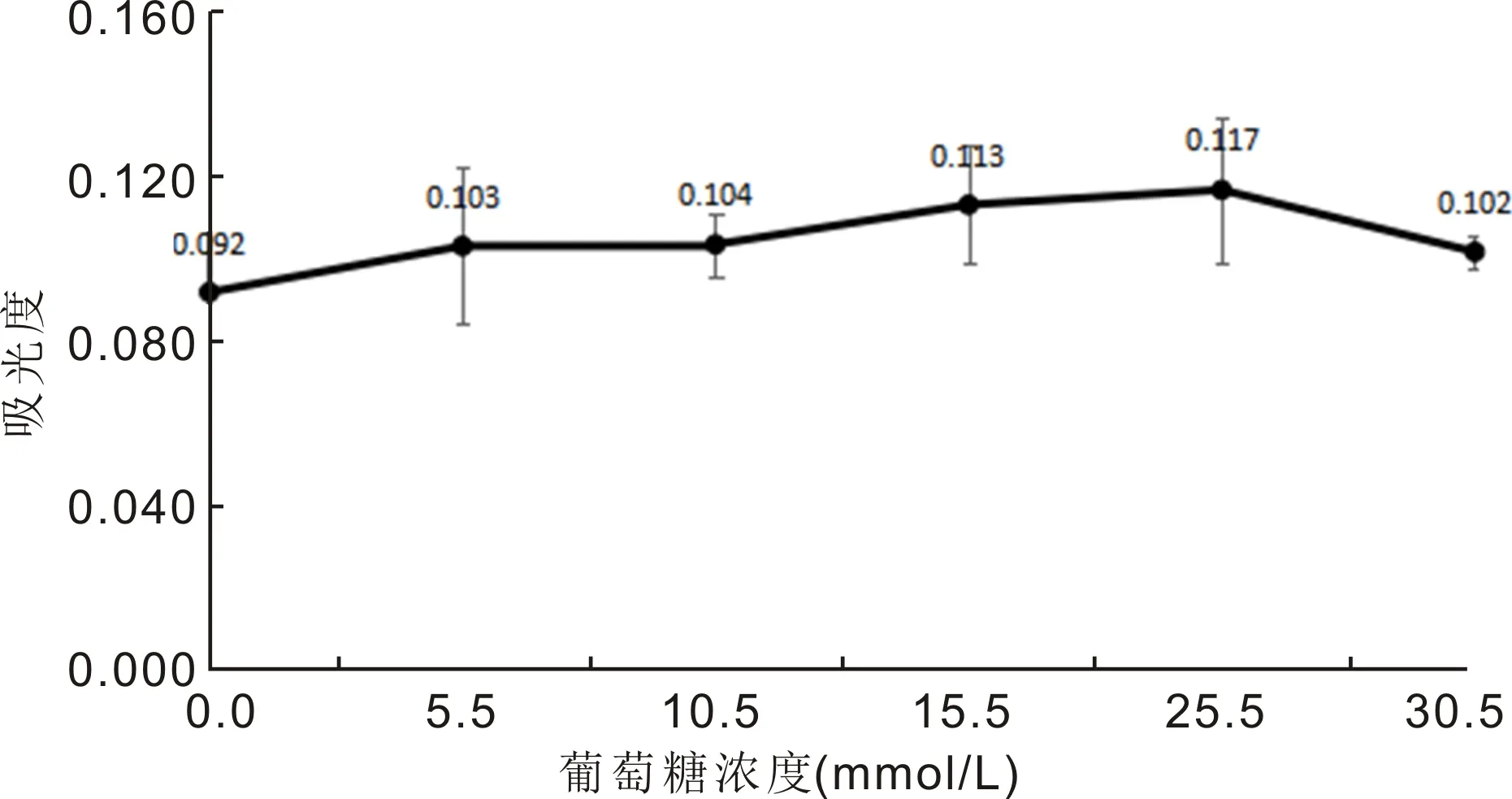
图1 不同浓度葡萄糖对晶状体上皮细胞增殖活力的影响。

图2 倒置显微下观察划伤处理不同时间细胞形态变化(×100)。
表1 高糖预处理组细胞Cyclin D1 mRNA表达情况
生长,划伤处由不平整逐渐趋于平滑,但高糖预处理组细胞数量明显少于非高糖预处理组。随着时间延长,划伤处产生细胞凸起,划痕间距明显缩小。划伤后48h,两组细胞形态有明显差异,非高糖预处理组细胞生长速度明显快于高糖预处理组,细胞数量和细胞凸起明显较多,且划痕间距明显小。划伤后72h,两组细胞形态差异没有划伤48h时明显,但较其他观察时间点划伤边缘处不再平整,细胞凸起要多。总体而言,高糖预处理对HLEB3细胞的生长具有抑制性,特别是在划伤刺激后48h。
2.3高糖预处理组细胞Cyclin D1表达情况对高糖预处理组qRT-PCR数据进行分析,结果显示,对照组和划伤组细胞Cyclin D1 mRNA表达水平差异具有统计学意义(F组间=59.073,P组间<0.001;F时间=35.349,P时间<0.001;F交互=11.162,P交互<0.001)。划伤24、72h时,两组细胞Cyclin D1 mRNA表达水平差异均有统计学意义(t=-10.775、-21.266,均P<0.01)。与划伤0h时比较,对照组划伤后12、24、48h时细胞Cyclin D1 mRNA表达水平差异均有统计学意义(P<0.05);划伤组划伤后48、72h时细胞Cyclin D1 mRNA表达水平差异均有统计学意义(P<0.01),见表1,图3。综上,高糖预处理HLEB3细胞后,随着时间的延长,细胞Cyclin D1 mRNA的表达水平总体呈下降趋势,而划伤处理后24、72h其表达水平明显上调。Western blot检测结果显示,高糖预处理能够明显抑制Cyclin D1蛋白的表达,而划伤刺激在一定程度上可上调Cyclin D1蛋白的表达水平(图4),与qRT-PCR检测结果基本一致,表明高浓度葡萄糖长时间作用能够抑制人晶状体上皮细胞Cyclin D1的表达水平,而划伤处理能够上调Cyclin D1的表达。
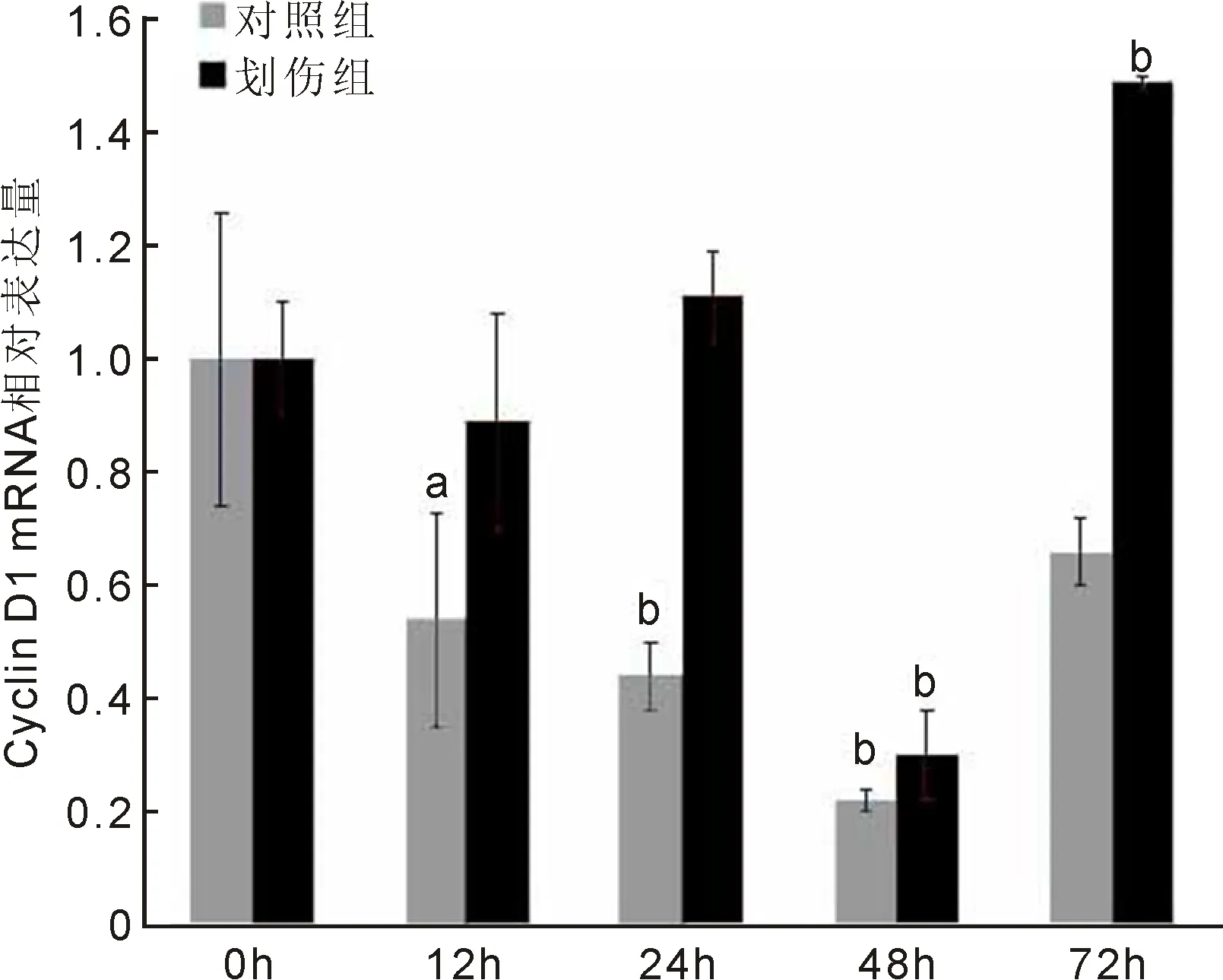
图3 高糖预处理组细胞Cyclin D1 mRNA表达情况 aP<0.05, bP<0.01 vs 同组0h。
2.4非高糖预处理组细胞Cyclin D1表达情况对非高糖预处理组qRT-PCR数据进行分析,结果显示,对照组和划伤组细胞Cyclin D1 mRNA表达水平差异具有统计学意义(F组间=18.707,P<组间0.012;F时间=108.193,P时间<0.001;F交互=16.097,P交互<0.001)。划伤48h时,两组细胞Cyclin D1 mRNA表达水平差异有统计学意义(t=-8.097,P<0.001)。两组划伤后12、48h时细胞Cyclin D1 mRNA表达水平分别与划伤0h时比较,差异均有统计学意义(P<0.01),见表2,图5。综上,未经高糖预处理的HLEB3细胞在进行高糖处理后,随着时间的延长,细胞Cyclin D1 mRNA表达水平呈现出不规律性,在高糖处理12、48h时其表达水平明显上调,而划伤处理后,细胞Cyclin D1的表达总体无明显变化,但划伤48h时其表达水平明显上调。Western blot检测结果(图6)与qRT-PCR检测结果基本一致,表明人晶状体上皮细胞处于高糖环境下的最初一段时间,细胞对Cyclin D1的表达具有一定的自我调控能力,能够通过调控Cyclin D1的表达从而弥补由于高糖环境导致的细胞数量减少,而划伤处理能够上调Cyclin D1的表达。
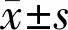
表2 非高糖预处理组细胞Cyclin D1 mRNA表达情况

图4 Western blot检测高糖预处理组细胞Cyclin D1蛋白表达A: 对照组; B: 划伤组。

图5 非高糖预处理组细胞Cyclin D1 mRNA表达情况 bP<0.01 vs 同组0h。
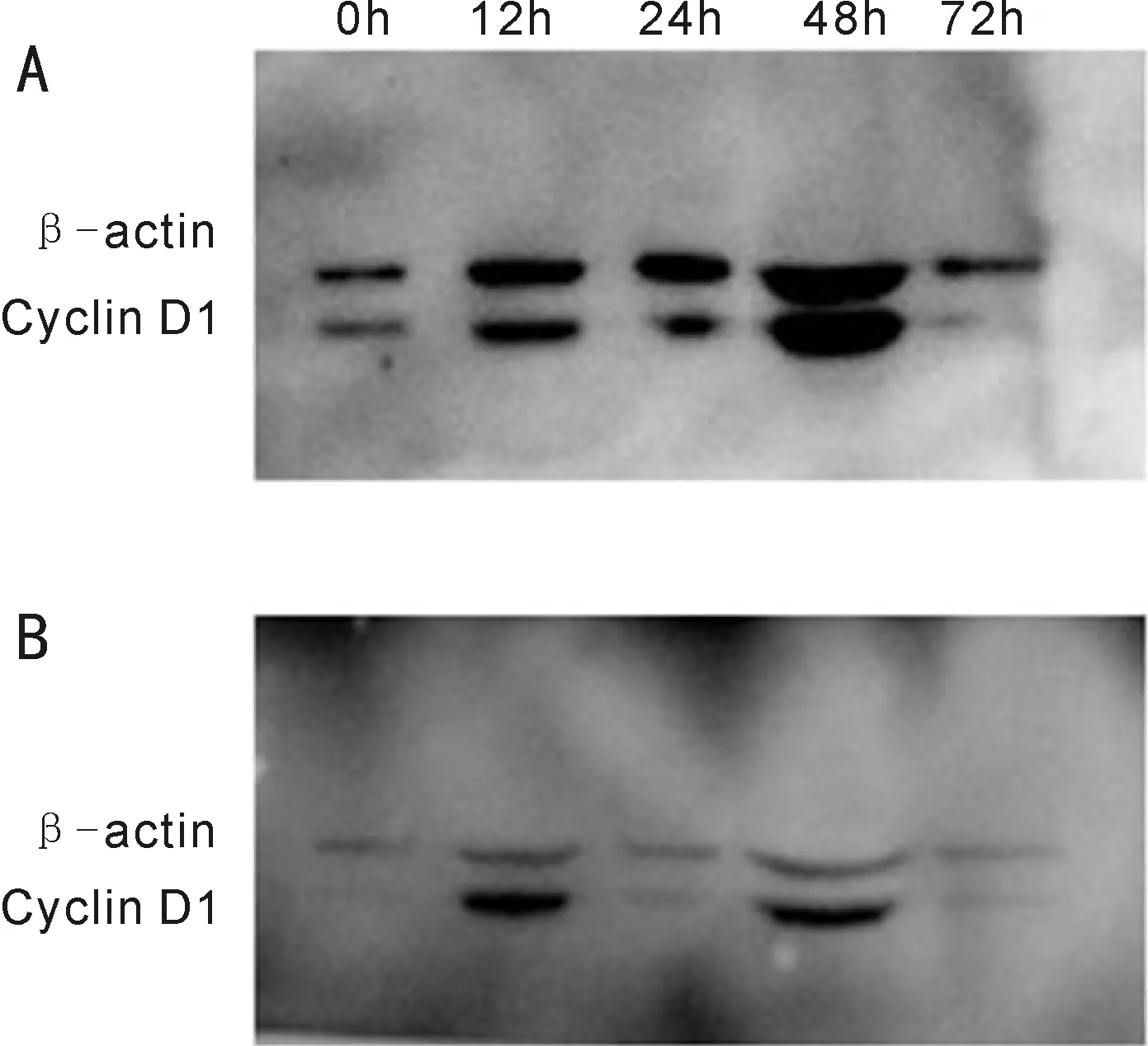
图6 Western blot检测非高糖预处理组细胞Cyclin D1蛋白表达 A: 对照组; B: 划伤组。
3讨论
糖尿病性白内障已成为众多糖尿病眼病并发症中位居第二的并发症[7]。糖尿病性白内障的发病机制有很多,如渗透压改变、晶状体蛋白氧化[8]、晶状体上皮细胞线粒体自噬[9-11]、晶状体细胞周期变化等。有研究表明,高浓度葡萄糖处理晶状体上皮细胞,可以诱导细胞进入细胞分裂,但随着处理时间的延长高浓度葡萄糖对细胞分裂可产生负面影响,从而阻止细胞继续进行有丝分裂[12]。本研究中,MTT检测结果显示,一定浓度的葡萄糖会使晶状体上皮细胞增殖活力增强,且葡萄糖浓度为25.5mmol/L时细胞增殖活力最大,超过该浓度细胞增殖活力下降,本研究结果与赵婷婷等[13]研究结果相符。糖尿病患者往往是在患糖尿病多年后才出现糖尿病性白内障,而以往研究在研究高糖对晶状体上皮细胞影响时并未采用高浓度葡萄糖预处理晶状体上皮细胞来模拟糖尿病患者长期患病导致白内障这一情况。故本研究设置25.5mmol/L葡萄糖预处理组和未用25.5mmol/L葡萄糖预处理组,采用倒置显微镜观察细胞形态发现,高糖预处理组细胞生长速度明显慢于非高糖预处理组,且在划伤刺激后48h特别明显。陈文静等[14]研究表明低浓度的葡萄糖(5mmol/L)即可诱导人晶状体上皮细胞凋亡,本研究结果提示,短暂的高浓度葡萄糖作用会增加晶状体上皮细胞活性,但长期的高糖环境会抑制人晶状体上皮细胞活性,这就解释了为什么糖尿病性白内障往往会出现在糖尿病中后期,而不是前期。
细胞周期受细胞周期蛋白(Cyclin)的调控,其中主要起作用的是Cyclin D1和Cyclin E1。Cyclin D1主要调控节点是G1/S期,Cyclin D1能够激活细胞周期蛋白依赖性激酶,从而使细胞由G1期进入到S期,促进细胞有丝分裂的进行[15]。本研究中,qRT-PCR和Western blot检测结果显示,高糖预处理组人晶状体上皮细胞中Cyclin D1的表达随着处理时间延长总体呈现下调趋势,结果与Chang等[12]报道的高糖处理晶状体上皮细胞对细胞分裂的影响结果基本一致。我们发现,划伤处理能够显著刺激高糖预处理组人晶状体上皮细胞Cyclin D1的表达。同样,我们还发现,划伤处理也能够在一定程度上刺激非高糖预处理组细胞Cyclin D1的表达,但表现出不规律性,其最高表达时间点出现在划伤后48h,这与任洁等[16]研究发现高糖处理晶状体上皮细胞后48h细胞活性最强结果存在一定的相似性。
综上所述,本研究将体外培养的人晶状体上皮细胞分为高糖预处理组与非高糖预处理组,同时每组内又设置划伤组和对照组,观察高糖培养的人晶状体上皮细胞在创伤后Cyclin D1的表达情况,结果证实短暂的高浓度葡萄糖处理人晶状体上皮细胞能够增强细胞活性,上调Cyclin D1的表达,长时间的高糖环境则能够抑制细胞活性,下调Cyclin D1的表达,而划伤处理能够刺激Cyclin D1的表达。但高糖具体如何影响Cyclin D1表达,划伤又是以何种机制调控Cyclin D1表达,尚不清楚,故Cyclin D1能否作为治疗糖尿病性白内障的药物靶点还有待进一步的探究。
