纳米多孔材料中气体吸附与分离的实验设计
2020-10-08鲁效庆魏淑贤王兆杰李邵仁
鲁效庆,魏淑贤,王兆杰,李邵仁
(中国石油大学(华东) 材料科学与工程学院,山东 青岛 266580)
材料多尺度模拟是一项快速发展的新型实验技术,是材料科学研究中的“计算机实验”。利用不同的模型和计算方法可从不同尺度与时域研究材料的结构演化及其与性能的相互关系,从而更好地理解、设计新材料[1]。针对材料不同尺度的微观性能,通常可结合不同计算方法进行分析,例如,在电子结构层次,密度泛函理论(density functional theory, DFT)是有效的计算方法;在模拟分子行为时,则选择分子动力学(molecular dynamics, MD)和蒙特卡罗方法(Monte Carlo,MC)。当前,以计算机硬件为载体,借助模拟软件,运用计算材料学相关理论知识,直观地展示材料微观、宏观结构以及性能信息的模拟手段,不仅在材料研究领域受到越来越多的关注,而且作为一门新型实验教学科目,正逐渐成为材料学本科实验教学体系的重要组成部分[2]。
1 实验设计依据
目前缓解温室气体排放的有效技术中,关键性问题是针对固定碳源点的低浓度、高流速CO2开发具有较高捕获与分离效率的吸附分离材料[3]。金属有机骨架(MOFs)因其具有超高孔隙率、可调孔径、功能位点丰富、比表面积大等优点,被认为是潜在的低压低浓度下CO2吸附和分离的理想材料,如MOF-5[4]、HKUST-1[5],以及具有不同孔径的SIFSIX-2-X[6]和开放金属位点的M-MOF-74[7-9]。
MFM-300 是具有独特一维孔隙的MOFs 材料,由两个顺式μ2-OH 基团连接成 [InO4(OH)2] 八面体,如图1 所示。该构型具有柱形通道,-OH 基团排列在孔道周围,赋予孔隙环境较高的客体-主体选择性。

图1 MFM-300 结构沿a 轴的侧视图和沿c 轴的俯视图
Savage 等人[10]通过原位中子粉末衍射研究了MFM-300(In)中H2和CH4分子的结合位点,观察到-OH 基团是最优的结合位点,并且在195 K 时对CH4的体积吸附量(单位体积吸附剂吸附的气体体积数)为201。同时他们也研究了MFM-300(In)中有害气体SO2和N2、CO2的混合吸附分离,发现在平衡状态下0.0~1.0 bar 之间存在陡峭的SO2吸附曲线,并且吸附量高达8.2 mmol/g,对SO2/N2和SO2/CO2两种混合气体的选择性分离研究,则分别获得5000 和43的选择吸附比[11]。
虽然相关实验提供了有关MFM-300 材料中气体吸附分离特性,但认识不同金属中心对气体吸附的影响具有重要意义,同时通过对比不同金属中心差异化影响,可以提高学生对金属中心配位的认识,了解气体吸附作用机理。
本实验项目以理论计算实验为手段,选取MFM-300 材料为研究对象,通过对结构金属中心进行设计,辅以可视化的计算手段,系统研究MFM-300 的吸附分离特性,同时提供一种有助于学生设计吸附分离实验的思路和手段。
2 实验内容设计
整体的实验设计方案包括实验目的、实验原理、实验所需软件、实验内容及实验结果与讨论等,其中实验内容按照“模型构建—计算模拟—数据处理—分析总结”的步骤实施,是整个实验最为关键的部分。
模型构建是计算模拟的基础,需依据研究对象的实验数据和研究目的进行。实验选定MFM-300(In)作为基础模型,通过替换不同金属中心以及三嗪基取代MFM-300(In)中的苯基构建模型(见图1)。
计算参数选择是计算模拟的关键,需兼顾计算精度和计算效率。本实验项目所有模型都采用2×2×2的周期性结构,并使用Forcite 模块进行优化。TraPPE力场[12]用于描述气体分子。CO2和N2采用由Potoff和Siepmann 开发的刚性线性3 位模型,带有3 个电荷和LJ 相互作用位点[13-14],CH4采用5 位模型。整个计算过程中考虑了LJ 相互作用和静电相互作用来计算总的相互作用,原子布局电荷采用ChelpG 电荷,通过B3LYP 结合LANL2DZ(对于In、Al 和Ga 原子)和6-31+G(d)(对于其他轻质元素)进行结构优化获得。用GCMC 计算MFM-300(In、Al、Ga 和In-3N)中单组分和二元混合组分的吸附。通过Peng-Robinson方程[15]得到单组分和二元组分气体的密度和逸度。为了使学生更好地了解温度效应的影响,GCMC 模拟过程设定了273 K、298 K、313 K 和373 K 共4 个温度。
3 结果与讨论
3.1 孔隙结构
孔隙结构在多孔材料吸附和分离能力方面有重要作用。清楚了解孔隙结构特性有助于学生认识气体分子在孔道中吸附作用位点,以及不同气体分子在孔道中的排列吸附情况。因此,本实验首先分析了可及孔隙体积VPc、孔隙限制直径DL、最大孔径DM、比表面积、密度和孔隙率Φc 等特性,从而全面评估孔隙结构,如表1 所示。

表1 MFM-300(In、Al、Ga 和In-3N)框架的物理特性
结果表明,不同的金属中心和N 改性对其孔隙结构有一定影响,MFM-300(In)具有相对较大的密度(1.33 g/cm3)和孔径DL(7.38 Å),但相比于MFM-300(Al)和 MFM-300(Ga)具有更低的比表面积(1104.18 m2/g)。通过与实验数据对比,发现MFM-300(In)的比表面积和孔径与在77 K 下由N2吸附等温线得到的1071 m2/g 和7.5 Å 基本一致[11]。MFM-300(Al)的计算结果为1340.69 m2/g 和6.98 Å,这与1370 m2/g 和6.5 Å 的实验结果基本一致[16]。MFM-300(In-3N)的框架具有相对较大的比表面积1174.54 m2/g,但N 改性对MFM-300(In-3N)的影响较小。MFM-300 结构的孔隙率范围处于 46.67%~51.74%,具有以下顺序:MFM-300(In-3N)>MFM-300(In)>MFM-300(Ga)>MFM-300(Al),其可及孔隙体积为0.37~0.44 cm3/g。
通过对孔隙特性的计算与分析,使学生清晰认识MFM-300 的孔隙特性,同时基本掌握多孔材料的评估方法和手段。
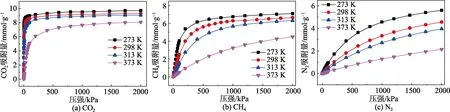
图2 MFM-300(In)在273 K、298 K、313 K 和373 K 下的绝对吸附等温线

图3 MFM-300 在298 K 下的绝对吸附等温线
3.2 单组分CO2、CH4 和N2 吸附分析
吸附量是指在一定温度及压强下,单位吸附剂中捕获气体的总量。吸附量与吸附剂的比表面积、孔隙大小、孔径分布、分子极性及吸附剂分子上官能团性质等有关,是评估多孔材料吸附存储能力的重要参数。
通过GCMC 模拟计算可评估MFM-300 材料对CO2等气体的吸附能力。图2 展示了MFM-300(In)在273 K、298 K、313 K 和373 K 温度下CO2、CH4、N2单组分气体的绝对吸附等温线,图3(a)、3(b)、3(c)为4 种MFM-300 材料在298 K 下的绝对吸附等温线。图3(d)、3(e)、3(f)为横坐标采用对数方式绘制的结果,以清楚地显示四种不同结构在低压下气体吸附的变化特征。
从图中可以明显地看到,MFM-300(In)在273~373 K 下对单组分气体的吸附等温线表现出典型的I型吸附等温线,证实了MFM-300(In)的微孔吸附剂特征。对于MFM-300(In)材料我们可以看到以下结果:(1)单一组分的CO2,CH4和N2的吸附量随着温度的升高而降低;(2)在相同温度和压力下,CO2吸附量大于CH4和N2吸附量;(3)MFM-300(In)中单组分气体的饱和吸附量遵循CO2>CH4>N2顺序,达到饱和的压力则为CO2<CH4<N2。
在273 K、298 K、313 K 和373 K 温度下,CO2的吸附量为3.1~9.1 mmol/g,优于当前大多数MOFs材料[17]。在273~373 K 和1.0 bar 下,CH4和N2的吸附量分别为0.4~4.0 mmol/g 和0.2~1.0 mmol/g。在图2(a)中,其CO2的吸附量在低压下突然增加,能够在298 K 和1.0 bar 时达到8.0 mmol/g,这一吸附量与优异的CO2捕获材料Mg-MOF-74 在296 K 和1.0 bar条件下的吸附量(8.0 mmol/g)相当。MFM-300(In)和 Mg-MOF-74 都具有相似的一维孔隙,其中Mg-MOF-74 中的开放金属位点与MFM-300(In)中均匀的μ2-OH 官能团在吸附过程中发挥了同样的重要作用——为CO2分子提供强结合位点。因此,这两种MOFs 在低压下都具有优异的CO2吸附性能。这种在具有合适孔径尺寸的一维孔道材料中进行功能化吸附位点修饰的MOFs,为低压下气体的吸附提供了有力的保证。
图4 为在饱和压力下MFM-300(In)中吸附气体的照片,图5 为298 K 和10 bar 下MFM-300(In)的CO2吸附密度视图。从图4 可以看到,CO2分子紧密地填充在圆柱形通道中,而CH4和N2分布相对松散。此外,在图5(a)中,CO2在-OH 位点周围具有规则的吸附密度分布,该结果与图4(a)中所示的结果一致。在图5(b)的侧视图中,CO2分子沿着一维孔与间隔-OH基团相互作用,并且当省略框架时(见图5(c)),可以更加清晰地看到吸附密度位点呈螺旋上升的状态。

图4 在饱和压力下MFM-300(In)中吸附气体的照片

图5 298 K 和10 bar 下MFM-300(In)的CO2 吸附密度视图
在图3 中,MFM-300(Al)、MFM-300(Ga)和MFM-300(In-3N)在298 K 和0.1 bar 下的CO2吸附量分别为4.6 mmol/g、2.4 mmol/g 和0.96 mmol/g,明显小于MFM-300(In)7.0 mmol/g 的CO2吸附量。在298 K 和0.1bar 下,MFM-300(A1)、MFM-300(Ga)和MFM-300(In-3N)的CH4和N2的吸附量分别为0.46 mmol/g、0.30 mmol/g 和 0.96 mmol/g 以及0.09 mmol/g、0.06 mmol/g 和0.04 mmol/g。在图3(d)、3(e)和3(f)中,CO2和N2在298 K 和0.1 bar 条件下的吸附量顺序为 MFM-300(In)>MFM-300(A1)>MFM-300(Ga)>MFM-300(In-3N),而CH4的吸附量遵循MFM-300(In-3N)>MFM-300(A1)>MFM-300(Ga)>MFM 300(In)的顺序。显然,MFM-300(In)比MFM-300(Al、Ga)在低浓度环境(如密闭空间和大气环境)中具有更高的CO2捕获效率。
通过吸附量的分析。能够使学生清楚地认识到所研究材料的吸附能力和容量水平,对当前多孔材料吸附研究有了更深的认识。
3.3 二元混合气体竞争吸附分析
除了相对较高的吸附量,CO2相对于N2和CH4的选择性是描述纳米多孔材料的捕获和分离性质的重要标准,其定义为:

其中SA/B表示气体A 对B 的选择性,xA和xB分别是吸附相中气体A 和B 的摩尔分数;yA和yB分别是自由相中相应的摩尔分数。
整个模拟过程中,为更加真实地模拟燃烧过程中烟道气组分的实际状况,设定CO2和CH4的摩尔分数为50∶50,CO2和N2的摩尔分数为15∶85。
图6 显示了MFM-300 在298 K 下CO2/N2和CO2/CH4的选择性。MFM-300(In)中CO2/N2的选择性在298 K 平衡状态下达到300,接下来依次是MFM-300(A1)、MFM-300(Ga)和MFM-300(In-3N)。在图6(a)中,CO2/N2的选择性在0~100 kPa 的低压力环境下急剧增加,且在600~1000 kPa 的压力下逐渐恒定。相对于N2,CO2的较大极化率使CO2在初始吸附时快速吸附在MFM-300 中的金属中心和-OH 吸附位点上。此外,CO2的分子动力学直径(0.33 nm)小于N2分子动力学直径(0.36 nm),在一维MFM-300 孔道中CO2将优先占据有利的吸附位点,随着吸附过程的进行,CO2分子对吸附力相对较弱的N2分子也具有一定排斥作用,导致了选择性的升高。
CO2/CH4选择性的变化与CO2/N2类似,但4 种MFM-300 材料中 CO2/CH4的选择性差异较大,MFM-300(In)中CO2/CH4的选择性在平衡状态下约为120,是MFM-300(Al)、MFM-300(Ga)和MFM-300(In-3N)的4 倍。
在图6 中,MFM-300 与一些纳米多孔材料选择吸附比“下降”变化趋势有很大不同,其中CO2/N2和CO2/CH4在低压下表现出明显的“上升”型选择性。这种低压变化趋势的差异主要归因于孔径效应。通常,“上升”型选择性是由具有强气体吸附能力的孔和相对有限的空间产生的,该空间中仅仅可以容纳单层气体分子。当提供较小的孔道空间时,框架双层壁和气体分子之间的相互作用增强了对气体分子的吸附能力。如表1 所示,4 种MFM-300 材料都具有这种限制性圆柱形通道(6.98~7.56 Å),从而为CO2-CO2和CO2-双壁提供了更多可能的相互作用。相比之下,当在相对大的孔中超过两层吸附时,将出现“下降”型选择吸附比。扩展的空间弱化了骨架与强极性气体在其平衡/或自由相之间的相互作用,从而降低了强极性气体对其他气体的选择性。

图6 298K 下MFM-300 中CO2 相对于N2 和CH4 的选择吸附比
通过竞争吸附的分析,能够使学生更加清楚地认识到,在多孔材料中,不同气体分子间的竞争吸附关系,加深他们对吸附作用的理解。
3.4 吸附热分析
吸附热是指吸附过程产生的热效应。在吸附过程中,气体分子移向固体表面,其分子运动速度会大大降低,因此释放出热量。为了让学生更好地理解不同分子吸附作用的强弱,在图7 中给出了CO2、CH4和N2的吸附热Qst。

图7 MFM-300 材料在298 K 下CO2、CH4 和N2 的吸附热
在图 7(a)中,平衡状态下在 MFM-300(In)、MFM-300(A1)、MFM-300(Ga)和MFM-300(In-3N)中CO2吸附热分别为48.87 kJ/mol、42.49 kJ/mol、40.03 kJ/mol 和35.92 kJ/mol。在1.0 bar 时,CO2吸附热遵循MFM-300(In)>MFM-300(A1)> MFM-300(Ga)>MFM-300(In-3N)的顺序,与图3(d)中所示CO2吸附量保持一致。图7(b)、7(c)中CH4和N2的吸附热表现出与图7(a)中的CO2类似的趋势。在平衡状态下,MFM-300(In)、MFM-300(Al)、MFM-300(Ga)和 MFM-300(In-3N)中 CH4的吸附热分别为25.42 kJ/mol、28.26 kJ/mol、26.32 kJ/mol 和23.11 kJ/mol,N2的吸附热分别为 18.48 kJ/mol、18.49 kJ/mol、17.37 kJ/mol 和15.71 kJ/mol。总之,在MFM-300 中,吸附热遵循CO2> CH4> N2的顺序,与平衡状态下的吸附量顺序一致。
为更好地理解CO2与N2/CH4之间的吸附热差ΔQst对选择性的影响,图8 给出了同种结构中不同气体吸附热差值和选择性的关系。

图8 MFM-300 在298 K、0.8 bar 下吸附热差与CO2/N2 和CO2/CH4 选择性的关系示意图
显然,较大的吸附热差值ΔQst对应于相对较大的选择性。例如,MFM-300(In)、MFM-300(A1)、MFM-300(Ga)和MFM-300(In-3N)的ΔQst(CO2-N2)在0.8 bar 下从33.18 kJ/mol、25.81 kJ/mol、23.99 kJ/mol降至20.59 kJ/mol,与CO2/N2的选择性153.15、94.59、90.85 和48.37 保持良好的一致性。同样,ΔQst(CO2-CH4)在0.8 bar 下从29.94 kJ/mol、19.18 kJ/mol 和17.8 kJ/mol降至15.63 kJ/mol,与CO2相对于CH4的选择性85.98、16.18、11.35、8.21 保持一致。同样在298 K,0.2、2.0、6.0 bar 下CO2与N2/CH4之间吸附热差ΔQst和选择性吸附比具有类似趋势。因此,为了提高吸附材料的选择性能,扩大目标气体和混合气体之间的吸附热差是设计开发具有较高选择性分离性能材料的有效策略。
4 实验内容拓展
本实验属于计算材料学研究型实验,从具体实验结果出发建立计算模型,综合计算结果进行理论分析,获得与实际相吻合的结论或合理的推论。运用该实验理论方法和模拟手段,可将实验内容依据理论方法和计算体系进行如下拓展。
(1)针对具有一维孔道MFM-300 金属有机骨架进行孔道优化设计,并根据配体多样性特点进行配体优化设计,使学生更加清晰地认识多孔材料孔径大小对气体分离的作用。
(2)采用不同金属中心和配体链多样化设计结构,分析不同结构下气体吸附分离的差异化性能,提高学生根据性能设计结构的创新能力。
(3)运用上述理论研究方法对不同材料(如COF、纳米多孔碳等)进行分析研究,强化学生对不同材料吸附分离性能认识的深度。
该拓展体系(见图9)可作为不同实验内容进行课堂教学,也可引导学生进行课外实验拓展,并可作为大学生创新项目,以课堂实验为基点进行自主创新,培养学生发现和解决问题的能力。

图9 实验拓展结构示意图
5 结语
本实验设计将教师科研成果转化为学生综合研究型实验,通过 GCMC 模拟,系统研究了多孔材料MFM-300(In、Al、Ga 和In-3N)中CO2、N2、CH4等三种气体的捕获和分离。结果表明,低压下,CO2吸附量遵循MFM-300(In)>MFM-300(A1)>MFM-300(Ga)>MFM-300(In-3N)的顺序,且展现出明显的“上升”型选择性,而不同气体吸附热差越大,选择性则越大。
教学实践表明,将气体吸附分离计算研究引入当前教学实验,有助于研究型实验教学的发展及理论与实验的结合,有助于加强学生对理论知识的理解,同时有助于培养学生的创新意识和科研能力。
