两株南海真菌Aspergillus aculeatus 1 P1和Paraconiothyriumcyclothyrioides1 I2的次级代谢产物研究
2020-10-05韩清华谢兴林田晓清樊成奇
韩清华,谢兴林,田晓清,李 涵,樊成奇
(1.中国水产科学研究院东海水产研究所,农业农村部远洋与极地渔业创新重点实验室,上海 200090;2.中山大学药学院,广州 510006)
海洋微生物主要包括生活在海水、海洋沉积物中的微生物及与海洋动植物共附生的微生物,是复杂动态的海洋生态系统中一个独特、重要的组成部分,在海洋的物质循环、能量流动、生态平衡、环境净化中承担着重要的角色,对于维持海洋系统的功能、物种及群落多样性的演化具有不可替代的作用。而在海洋生态系统漫长的演化过程中,海洋微生物形成了独特和多样的机制来适应高压、黑暗、高盐、低温和寡营养等严酷的生存环境,从而进化出基因型、代谢途径和生理生态功能的多样性,成为地球上最丰富和最重要的战略资源。据估计海洋微生物物种达2~10亿种,具有陆生微生物所无法比拟的生态群落结构多样性和物种多样性[1]。因此,对海洋微生物资源的利用与开发已成为当今国内外研究的热点领域[2]。海洋真菌次级代谢产物是海洋微生物代谢产物的主要来源,从2010年起,海洋真菌中发现的新的次级代谢产物占海洋微生物的比例超过50%,约占海洋天然产物的三分之一[3],其中活性化合物超过50%。表明海洋真菌是发现新化合物、开发海洋药物的重要来源。
南海海域辽阔,面积约350万km2,平均水深约1 212 m,最深处5 559 m;其中,属于我国的部分约210万km2[4]。南海海洋生物资源种类繁多,有藻类(红藻、褐藻、绿藻)、海绵动物、腔肠动物、软体动物、棘皮动物、被囊动物、苔藓虫类、微生物等;南海海洋生物量大,前期从南海海洋生物中发现许多结构特异的次生代谢产物,如萜类、生物碱、糖类、脂类和甾体等,这些化合物不仅结构类型特殊,而且具有抗肿瘤、抗菌、抗病毒、抗心血管病、抗氧化、神经生长与功能调节等活性,有望开发成新一代的海洋药物。
真菌作为南海海洋环境中一个重要的微生物类群,因其代谢产物结构和活性多样、创新指数高、成药性强、产量大等特点,近年来倍受研究者关注,已成为海洋天然产物研究的热点[5],然而关于南海真菌活性次级代谢产物的相关研究起步较晚,且研究对象多集中在深海来源真菌、红树林内生菌、海绵、珊瑚及海星共附生真菌等[6-11],对南海近海的渔业捕捞区域中的真菌及其代谢产物的研究较少,因此对该区域的研究将为丰富南海真菌资源多样性、发掘结构新颖的活性代谢产物提供基础。本课题组前期从位于南海上川岛沙堤渔港南32 km处表层海水中分离筛选到100多株真菌资源,并对其中部分菌株进行蛋白磷酸酶活性筛选,结果表明其中部分菌株具有较好的蛋白磷酸酶活性。本研究拟通过对两株活性较好的潜在菌株Aspergillusaculeatus1 P1和Paraconiothyrium cyclothyrioides1 I2的次级代谢产物进行初步研究,分析其活性潜能,以期为南海真菌资源的进一步开发利用提供参考。
1 材料与方法
1.1 材料与试剂
生物材料:海水采自2018年6月12日南海上川岛沙堤渔港南32 km处(水深0.5 m),站位112°42′E、21°19′N,冷藏保存运输至实验室。
微生物鉴定材料:真菌DNA小剂量快速提取试剂盒(上海生工生物公司);18S引物(上海美吉生物公司);PCR扩增体系(康为世纪)。
色谱填料和试剂:HP 20大孔吸附树脂(Mitsubishi Chemical Ltd,Japan);凝胶Sephadex LH 20(Pharmacia Biotech,Sweden);预制GF254 TLC硅胶板(青岛海洋化学公司);液相用乙腈、甲醇(色谱级,Tedia,USA);其余溶剂均为分析纯(AR,上海国药集团)。
分离培养基:孟加拉红固体培养基(葡萄糖10.0 g,蛋白胨5.0 g,磷酸二氢钾1.0 g,硫酸镁0.5 g,琼脂20.0 g,1/3000孟加拉红溶液100 mL,陈海水1 000mL)[12];PDA固体培养基(马铃薯200.0 g,葡萄糖10.0 g,琼脂18.0 g,陈海水1 000 mL);YPD固体培养基(酵母膏10.0 g,蛋白胨20.0 g,葡萄糖20.0 g,琼脂18.0 g,陈海水1 000 mL)。用于分离菌株时每种培养基添加氯霉素和萘啶酮酸各30 U·mL-1,pH 6.0~6.5[13]。发酵培养基:YPD液体培养基。
1.2 仪器
高压灭菌器:上海申安医疗器械厂,LDZX 75KBS型;电热恒温鼓风干燥箱:上海一恒科技有限公司,DHG 9123A型;微生物恒温培养箱:上海一恒科技有限公司,DHP 9162A型;高速微量离心机:上海生工生物有限公司,HICO 21型;PCR仪:杭州朗基科学仪器有限公司,AG 22331型;凝胶成像系统:上海天能科技有限公司,GIS 1600型;酶标仪:TECAN,SPARK 10M型;半制备HPLC系统:Shimadazu,LC 20AT pump,SIL 20A auto sampler,SPD M20A PDA detector;NMR:Bruker,AM 400 spectrometer(TMS内标);UPLC MS:Agilent,1290 HPLC 6224 TOFMS。
1.3 共附生微生物的分离和培养
1.3.1 菌株的分离
将海水样品过滤,滤纸剪碎后放至装有10 mL无菌水的50 mL无菌离心管内,震荡混匀后静置于4℃冰箱过夜。将样品悬液进行10-1、10-2、10-3的梯度稀释,每个梯度分别取100μL涂布于孟加拉红、PDA和YPD固体培养基上,将平板放于27℃培养箱中倒置培养[14]。培养约1~2周后长出菌落,根据颜色、形态等特征挑取差异较大的菌落,接种至相应新鲜培养基上继续分离培养。最终得到的菌株保存于YPD斜面培养基,编号并置于4℃冰箱备用。
1.3.2 18S rDNA ITS序列分析
将真菌液体发酵液减压抽滤浓缩得菌丝体,取适量菌体于研钵中,加液氮充分研磨至粉末状[15]。使用真菌DNA小剂量快速提取试剂盒提取真菌基因组DNA,并于-20℃保存备用。采用18S EF3:TCCTCTAAATGACCRAGTTTG和18S EF4:GGAAGGGRTGTATTTATTAG,扩增真菌18S rDNA ITS序列。
PCR扩增体系为50μL:2×PCR MasterMix 25μL,引物各2μL,模板DNA 5μL,重蒸水16 μL。扩增程序:94℃预变性5 min,94℃变性30 s,56℃退火30 s,72℃延伸1 min,共35个循环,最后72℃延伸10 min[16]。取5μL PCR扩增产物经质量分数为1%的琼脂糖凝胶,100 V电泳30 min,检测DNA大小,然后用凝胶成像分析系统拍照。提取的基因组DNA于-20℃保存,统一送上海美吉生物科技有限公司测序。所测结果在NCBI网站比对并进行种属归类,结合相关文献选择编号为1 P1(Aspergillusaculeatus1 P1)和1 I2(Paraconiothyriumcyclothyrioides1 I2)的两株真菌进行代谢产物研究。
1.4 1 P1和1 I2菌株中化合物分离纯化
1.4.1 菌株发酵培养
配制2瓶800 mL YPD液体培养基,置于2 L三角瓶中,121℃高温灭菌30 min,再分别接入经过活 化 培 养 的1 P1和1 I2菌 株,20°C、160 r·min-1进行摇床发酵培养,5 d后得到种子发酵液。将1 P1菌株种子液按一定比例接种于含有0.75 L YPD液体培养基的2 L三角瓶中,在20℃、160 r·min-1分3批进行摇床发酵培养,每批发酵培养10~15 d;将1 I2菌株种子液按一定比例接种于含有0.75 L马丁氏液体培养基(KH2PO4:1g,MgSO4·7H2O:0.5 g,蛋白胨:5 g,葡萄糖:5 g)的2 L三角瓶中,在20℃、160 r·min-1分3批进行摇床发酵培养,每批发酵培养10~15 d,两株菌均得到约60 L发酵液。
1.4.2 1 P1中化合物的提取分离
菌株1 P1的发酵液经抽滤得到菌丝体,菌丝体置于-80℃冰箱中冷冻,然后取出自然解冻破壁,依次加入2 L的丙酮和甲醇进行超声破碎,分别提取3次,提取液减压低温浓缩除去有机溶剂,合并提取液并蒸干。浓缩后的浸膏加1.5 L纯水溶解充分,然后分别用石油醚、乙酸乙酯、正丁醇各萃取3次,得到相应的石油醚(9.2 g)、乙酸乙酯(2.9 g)和正丁醇萃取物(22.6 g)。
1 P1的乙酸乙酯部分经Sephadex LH 20凝胶柱层析分离,氯仿∶甲醇为1∶1进行洗脱,得到Fr.1~Fr.5共5部分,将Fr.2经HPLC反复进样制备(流动相∶乙腈-0.1%三氟乙酸 水)得到化合物5(9.1 min)、6(13.2 min)、1(24.5 min);将Fr.4经HPLC反复进样制备(流动相:乙腈-0.1%三氟乙酸 水)得到化合物10(14.7 min)、11(27.7 min)、9(12.4 min);将Fr.3经HPLC反复进样制备(流动相:乙腈-0.1%三氟乙酸 水)得到化合物7(14.0 min)和8(29.8 min)。1 P1的石油醚部分经正相硅胶柱进行分离,分别用氯仿∶甲醇为100∶1、80∶1、60∶1、40∶1、30∶1、20∶1、10∶1的梯度洗脱,得到Fr.Ⅰ~Fr.Ⅴ共5部分,将Fr.Ⅲ经HPLC反复进样制备(流动相∶乙腈-0.1%三氟乙酸 水)得到化合物2(21.5 min);将Fr.Ⅴ经Sephadex LH 20凝胶柱层析分离,氯仿∶甲醇为1∶1进行洗脱,得到化合物3和4。
1.4.3 1 I2中化合物的提取分离
菌株1 I2的发酵液经抽滤得到菌丝体,菌丝体置于-80℃冰箱中冷冻,然后取出自然解冻破壁,依次加入2 L的丙酮和甲醇进行超声破碎,分别提取3次,提取液减压低温浓缩除去有机溶剂,合并提取液并蒸干。浓缩后的浸膏加1.0 L纯水溶解充分,然后分别用石油醚、乙酸乙酯、正丁醇各萃取3次,得到相应的石油醚(12.5 g)、乙酸乙酯(814 mg)和正丁醇萃取物(15.0 g)。
将1 I2的石油醚部分经正相硅胶柱进行分离,分别用氯仿∶甲醇为100∶1、60∶1、40∶1、30∶1、20∶1、10∶1、5∶1、1∶1的梯度洗脱,得到Fr.A~Fr.F共6部分,将Fr.C经Sephadex LH 20凝胶柱层析分离,氯仿∶甲醇为1∶1进行洗脱,得到化合物12;将Fr.B经正相硅胶柱进行分离,用石油醚:丙酮为30∶1洗脱,得到化合物14;将Fr.E经HPLC反复进样制备(流动相∶乙腈-0.1%三氟乙酸 水),得到化合物16(18.5 min)、17(19.4 min)和15(21.2 min);将Fr.F经反相硅胶柱进行分离,甲醇 水进行洗脱,得到化合物13。
2 结果与分析
2.1 测序结果
2株菌株送样均测序拼接成功。将上海美吉生物医药科技有限公司所测结果在NCBI网站比对,种属归类如表1。
2.2 真菌1 P1、1 I2化合物的结构鉴定
2.2.1 1 P1中次级代谢产物的结构鉴定
化合 物1:白 色 无 定 形 粉 末,1H NMR(CD3OD,600 MHz)数据如下:4.25(1H,d,J=7.8 Hz),4.11(1H,d,J=10.8 Hz),3.85(1H,dd,J=12.9,2.1 Hz),3.75(1H,s),3.62(1H,dd,J=9.0,7.8 Hz),3.53(1H,d,J=3.6 Hz),3.39(1H,d,J=10.8 Hz),2.17(1H,dd,J=6.9,3.6 Hz),1.21(3H,s),1.18(3H,s),1.00(6H,d,J=7.8 Hz),0.94(6H,d,J=10.8 Hz),13C NMR(CD3OD,125 MHz)数据如下:39.7(C 1),28.6(C 2),81.2(C 3),43.5(C 4),57.2(C 5),19.8(C 6),34.0(C 7),41.2(C 8),48.9(C 9),37.1(C 10),24.9(C 11),123.5(C 12),145.1(C 13),42.7(C 14),27.3(C 15),28.3(C 16),40.0(C 17),45.3(C 18),48.0(C 19),37.8(C 20),76.8(C 21),93.4(C 22),23.2(C 23),65.3(C 24),16.5(C 25),17.3(C 26),27.0(C 27),23.2(C 28),31.3(C 29),21.3(C 30),108.8(C 1′),73.9(C 2′),75.3(C 3′),70.2(C 4′),67.7(C 5′),以上波谱数据与文献[17]报道的数据一致,因此鉴定化合物为kudzusaponin SA4。
化合 物2:白 色 无 定 形 粉 末,1H NMR(CDCl3,600 MHz)数据如下:5.25(1H,d,J=3.6 Hz),3.45(1H,d,J=4.5 Hz),1.11(3H,s),1.04(3H,s),0.94(3H,s),0.91(3H,s),0.90(3H,s),0.87(3H,s),13C NMR(CDCl3,125 MHz)数据如下:38.5(C 1),26.0(C 2),80.9(C 3),42.2(C 4),56.0(C 5),18.6(C 6),33.2(C 7),39.8(C 8),47.8(C 9),37.5(C 10),23.9(C 11),122.4(C 12),144.0(C 13),42.8(C 14),28.3(C 15),27.7(C 16),36.8(C 17),44.9(C 18),46.3(C 19),30.6(C 20),41.6(C 21),76.7(C 22),22.5(C 23),64.6(C 24),16.3(C 25),17.0(C 26),25.5(C 27),29.8(C 28),32.9(C 29),20.1(C 30),以上波谱数据与文献[18]报道的数据一致,因此鉴定化合物为大豆皂醇。
化合物3:白色无定形粉末,1H NMR(Pyr,600 MHz)数据如下:δH5.74(1H,brs),5.26(1H,dd,J=15.3,7.5 Hz),5.19(1H,dd,J=15.0,8.4 Hz),4.83(1H,m),3.03(1H,t,J=12.3 Hz),2.56(1H,m),1.54(3H,s),1.07(3H,d,J=6.0 Hz),0.97(3H,d,J=7.2 Hz),0.88(3H,d,J=5.4 Hz),0.86(3H,d,J=6.0 Hz),0.67(3H,s),13C NMR(Pyr,125 MHz)数据如下:δC33.0(C 1),33.7(C 2),67.9(C 3),42.3(C 4),76.5(C 5),74.6(C 6),120.8(C 7),141.9(C 8),44.1(C 9),38.4(C 10),22.7(C 11),40.2(C 12),44.1(C 13),55.6(C 14),23.8(C 15),28.8(C 16),56.4(C 17),12.9(C 18),19.2(C 19),41.2(C 20),20.5(C 21),136.5(C 22),132.4(C 23),43.4(C 24),34.2(C 25),21.8(C 26),20.2(C 27),30.4(C 28),18.2(C 29),以上波谱数据与文献[19]报道的数据一致,因此鉴定该化合物为24 ethylcholesta 7,22 diene 3β,5α,6β triol。
化合 物4:白 色 无 定 形 粉 末,1H NMR(CDCl3,600 MHz)数据如下:δH5.57(1H,m),5.20(2H,m),3.64(1H,m),1.03(3H,d,J=6.6 Hz),0.94(3H,s),0.92(3H,d,J=6.6 Hz),0.84(3H,d,J=7.2 Hz),0.82(3H,d,J=6.6 Hz),13C NMR(CDCl3,125 MHz)数据如下:39.3(C 1),32.1(C 2),70.7(C 3),37.2(C 4),139.9(C 5),119.8(C 6),116.5(C 7),141.5(C 8),46.4(C 9),38.5(C 10),21.3(C 11),40.6(C 12),42.9(C 13),54.7(C 14),23.2(C 15),28.4(C 16),55.9(C 17),12.2(C 18),16.4(C 19),40.9(C 20),21.3(C 21),135.7(C 22),132.1(C 23),43.0(C 24),33.2(C 25),19.8(C 26),20.1(C 27),17.8(C 28),以上波谱数据与文献[20]报道的数据一致,因此鉴定该化合物为(22E,24R) ergosta 5,7,22 trien 3β ol。
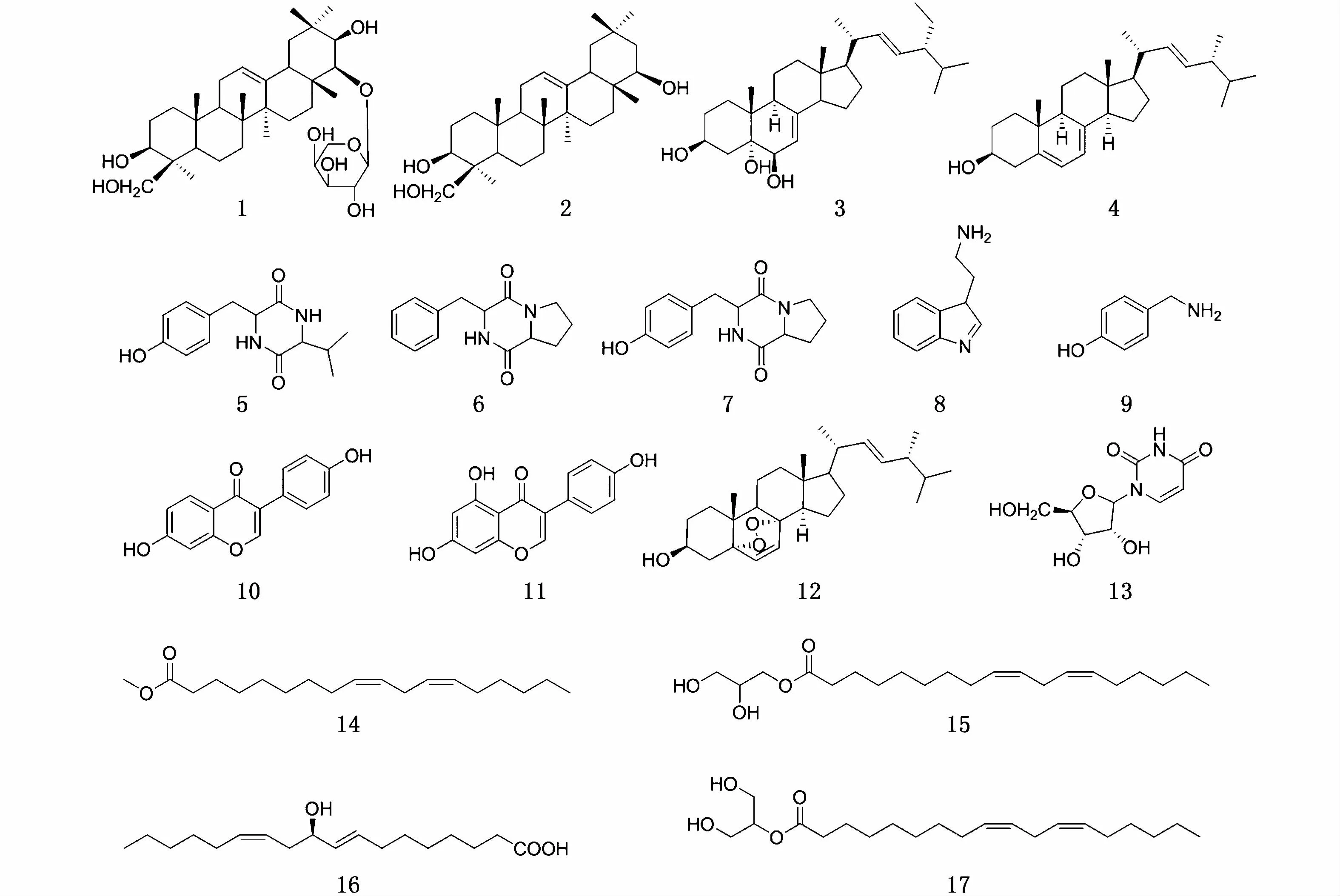
图1 从南海真菌Aspergillus aculeatus 1 P1和Paraconiothyrium cyclothyrioides 1 I2中分离得到的化合物结构式Fig.1 Structural formulas of compounds isolated from two South China Sea fungi Aspergillus aculeatus 1 P1 and Paraconiothyrium cyclothyrioides 1 I2
化合物5:浅褐色无定型粉末,1H NMR(CD3OD,400 MHz)信号:δH0.12(1H,m),0.72(3H,d,J=6.7 Hz),0.86(1H,m),1.21~1.38(1H,m),2.80(1H,m),3.18(1H,m),3.65(1H,m),4.21(1H,m),6.69(2H,d,J=7.8 Hz),6.97(2H,d,J=7.8 Hz)。以上波谱数据与文献[21]报道的数据一致,鉴定为已知化合物4 羟基苯丙氨酸 亮氨酸。
化合物6:浅黄色油状物,HR ESI MS谱给出准分子离子峰m/z245.128 3([M+H]+,计算值为245.128 5),提示其分子式为C14H16N2O2。1H NMR(CD3OD,400 MHz)数据如下:δH7.27(5H,m),4.46(1H,s),4.09(1H,dd,J=11.2,2.8 Hz),3.56(1H,dd,J=18.8,8.0 Hz),3.39(1H,m),3.18(2H,m),2.10(1H,m),1.82(2H,m),1.24(1H,m)。以上波谱数据与文献[22]报道的数据基本一致,鉴定为已知化合物环(苯丙氨酸 脯氨酸)。
化合物7:浅黄色粉末,HR ESI MS谱给出准分子离子峰m/z261.117 7([M+H]+,计算值为261.116 1),提示其分子式为C14H16N2O3。1H NMR(CD3OD,400 MHz)数据如下:δH7.04(1H,d,J=8.4 Hz),6.70(1H,d,J=8.8 Hz),4.36(1H,tlike),4.04(1H,dd,J=11.0,7.4 Hz),3.54(1H,m),3.36(1H,m),3.06(2H,m),2.19(1H,m),1.80(2H,m),1.21(1H,m)。以上波谱数据与文献[23]报道的数据基本一致,鉴定为已知化合物cyclo (L Pro L Tyr)。
化合物8:浅黄色油状物,1H NMR(CD3OD,600 MHz)数据如下:δH7.55(1H,d,J=7.8 Hz),7.32(1H,d,J=7.8 Hz),7.06(3H,m),2.94(2H,t,J=7.2 Hz)。以上波谱数据与文献[24]报道的数据一致,因此鉴定该化合物为已知芳香胺类化合物色胺,即吲哚乙胺。
化合物9:黄色无定形粉末,HR ESI MS谱给出准分子离子峰m/z138.089 9([M+H]+,计算 值 为138.091 3),提 示 其 分 子 式 为C8H11NO。1H NMR(CD3OD,600 MHz)数据如下:δH7.03(2H,d,J=8.4 Hz),6.70(2H,d,J=8.4 Hz),3.68(2H,t,J=7.2 Hz),2.71(2H,t,J=7.2 Hz)。该化合物数据与文献[25]报道的数据基本一致,鉴定为对羟基苯乙胺。
化合物10:无色固体,HR ESI MS谱给出准分子离子峰m/z255.064 6([M+H]+,计算值为255.061 3),提示其分子式为C15H10O4。1H NMR(Pyr,400 MHz)数据如下:δH8.47(1H,d,J=8.4 Hz),8.17(1H,s),7.86(1H,d,J=8.4 Hz),7.82(2H,d,J=8.4 Hz),7.29(2H,d,J=8.4 Hz),7.12(1H,d,J=2.4 Hz)。以上波谱数据与文献[26]报道的数据基本一致,鉴定为异黄酮类化合物7,4′ 二羟基异黄酮。
化合物11:浅黄色固体,1H NMR(CDCl3,400 MHz)数据如下:δH8.13(1H,s),8.06(1H,d,J=8.8 Hz),7.37(2H,d,J=8.8 Hz),6.94(1H,dd,J=8.6,1.8 Hz),6.85(2H,d,J=8.8 Hz)。以上波谱数据与文献[27]报道的数据一致,因此鉴定该化合物为异黄酮类化合物5,7,4 三羟基异黄酮。
2.2.2 1 I2中次级代谢产物的结构鉴定
化合物12:白色粉末,1H NMR(CDCl3,400 MHz)数据如下:δH6.50(1H,d,J=8.4 Hz),6.23(1H,d,J=8.4 Hz),5.21(1H,dd,J=15.2,7.6 Hz),5.14(1H,dd,J=15.2,8.0 Hz),3.96(1H,m),0.99(3H,d,J=6.4 Hz),0.90(3H,d,J=6.8 Hz),0.88(3H,s),0.83(3H,d,J=6.4 Hz),0.81(3H,s),13C NMR(CDCl3,100 MHz)数据如下:34.7(C 1),30.1(C 2),66.4(C 3),36.9(C 4),82.1(C 5),135.4(C 6),130.7(C 7),79.4(C 8),51.1(C 9),37.0(C 10),23.4(C 11),39.3(C 12),44.5(C 13),51.7(C 14),20.6(C 15),28.6(C 16),56.2(C 17),12.9(C 18),18.2(C 19),39.7(C 20),20.9(C 21),135.2(C 22),132.3(C 23),42.8(C 24),33.0(C 25),19.6(C 26),19.9(C 27),17.5(C 28),以上波谱数据与文献[28]报道的数据一致,因此鉴定该化合物为(22E) 5α,8α Epidioxyergosta 6,22 dien 3β ol。
化合物13:淡黄色粉末,1H NMR(DMSO,400 MHz)数据如下:7.87(1H,d,J=8.4 Hz),5.77(1H,d,J=5.2 Hz),5.63(1H,d,J=8.4 Hz),13C NMR(DMSO,100 MHz)数据如下:150.8(C 2),163.2(C 4),101.8(C 5),140.8(C 6),87.8(C 2′),73.6(C 3′),69.9(C 4′),84.9(C 5′),63.2(C 6′),以上波谱数据与文献[29]报道的数据一致,因此鉴定该化合物为尿嘧啶核苷。
化合物14:无色油状物,1H NMR(CDCl3,400 MHz)数据如下:δH5.36(4H,m),3.66(3H,s),2.77(2H,t,J=6.2 Hz),2.32(2H,t,J=7.4 Hz),2.05(4H,m),1.59(2H,m),0.89(3H,t,J=6.4 Hz),13C NMR(CDCl3,100 MHz)数据如下:174.3(C 1),34.1(C 2),24.9(C 3),29.1(C 4),29.1(C 5),29.3(C 6),29.6(C 7),27.2(C 8),130.0(C 9),127.9(C 10),25.6(C 11),128.0(C 12),130.2(C 13),27.2(C 14),29.1(C 15),31.5(C 16),22.6(C 17),14.0(C 18),51.4(-OCH3),以上波谱数据与文献[30]报道的数据一致,因此鉴定该化合物为Methyl Linoleate。
化合物15:无色油状物,1H NMR(CDCl3,400 MHz)数据如下:δH5.34(4H,m),3.93(1H,m),3.69(1H,dd,J=11.4,3.9 Hz),3.60(1H,dd,J=11.4,5.8 Hz),2.77(2H,t,J=6.3 Hz),2.35(2H,t,J=7.6 Hz),2.04(4H,dd,J=14.0,7.0 Hz),2.04(4H,dd,J=13.4,6.6 Hz),1.63(2H,m,H 3′),0.89(3H,t,J=6.8 Hz),13C NMR(CDCl3,100 MHz)数据如下:174.3(C 1),34.1(C 2),24.9(C 3),29.1(C 4),29.1(C 5),29.3(C 6),29.6(C 7),27.2(C 8),130.0(C 9),127.9(C 10),25.6(C 11),128.1(C 12),130.2(C 13),27.2(C 14),29.1(C 15),31.5(C 16),22.6(C 17),14.1(C 18),65.2(C 1′),70.3(C 2′),63.3(C 3′),以上波谱数据与文献[31]报道的数据一致,因此鉴定该化合物为1O(9Z,12Z octadecadienoyl)glycerol。
化合物16:淡黄色油状物,1H NMR(CDCl3,400 MHz)数据如下:δH5.65(1H,m),5.55(1H,m),5.48(1H,m),5.37(1H,m),4.09(1H,dd,J=12.8,6.2 Hz),2.34(2H,t,J=7.4 Hz),2.04(4H,m),1.64(2H,m),0.89(3H,t,J=6.8 Hz),13C NMR(CDCl3,100 MHz)数据如下:177.8(C 1),32.0(C 2),24.6(C 3),29.3(C 4),28.6(C 5),28.8(C 6),33.7(C 7),133.4(C 8),132.4(C 9),72.5(C 10),35.4(C 11),124.5(C 12),132.0(C 13),27.4(C 14),28.8(C 15),31.5(C 16),22.6(C 17),14.1(C 18),以上波谱数据与文献[32]报道的数据一致,因此鉴定该化合物为(8E,12Z) 10 Hydroxy 8,12 octadecadienoic acid。
化合物17:无色油状物,1H NMR(CDCl3,400 MHz)数据如下:δH5.36(4H,m),4.93(1H,m),3.83(4H,brd,J=4.4 Hz),2.77(2H,brt,J=6.2 Hz),2.37(1H,t,J=7.4 Hz),2.05(4H,dd,J=13.4,6.6 Hz,),1.64(2H,m),0.89(3H,t,J=6.6 Hz),13C NMR(CDCl3,100 MHz)数据如下:174.0(C 1),34.3(C 2),25.0(C 3),29.1(C 4),29.2(C 5),29.3(C 6),29.6(C 7),27.2(C 8),130.0(C 9),127.9(C 10),25.6(C 11),128.1(C 12),130.2(C 13),27.2(C 14),29.1(C 15),31.5(C 16),22.6(C 17),14.1(C 18),75.1(C 1′),62.6(C 2′),62.6(C 3′),以上波谱数据与文献[31]报道的数据一致,因此鉴定该化合物为2 linoleoylglycerol。
3 讨论与展望
本文对位于南海上川岛沙堤渔港南32 km处表层海水中获得的2株真菌Aspergillus aculeatus1 P1和Paraconiothyrium cyclothyrioides1 I2的 化 学 成 分 进 行 了 研 究,从Aspergillus aculeatus1 P1中分离得到11个化合物,从Paraconiothyriumcyclothyrioides1 I2中分离得到6个化合物,化合物类型包括萜类、甾醇、环二肽、脂肪酸等,学者前期对棘孢曲霉Aspergillus aculeatus的化学成分研究结果表明其中主要的化合物类型包括倍半萜类[33-34]、衣康酸衍生物和二酮哌嗪类[35];Paraconiothyrium属作为2004年新发现的一个属,近年来有多位学者对其进行化学成分及活性研究,对该属的化学成分研究结果表明其中主要的化合物类型包括二萜烷类[36-37]、呋喃酮类[38]、异海松烷型二萜苷[39]、倍半萜类[40-43]、聚酮类[44]、缩酮类[45],活性研究结果表明部分二萜烷类、倍半萜类及缩酮类化合物具有细胞毒、抗菌及抗病毒活性,表明该属微生物具有一定的代谢潜力,但是本研究从Paraconiothyriumcyclothyrioides1 I2中获得的次级代谢产物种类较少,化合物结构类型与其他研究结果相比也较为简单,猜测一方面可能是由于本研究所获得的微生物样本均来源于表层海水(0.5 m),而表层海水及沉积物环境相对较为简单,与中底层海水及沉积物复杂环境相比,缺乏特殊的条件来刺激诱导真菌产生丰富的代谢产物及生物活性[46],另一方面,猜测可能是培养基较为单一、且培养条件较为简单的缘故。虽然课题组在前期尝试过利用5种不同培养基对Paraconiothyriumcyclothyrioides1 I2的代谢产物多样性进行分析,并选择了代谢产物多样性最为丰富的马丁氏培养基作为发酵条件,但是从研究结果来看,仍然未得到较为复杂的结构。
近年来借助于飞速发展的基因组测序和生物信息数据挖掘技术发现,微生物具有产生丰富次生代谢产物的遗传基础,其代谢潜能远远超过先前的认识,许多新的次生代谢产物编码基因和基因簇陆续被发现。常规发酵条件优化过程对于挖掘南海真菌中新结构代谢产物效率不高,沉默的生物合成基因簇限制了次生代谢产物的多样性和新颖性。前期研究发现一株黄曲霉Aspergillusflavus中共含有编码56个次级代谢产物的基因簇,但仅有少量编码合成leporin类、黄曲霉毒素类、偶氮酸、哌嗪类等化合物的基因簇被发现[47]。在后基因组时代的今天,迫切需要研究利用各种沉默基因激活方法,提高南海真菌代谢产生各类活性天然产物的效率。
蛋 白翻译后修饰(post translational modification,PTM)是指对翻译后的蛋白质进行共价加工的过程,通过一系列酶催化的在一个或多个氨基酸残基加上或消除修饰基团的动态过程,改变蛋白质物化性质,进而影响蛋白质功效;其中最为频繁的修饰包括磷酸化、乙酰化、甲基化和泛素化等[48]。其研究热点在于利用蛋白质组学方法研究相关的重大疾病新靶点、新机制;在微生物代谢产物研究中,也有用于挖掘生物合成基因簇潜力、代谢产生新结构产物的尝试。几种修饰模式中研究较为透彻的是组蛋白的乙酰化和甲基化作用。组蛋白修饰在真菌基因的表达中有广泛的应用,组蛋白乙酰化和去甲基化使其结构呈松散状,有利于基因的转录,反之则使基因处于沉默状态。研究效果显著的例子是利用组蛋白去乙酰化酶(histone deacetylase,HDAC)抑制剂增加真菌细胞内组蛋白的乙酰化程度,有利于DNA与组蛋白八聚体的解离使核小体结构趋于松弛,从而利于各种转录因子、协同转录因子与DNA结合位点的特异性结合,激活基因的转录,尤其是提高代谢相关基因的表达水平,成功改善了菌株代谢产物的多样性或产量[49]。HENRIKSON等[50]在黑曲霉培养基中添加组蛋白去乙酰化酶抑制剂伏立诺他(suberoylanilide hydroxamic acid,SAHA)后发现14个生物合成基因簇的表达量有大幅度提高,从而使黑曲霉代谢途径发生改变,最终从发酵液中分离得到1个全新的代谢产物nygerone A,也是在黑曲霉中首次报道产生。前期本课题组利用SAHA对一株南极黄曲霉Aspergillussp.NJF3进行蛋白翻译后磷酸化修饰调控的尝试,结果表明其代谢产物多样性、特定成分产量有明显变化,后期将进一步优化真菌的发酵条件,尝试使用不同的海洋真菌培养基,尝试适合的代谢调控方法,扩大发酵规模并富集微量成分,以期获得较为复杂的结构新颖性化合物。
本研究结果丰富了研究者对南海真菌多样性及其代谢产物活性的了解,为药源微生物发掘提供资源保障,同时也为研究人员通过活性追踪方法、有目的地深入开展其代谢产物化学多样性和活性研究提供指导。
