不同浮游植物叶绿素a提取方法的比较研究
2020-10-05江天棋姜亚洲凌建忠唐保军
江天棋,张 扬,姜亚洲,孙 鹏,凌建忠,唐保军
(1.上海海洋大学水产科学国家级实验教学示范中心,上海201306;2.中国水产科学研究院东海水产研究所,上海 200090;3.上海海洋大学海洋生物科学国际联合研究中心,上海 201306)
叶绿素a(Chla)是估算海洋初级生产力和评估海水富营养化程度的重要指标之一[1]。准确测定水体中Chla浓度对于评价水体营养状态及水域生态系统修复状况具有重要意义[2]。虽然水体Chla浓度的测定方法已有国家标准(GB 17378.7 2007、GB/T 12763.6 2007)和环境保护标准(HJ 897 2017)[3-5]可参考,但在实际分析操作中仍存在一些尚未解决的问题。比如,上述标准都采用了玻璃纤维滤膜,但出于成本考虑,纤维素酯类膜仍被许多研究单位使用,而纤维素酯类膜在丙酮中溶解不完全,存在微细胶体颗粒,这些颗粒在多大程度上会影响比色结果尚不明确。在提取方法上,GB 17378.7 2007标准是加90%丙酮溶液后振荡,HJ 897 2017标准则采用了研磨方法;在提取时间、样品保存时间方面两个标准也有所不同。此外,单胞藻经常作为指示物应用在滤食性动物滤水率的测定中[6-7],而有研究表明丙酮对栅藻(Scenedesmussp.)、小球藻(Chlorellasp.)、微拟球藻(Nannochlorissp.)等绿藻的提取效果不佳[8-9],虽然研磨、匀浆、超声等方法可以提高有机溶剂对Chla的提取效果[10],但对不同单胞藻类Chla提取率的影响程度如何,尚待进一步研究。
本文选择了2种绿藻和1种硅藻,分析了不同滤膜和提取溶剂对Chla浓度测定结果的影响,比较了不同样品提取时间、保存时间以及研磨和冻融两种方法下丙酮对Chla的提取效果,并探讨了如何降低纤维素酯类膜溶解后的微小颗粒对测定结果的影响,以期为海水Chla浓度的分析测定提供参考资料。
1 材料与方法
1.1 材料与试剂
实验 采 用3种 滤 膜:孔 径0.7μm的Whatman GF/F玻璃纤维滤膜(GE healthcare life sciences)、孔径0.45μm的混合纤维素酯(水系)滤膜和孔径0.45μm的聚偏氟乙烯微孔滤膜(上海兴亚净化材料厂);3种单胞藻类(包含2种绿藻和1种硅藻):蛋白核小球藻(Chlorella pyrenoidesa)、亚心形扁藻(Platymonas subcordiformis)和牟氏角毛藻(Chaetoceros muelleri);3种提取溶剂:90%丙酮、90%乙醇和甲醇。其他试剂和设备包括:碳酸镁悬浊液、真空泵(津腾GM 0.5A)、台式离心机(湘仪TG 16WS)、紫外可见分光光度计(上海精科752N)。
1.2 实验方法
1.2.1 水样采集和处理
为模拟海水环境,以海水晶(浙江蓝海星)配制盐度为25的海水,然后分别加入各单胞藻液。水样的过滤、Chla提取流程均参照GB 17378.7 2007《海洋监测规范第7部分:近海污染生态调查和生物监测》[3]中Chla浓度的测定(分光光度法)。样品采集后立即测定。对于比较冻融法与研磨法以及不同保存时间的样品,则在水样刚刚抽干后,将滤膜(添加碳酸镁)对折,用锡箔纸封好,放到棕色塑料瓶中,置于-20℃保存。
1.2.2 不同滤膜和提取溶剂对Chla浓度测定结果的影响
配制海水50 L,加入100 mL蛋白核小球藻,充分混匀,分别用上述3种滤膜抽滤1 L水样。采用冻融法[11],将滤膜在-20℃冷冻1 h,取出室温融解20 min,反复5次。然后将滤膜放入具塞离心管,分别加10 mL 90%丙酮、90%乙醇和甲醇,每种提取溶剂设4个平行,置于4℃避光浸泡12 h,3 500 r·min-1离心10 min提取Chla。牟氏角毛藻测定操作同上。
用分光光度法测定各Chla提取液在600~750 nm的吸收光谱。
1)对90%丙酮提取液,测定波长750、664、647、630 nm处的吸光度值,参照GB 17378.7 2007标准,Chla浓度计算公式如下:

式(1)中,E750、E664、E647、E630分别为波长750、664、647、630 nm处提取液的吸光度值,V丙酮为丙酮提取液体积(mL),V水样为过滤水样的体积(L),δ为比色皿光程(cm)。
2)参照金霞等[12],体积分数为90%的丙酮比吸光系数为89,而体积分数90%乙醇的比吸光系数为87,因此用式(1)乘以1.023,得到如下公式:

式(2)中符号意义同式(1)。
3)对甲醇提取液,参照PORRA[8]方法,测定波长750、665、652 nm处的吸光度值,Chla浓度计算公式如下:式(3)中,E750、E665、E652分别为波长750、665、652 nm处提取液的吸光度值,其余符号意义同式(1)。

1.2.3 不同提取方法对Chla浓度测定结果的影响
根据上述实验结果,采用玻璃纤维滤膜和90%丙酮,分析冻融和研磨对3种藻Chla浓度测定结果的影响。每种藻设4个平行。冻融操作同1.2.2。研磨操作参照HJ 897 2017标准[5],采用10 mL玻璃匀浆器,加入6 mL 90%丙酮溶液,充分研磨5 min以上,冲洗,转移至玻璃刻度离心管中,定容至10 mL,置于4℃避光浸泡12 h,3 500 r·min-1离心,分光光度法测定Chla浓度。
1.2.4 不同提取时间对Chla浓度测定结果的影响
以玻璃纤维滤膜和90%丙酮为提取溶剂,采用冻融法提取Chla,方法同1.2.2,分别在加入提取剂后6、12、24、48、72、96 h通过分光光度法测定Chla浓度。每个时间点设4个平行。
1.2.5 不同样品保存时间对Chla浓度测定结果的影响
以玻璃纤维滤膜和90%丙酮为提取溶剂,水样过滤后分别保存0、7、15、30、60 d。采用冻融法提取Chla,分光光度法测定Chla浓度。每个时间点设4个平行。
1.3 数据分析
实验所得数据以平均数±标准差的形式表示,采用SPSS16.0软件先对数据进行正态化检验,符合正态分布的进行单因子方差分析和双因子方差分析,并对不同滤膜与提取介质、不同提取时间和保存时间的测定结果进行多重比较,以P<0.05和P<0.01表示差异有显著和极显著意义。
2 结果与分析
2.1 不同滤膜和提取溶剂对Chla浓度测定结果的影响
实验发现,玻璃纤维滤膜抽滤水样速度最快,1 L水样约需2~5 min;聚偏氟乙烯微孔滤膜抽滤速度最慢,1 L水样约需45~60 min。加入90%丙酮后,混合纤维素滤膜完全溶解,聚偏氟乙烯滤膜和玻璃纤维滤膜仍保持完整。加入90%乙醇后,3种滤膜都没有明显变化。加入甲醇后,混合纤维素滤膜部分溶解,呈悬浊状态,聚偏氟乙烯滤膜和玻璃纤维滤膜仍保持完整。
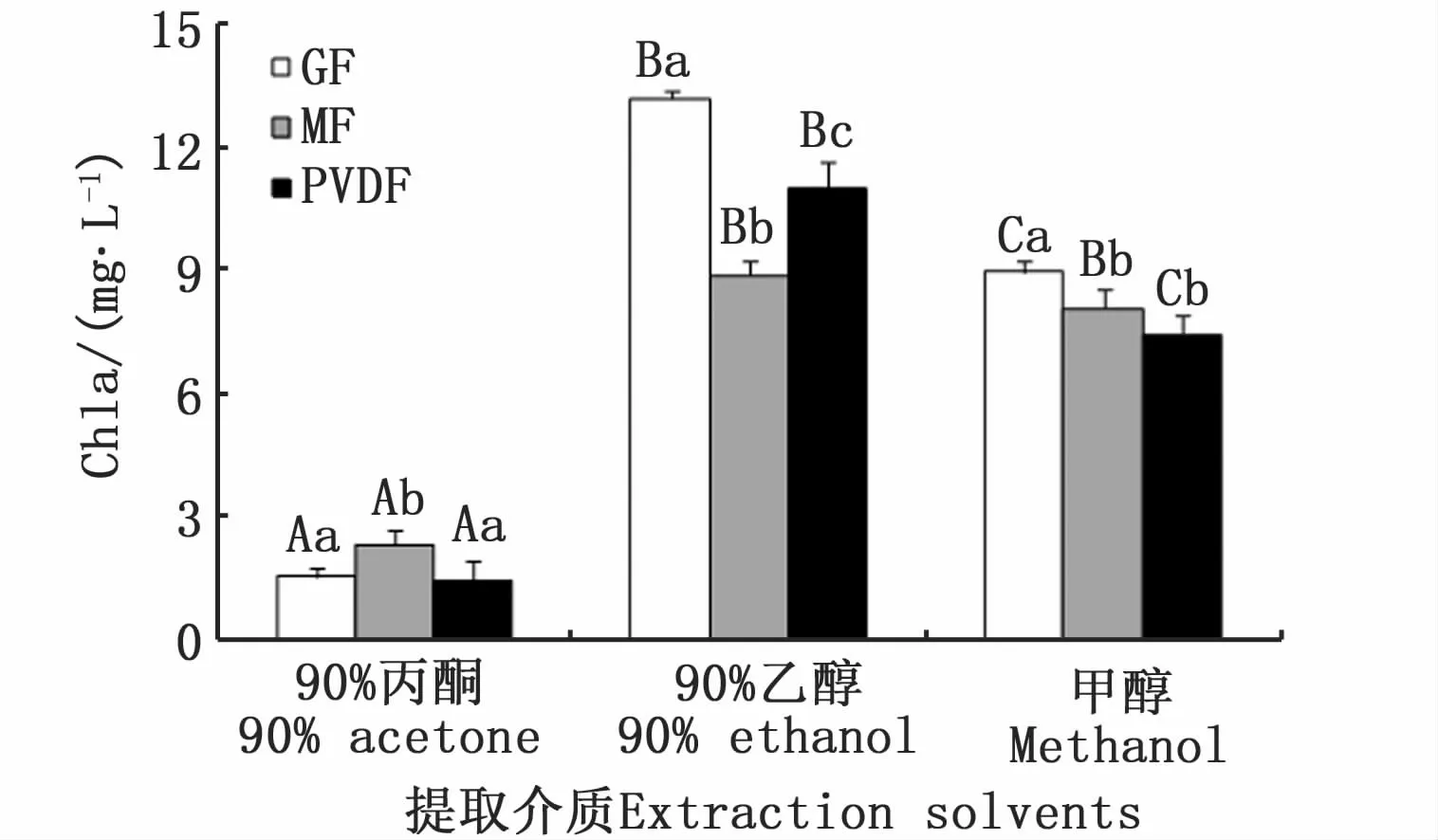
图1 不同滤膜和提取溶剂对蛋白核小球藻Chla浓度测定的影响Fig.1 Effects of filter membranes and extraction solvents on measured Chla concentrations of C.pyrenoidesa
双因子方差分析表明,不同滤膜和提取溶剂均对蛋白核小球藻Chla测定结果有极显著差异(P<0.01),90%丙酮提取的Chla测定结果极显著低于其他两种介质(P<0.01)(图1)。混合纤维素滤膜和聚偏氟乙烯滤膜测定结果无显著差异(P=0.54)。不同滤膜和提取溶剂均对牟氏角毛藻Chla浓度测定结果有极显著影响(P<0.01)(图2)。
为了判断甲醇溶解滤膜对测定结果的影响,采用3 500 r·min-1(850 g)和8 000 r·min-1(4 450 g)两种转速对提取液进行离心。结果显示,3 500 r·min-1离心后,混合纤维素滤膜提取液仍呈悬浊状态,而8 000 r·min-1离心后,提取液上部澄清。结果表明,转速升高后,混合纤维素滤膜测定的Chla浓度显著下降(P<0.01)(图3),玻璃纤维滤膜测定结果虽然也显著下降(P<0.05),但幅度较小,而聚偏氟乙烯滤膜无显著差异。

图2 不同滤膜和提取溶剂对牟氏角毛藻Chla浓度测定的影响Fig.2 Effects of filter membranes and extraction solvents on measured Chla concentrations of C.muelleri

图3 不同离心转速下甲醇提取蛋白核小球藻Chla浓度测定结果Fig.3 Determ ination of Chla concentrations in C.pyrenoidosa by methanol extraction at different centrifugal speeds
2.2 不同提取方法对Chla浓度测定结果的影响
结果显示,采用冻融法测定的牟氏角毛藻和亚心形扁藻Chla浓度值均高于研磨法(图4),但双因子方差分析表明两种处理方法之间无显著性差异。冻融法测定的蛋白核小球藻Chla浓度极显著低于研磨法(P<0.01),仅为研磨法的1/24。

图4 不同提取方法对不同藻类Chla浓度测定结果的影响Fig.4 Effects of extraction methods on measured Chla concentrations of threem icroalgae
2.3 不同提取时间对Chla浓度测定结果的影响
结果显示,不同提取时间对牟氏角毛藻Chla的测定结果有显著影响(图5)。提取12 h的Chla浓度显著高于其他时间点(P<0.05),提取6 h的Chla浓度则显著低于其他时间点(P<0.05),24~96 h的Chla浓度无显著差异。
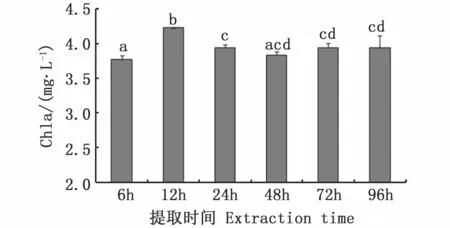
图5 不同提取时间对牟氏角毛藻Chla浓度测定结果的影响Fig.5 Effects of extraction time on measured Chla concentrations of C.muelleri
2.4 样品保存时间对Chla浓度测定结果的影响
结果显示,随着样品保存时间的延长,Chla浓度的测定结果逐渐降低(图6),冷冻保存7 d后即出现显著降低(P<0.05);但在7~30 d之间,Chla浓度的测定结果无显著差异;样品保存60 d后Chla浓度的测定结果极显著降低(P<0.01)。

图6 不同样品保存时间对牟氏角毛藻Chla浓度测定结果的影响Fig.6 Effects of sam p le preservation tim e on measured Chla concentrations of C.muelleri
3 讨论
本实验中,玻璃纤维滤膜在加入3种抽提剂后保持完整,测定的Chla浓度结果也相对稳定。混合纤维素滤膜加入抽提介质后易造成液体浑浊,影响比色结果,有机系的聚偏氟乙烯滤膜则过滤速度较慢,不适合大量样品分析。宁修仁[13]报道,使用Whatman GF/C玻璃纤维滤膜加碳酸镁,测定海水浮游植物Chla浓度效果最佳。这是因为碳酸镁具有防止叶绿素分解的作用,而玻璃纤维滤膜在丙酮中的不可溶性,提高了比色测定的准确性。林少君等[11]使用醋酸纤维滤膜、微孔滤膜和GF/F玻璃纤维滤膜抽滤微囊藻水样,发现各滤膜对Chla浓度测定结果影响不显著。但吴妹英[14]报道,使用玻璃纤维滤膜测得的Chla浓度显著高于使用醋酸纤维素滤膜和微孔滤膜测得的结果。结合本文实验研究结果,可以认为玻璃纤维滤膜比较适宜海水Chla浓度分析。
本实验中,使用丙酮冻融法提取的蛋白核小球藻Chla浓度测定结果大幅低于乙醇和甲醇,表明丙酮对蛋白核小球藻Chla的提取效果不好。已有研究表明,丙酮对栅藻、小球藻、微拟球藻等绿藻的提取效果不佳[8-9,15]。研究表明,绿藻和蓝藻中Chla较难提取,通常需要机械破碎细胞[16-17]。本研究中,蛋白核小球藻经研磨后测定结果大幅提高,应与此有关。但对同属绿藻门的亚心形扁藻,丙酮冻融和研磨提取的Chla浓度无显著性差异,表明丙酮对Chla的提取效果有种间差异。我国沿海海水中浮游植物主要为硅藻和甲藻[18-20],采用丙酮作为提取溶剂对测定结果影响不大。但如果因环境条件改变导致海水中小球藻等绿藻的含量升高,冻融法会造成测定结果偏低。在养殖池塘水体中,绿藻占比较高[21-23],在对其进行养殖环境的监测时,应注意丙酮提取方法可能导致的结果差异。
小球藻Chla浓度测定结果表明,乙醇提取效果优于甲醇和丙酮。不同提取剂的提取效果也与藻类种类有关[24-25]。陈纪新等[26]报道,丙酮、甲醇和乙醇对盐生杜氏藻(Dunaliellasalina)、角毛藻(Chaetocerossp.)、赫胥黎艾氏藻(Emilliania huxleyi)的Chla提取效果无显著性差异。WASMUND等[27]发现乙醇对于以甲藻和硅藻为主的海水Chla的提取效果优于丙酮。但ROIJACKERS[28]报 道 丙 酮 对 阿 氏 颤 藻(Oscillatoriaagardhii)、美丽团藻(Volvoxaureus)和Pennales目硅藻的提取效果比乙醇好,3种藻之间无差异。甲醇对铜绿微囊藻(Microcystisaeruginosa)Chla的提取效果优于丙酮和乙醇[29]。但甲醇可部分融解混合纤维素滤膜,形成凝胶状颗粒悬浊,干扰测定结果。本实验结果还表明,对于玻璃纤维滤膜和聚偏氟乙烯滤膜,离心转速对测定结果影响不大。
一般来说,研磨破碎细胞可提高Chla的提取率[27,30]。本实验中,冻融法测定的亚心形扁藻和牟氏角毛藻Chla浓度却高于研磨法。此前也有研究表明,冻融法测定Chla浓度的结果高于研磨法[11,31]。这可能是因为反复冻融法是利用细胞内冰粒形成和细胞液浓度的增高引起溶胀来达到破损细胞壁的目的,而研磨操作步骤多,样品转移过程中可能造成损失,这应该是造成研磨法测定结果偏低的原因[32]。林少君等[11]认为,冻与融的时间比例大概为20 min∶5 min,融解时间最好不要超过10 min。本实验中冻、融时间分别为1 h、20 min,也取得了比较好的效果,说明冻融时间的长短对结果影响不大。
不同提取时间的结果显示,提取12 h的Chla浓度测定值最高,这与GB 17378.7 2007和HJ 897 2017标准一致。吴妹英[14]也发现,4℃下提取16 h,Chla浓度值趋于稳定,而24 h后,Chla浓度值缓慢下降。有研究报道[33-34],升高温度可缩短Chla的提取时间。考虑到操作简便性,建议Chla的提取时间为12 h以上、不超过24 h。
在实际的海洋调查监测工作中,经常遇到因条件所限无法现场测定,导致水样抽滤后保存时间较长的问题。王秋丽[35]报道,冷冻保存7~14 d后,Chla损失约15%,冷冻保存30 d后,Chla损失约20%。本实验中,样品冷冻保存15 d后Chla损失7%,保存30 d后损失12%,而保存60 d后损失高达22%。因此,水样抽滤后,最好在15 d内完成测量,以确保监测结果的准确性。
综上,在测定不同藻类的叶绿素a含量时,采用玻璃纤维滤膜过滤水样、冻融法提取12~24 h后测定效果最好,水样抽滤后保存时间不宜超过15 d,对蛋白核小球藻应采用研磨法提取Chla。
致谢:本实验得到温州大学马增岭老师和上海海洋大学沈盎绿老师的指导,在此一并表示感谢。
