外源激素处理对花椒插穗生根及其生理生化特性的影响
2020-09-30,,,,,,,,
,,,,,,,,
(1.黄河下游森林培育国家林业和草原局重点实验室,山东 泰安 271018;2.山东农业大学 林学院,山东 泰安 271018;3.山东省阳信县职业中专,山东 滨州 251800;4.济南市林业科技推广站,山东 济南271100;5.上海市环境学校,上海 200135;6.山东省国土空间数据遥感技术中心,山东 济南 250002)
扦插繁殖是植物无性繁殖中应用最广泛的一种传统技术,是用部分或全部营养器官作为繁殖材料,在适宜条件下插入土壤或营养基质中,促使其发生不定根或不定芽,利用植物细胞的全能性培育成完全独立植株的一种无性繁殖方法[1-2]。
影响插穗扦插成活的因素较多,如植物品种、温度、插穗成熟度、插床类型、基质以及外源激素等[3],其中,外源激素处理对花椒Zanthoxylum bungeanum扦插生根有显著影响[4]。1935年,Zimmerman 等[5]发现α-NAA 和IAA 等8 种 新的有机化合物能促进根系生长,诸多学者便开始研究生长素对花椒扦插育苗的作用。陈荣江等[6]开展了生长素种类和浓度的正交设计试验,发现在一定浓度范围内,IAA(indole-3-acetic acid)和NAA(indoleethyl butyric acid)配合使用可明显提高花椒插穗的生根率;宋建伟等[7]用不同质量浓度IBA 处理花椒硬枝插穗,发现50 ~100 mg/L IBA(indoleethyl butyric acid)处理12 h 效果较好,且明显缩短了育苗时间。另外,在扦插基质方面,王丽敏[8]经研究发现,适宜的温度和湿度条件下,进行小花花椒扦插时选用有机基质比无机基质成活率高,生根时间缩短,原因是有机基质多由珍珠岩、蛭石以及草炭等材料组成,具有养分含量高、透水性强、透气性好等特点。
随着花椒产品资源的开发和利用,以及人们对饮食要求的提高,花椒作为调味食品越来越受到青睐,其市场潜力巨大。若要增加花椒的生产效益,提高花椒的经济价值,首先应提高花椒的苗木质量,并保持其优良的生产特性。本试验中以‘狮子头’嫩枝为试材,使用不同浓度不同种类的外源激素处理其插穗后进行扦插试验,测定扦插生根关键物质和生物酶活性,并持续观测根系发育过程,旨在探索激素促进花椒根系发生和发育的生理机制,为花椒优良品种的繁育提供理论参考。
1 材料与方法
1.1 试验地概况
在山东省泰安市夏张镇优木苗圃合作社温室内进行扦插试验。温室长20.0 m,宽4.0 m,高2.5 m,温室内采用全日照间歇式喷雾装置和水帘降温系统控制温湿度。扦插前10 d,喷施0.3%KMnO4溶液对基质进行消毒处理,同时将基质深翻、搅匀后,用地膜覆盖2 d,揭开,摊晾通风后备用。采用50穴育苗穴盘(54 cm×28 cm)进行扦插,穴盘底部铺设碎石子和河沙,防止水分积聚。
1.2 试验设计
2019年6月,以生长一致的2 ~3年生‘狮子头’实生苗嫩枝为试材进行扦插。将插穗在0.1%KMnO4溶液中浸泡消毒1 h 并洗净后,在不同质量浓度、不同种类的外源激素中浸泡插穗1 h,分别为250、500 mg/L 的IAA(处理编号T2、T3)、IBA(处理编号T4、T5)和NAA(处理编号T6、T7),然后剪掉插穗基部1 cm,将其洗净用于扦插,以清水处理为对照(处理编号T1)。选用珍珠岩和蛭石的混合基质(质量比为2∶1)作为扦插基质,采用直插法进行扦插。采用完全随机区组试验设计,每小区扦插150 株,重复3 次。
1.3 管理方法
扦插后,各处理穴盘做好标记,且各扦插处理幼苗均采取统一田间管理措施。温室内环境温度为24 ~28 ℃,相对湿度约为70%。生根前,每隔5~7 d分别用0.5%多菌灵溶液和0.3%KMnO4溶液进行交替消毒,防止细菌、病虫导致的扦插苗基部感染或腐烂。生根后至移栽前,进行消毒灭菌处理,给予幼苗良好的生长环境。
1.4 测定方法
扦插后,每隔10 d 采样1 次,观察插穗基部变化情况。每个处理取10 株健康植株,剥取基部3 cm 的韧皮层,用蒸馏水洗净后,在液氮中储存,带回实验室于-80 ℃保存待测。超氧物歧化酶(superoxide dismutase,SOD)活性采用氮蓝四唑法(nitroblue tetrazolium,NBT)测定[9],过氧化物酶(peroxidase,POD)活性采用愈创木酚法测定,可溶性糖含量采用蒽酮比色法于630 nm 波长下测定,多酚氧化酶(polyphenol oxidase,PPO)活性采用邻苯二酚比色法[10]测定,可溶性蛋白含量采用考马斯亮蓝G-250 法于595 nm 波长下测定,吲哚乙酸氧化酶(indoleacetic acid oxidase,IAAO)活性采用紫外分光光度法于530 nm波长下测定[11]。各指标重复测定3 次,并记录数据。60 d 后,调查统计不同处理的插穗生根成活情况,包括生根数量、根长、生根率、平均根长、根数和生根指数,并记录数据。
1.5 数据分析
使用Excel 2013 软件对数据进行统计分析,使用SPSS 22.0 软件对所有指标进行方差分析和Duncan 多重比较。为避免使用单一指标评价插穗生根效果的片面性,通过计算生根效果指数对其进行评价分析。
生根效果指数=(成活率/插穗成活数)×平均根长×生根数。
2 结果与分析
2.1 花椒插穗根系发生进程
扦插后,取样观察插穗生根进展,结果如图1所示。扦插后10 d 时,插穗基部皮孔膨胀、外凸、开裂(图1A),并在韧皮部与木质部夹层形成乳白色幼嫩组织,即愈伤组织(图1B);扦插后15 ~20 d,愈伤组织继续膨大,有愈伤组织形成的插穗数量继续增加(图1C);扦插后25 ~30 d,愈伤组织已不再生长,部分插穗愈伤组织开始褐变;地上部分出现萌芽,幼叶也开始发育,不定根从愈伤组织处(图1D)或皮孔开裂处(图1E)发生后进行伸长生长,且数量逐渐增多(图1F),同时,插穗地上部分形成幼嫩新梢(图1G)。
成活的插穗中,愈伤组织和皮部均能生根,其中,愈伤组织生根株数占生根总数的73.25%,皮部生根株数占生根总数的25.62%,两者均生根的比例为1.13%。由此可见,多数花椒扦插苗不定根的发生属愈伤组织生根型,即插穗基部下切口以上3 cm 范围出现明显膨大且长出根系(图1F)。另外,若干皮部生根插穗的基部水分吸收过多,腐烂较为严重,甚至死亡(见图1H)。少部分插穗组织腐烂却正常生根(图1I)。花椒扦插生根过程大致分为4 个阶段:扦插后0 ~10 d为花椒愈伤组织诱导期;扦插后10 ~30 d 为不定根形成期;扦插后30 ~40 d 为不定根伸长期;扦插40 d 以后为生根后期。
2.2 激素处理对花椒插穗生根指标的影响
不同浓度激素处理中花椒插穗的生根情况存在差异(表1)。不同浓度激素处理后,花椒插穗的生根率、生根数量、平均根长和生根效果指数等方面均具有显著差异(F=23.35,P<0.05)。按照IAA 处理后花椒成活率由高到低排序,各处理依次为T2、T3、T1,根系形态特性与之表现相同。在IBA 处理中,以250 mg/L IBA 处理效果最好,T4 和T5 处理的插穗成活率较T1 处理分别提高了119.53%、82.59%,T4 处理的插穗生根数量、平均根长和生根效果指数较T1 处理分别提高76.58%、46.79%和159.70%。在NAA 处理中,按照插穗生根数量、平均根长和生根效果指数由高到低,各处理依次均为T7、T6、T1,说明在一定浓度范围内,较高浓度的NAA 更有利于根系的发生。
2.3 激素处理对花椒插穗生理生化指标的影响
2.3.1 可溶性蛋白含量变化
不同激素处理中花椒插穗可溶性蛋白含量的变化不同(图2)。T1 和T2 处理中,插穗可溶性蛋白含量随扦插时间的延长而逐渐降低,其他处理中其含量大致表现为“降低—升高—降低”的变化趋势。扦插后0 ~20 d 时,插穗可溶性蛋白含量缓慢下降,其中,T4 和T7 处理中插穗可溶性蛋白含量下降速度较快,由最初的25.17 mg/g分别下降至20.08、21.34 mg/g,二者平均下降比例为19.71%。扦插后20 ~40 d 为不定根形成和伸长阶段,该时期插穗可溶性蛋白含量逐渐升高。另外,T3、T4 和T6 处理中插穗可溶性蛋白含量在扦插后40 d 时达到峰值,T5 和T7 处理中其含量在扦插后30 d 时达到峰值。而T1 和T2 处理中插穗可溶性蛋白含量持续下降,扦插后20 ~50 d时,T1 处理中其含量由22.35 mg/g 急剧下降至13.25 mg/g;T2 处理中其含量下降趋势相对平缓,由22.07 mg/g 降至18.89 mg/g。

图1 花椒扦插生根过程中不同阶段插穗的情况Fig.1 Rooting development properties of Z.bungeanum in different cutting stages
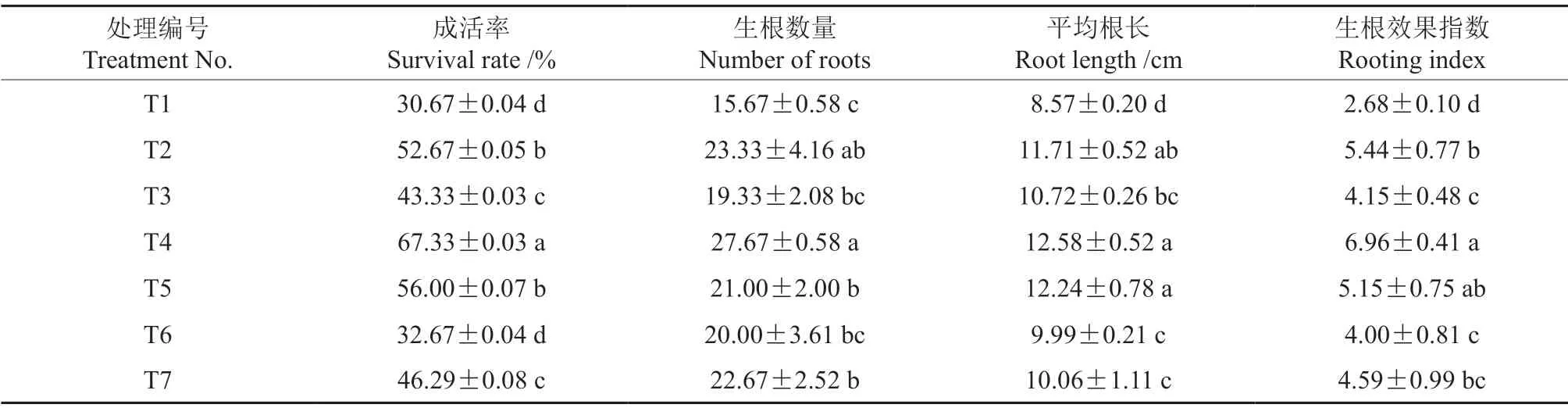
表1 不同浓度激素处理中花椒插穗的生根情况Table1 Duncan multiple comparisons of rooting parameters with various exogenous hormones treatments in pepper cuttings
2.3.2 可溶性糖含量的变化
不同激素处理中花椒插穗可溶性糖含量的变化大致相似(图3),均呈现“下降—上升—下降”的变化趋势。扦插后0 ~10 d 时,可溶性糖含量持续下降。扦插后10 ~30 d 时,不定根开始形成,插穗萌芽抽枝并展叶,可溶性糖含量提高。其中,T1、T5 和T7 处理中可溶性糖含量在扦插后40 d时达到峰值,其余处理在扦插后30 d 时达到峰值。与之不同的是,清水处理后不同时期中插穗可溶性糖含量均低于各激素处理,且有显著差异。另外,在愈伤组织诱导期,清水处理中插穗可溶性糖含量的下降速度明显高于各激素处理(P<0.05)。扦插后30 ~50 d,不同处理的插穗不定根迅速伸长,可溶性糖含量持续下降。
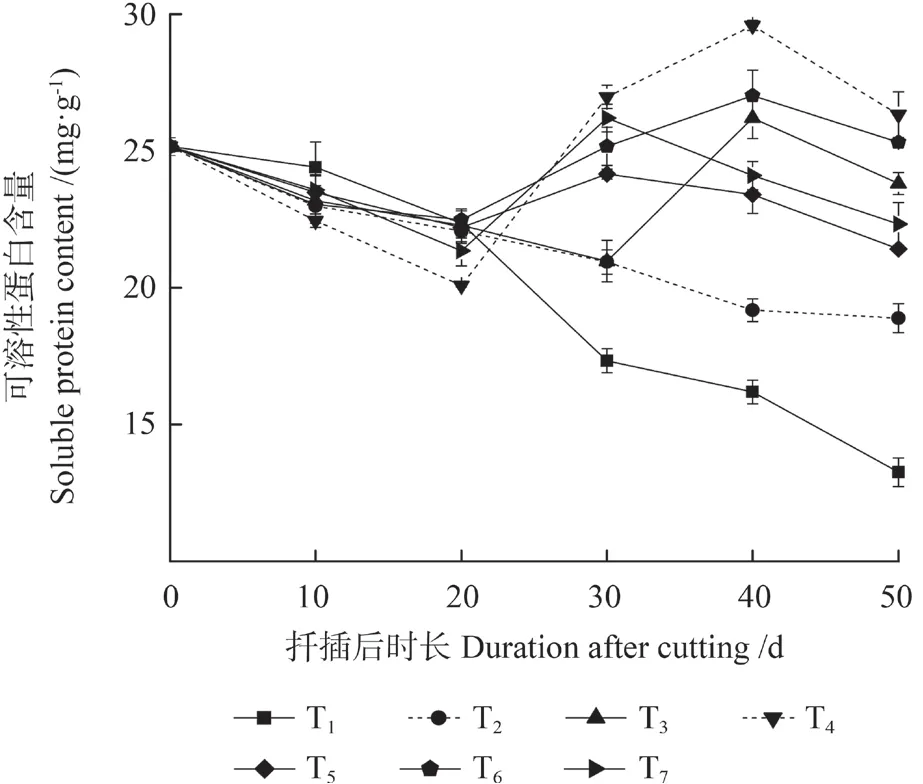
图2 不同激素处理中花椒插穗可溶性蛋白含量的变化Fig.2 Changes of soluble protein contents during rooting process of pepper cuttings
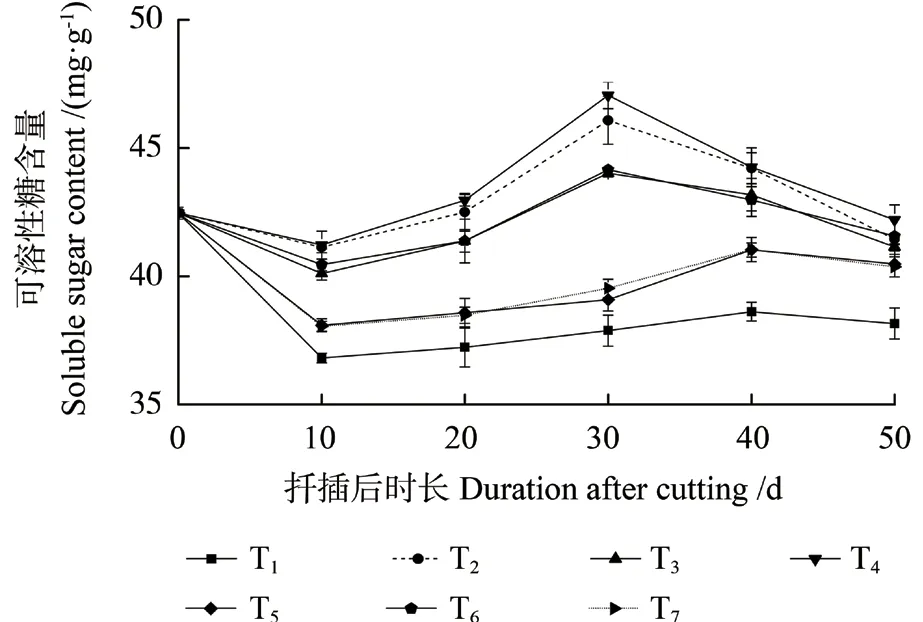
图3 不同激素处理中花椒插穗可溶性糖含量的变化Fig.3 Changes of soluble sugar contents during rooting process of pepper cuttings
2.3.3 SOD 活性的变化
不同激素处理中花椒插穗SOD 活性随着生根进程均呈先升高、后降低的变化趋势(图4),且除T5 处理中SOD 酶活性在扦插后10 d 时低于T1处理外,其他激素处理在不同测定时间的SOD 酶活性均高于对照(T1)。扦插后30 d 时,与T1相比,其他处理中插穗SOD 活性均提高,分别提高了36.47%、20.57%、38.35%、11.09%、51.50%和8.53%;而T1 处理在扦插后40 d 时SOD 酶活性到达峰值,之后便开始逐渐下降。另外,对照组和激素处理组插穗SOD 活性峰值出现的时间均为不定根表达时期,而激素处理中SOD 活性峰值出现的时间早于T1 处理。
2.3.4 POD 活性的变化
不同激素处理中花椒插穗POD 活性在不同生根时期内变化趋势基本一致(图5),均表现为“升高—降低—升高—降低”的变化趋势,且不同处理之间差异显著(P<0.05)。扦插后0 ~10 d 时,为扦插前期,即愈伤组织诱导时期,POD 活性迅速上升,且大致在扦插后10 d 时达到峰值。之后POD 活性在扦插后20 d 时降低,且T1 处理中其活性均低于其他激素处理。随后在不定根表达时期又出现1 个明显的峰值,且此时POD 活性较第1 峰值显著提高(P<0.05),其中,T1、T2、T5 和T7 处理在扦插后30 d 时出现第2 峰值,而T3 与T6 处理峰值出现时间滞后于上述4 个处理,其第2 峰值在扦插后40 d 时出现。在生根伸长期,不同处理中插穗POD 活性均下降。
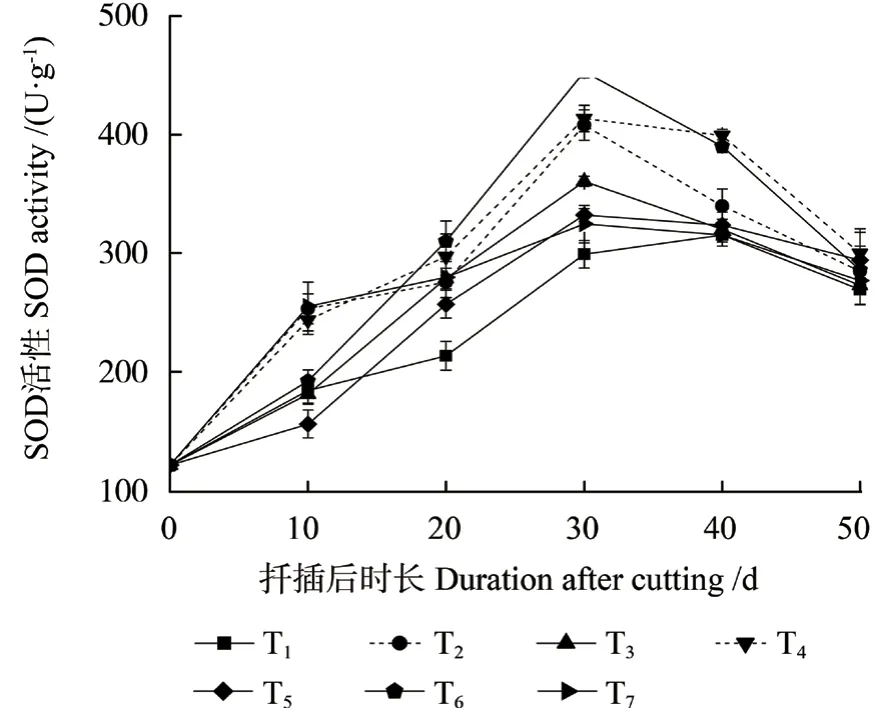
图4 不同激素处理中花椒插穗SOD 活性的变化Fig.4 Changes of superoxide dismutase (SOD) activity during rooting process of pepper cuttings
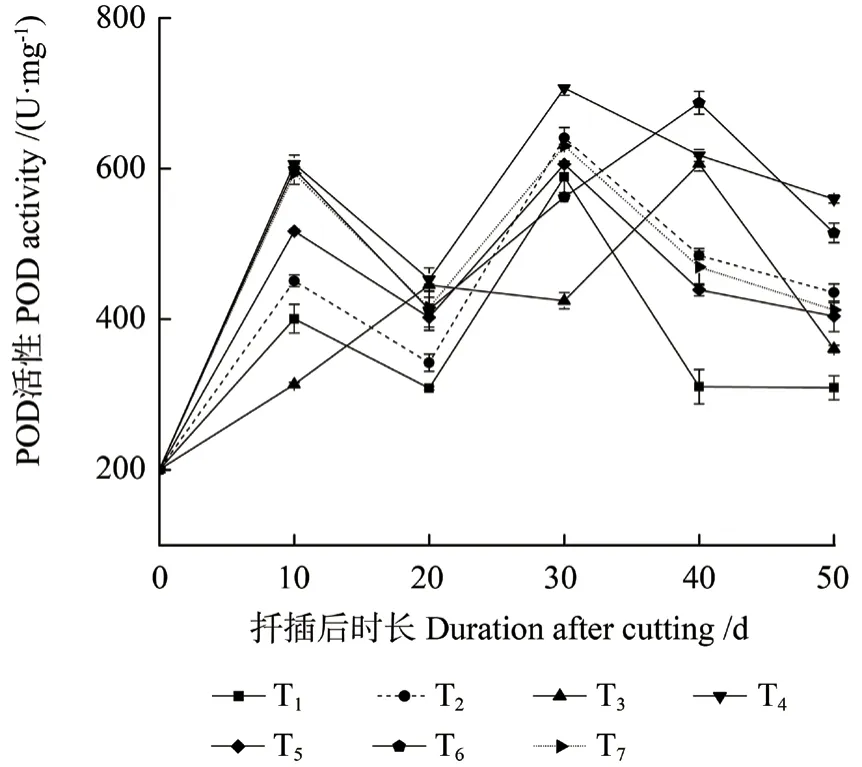
图5 不同激素处理中花椒插穗POD 活性的变化Fig.5 Changes of peroxidase (POD) activity during rooting process of pepper cuttings
2.3.5 PPO 活性的变化
不同激素处理中花椒插穗PPO 活性的变化不同(图6)。T1(CK)处理中插穗PPO 活性表现为先下降、后上升、再下降的变化趋势,各激素处理组中PPO 活性均呈缓慢上升后下降的变化趋势。扦插后10 d 时,即愈伤组织诱导期,此时T1处理中PPO 活性缓慢下降,但差异不显著,激素处理则提高了PPO 活性,其活性为逐渐上升的变化趋势。扦插后20 d 时,不定根开始形成,T1 处理中PPO 活性降低,而激素处理同样促进了PPO活性的提高。生根后期,不同处理中PPO 活性均显著下降。另外,T1 处理中插穗PPO 活性在扦插后30 d 时达到峰值;激素处理组表现不同,其在扦插后20 d 时即达到峰值,较T1 处理提前10 d。
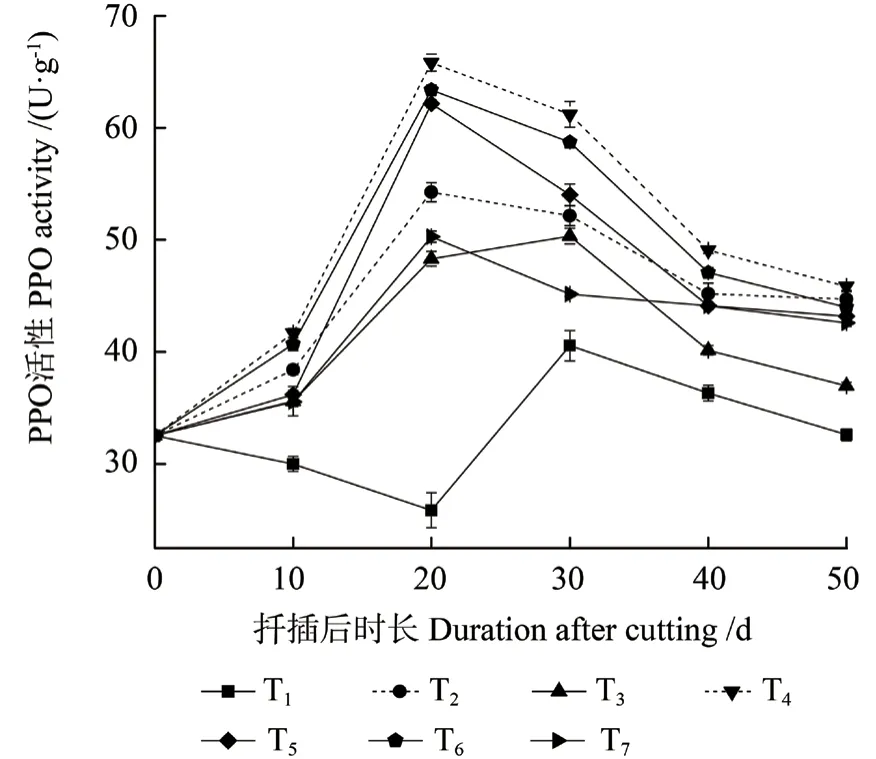
图6 不同激素处理中花椒插穗PPO 活性的变化Fig.6 Changes of polyphenoloxidase (PPO) activity during rooting process of pepper cuttings
2.3.6 IAAO 活性的变化
不同激素处理中花椒插穗IAAO 活性变化趋势基本一致(图7),大致表现为生根前期至中期时其活性有所升高,至生根后期呈现缓慢降低的变化趋势。扦插后0 ~10 d 时,即愈伤组织诱导期,IAAO 活性提高。扦插后10 ~20 d 时,即不定根形成期,T1 处理IAAO 活性略有升高,各激素处理中其活性均剧烈下降。扦插后20 ~30 d 时,为不定根形成后期,各激素处理中IAAO 活性表现为上升的变化趋势,而T1 处理表现相反。扦插后30 ~40 d 时,不定根开始伸长生长,IAAO 活性随之逐渐下降。进入生根后期时,各处理中IAAO活性变化趋于平缓,且不同激素处理间存在一定的差异,这与PPO 和POD 活性变化规律相似。
3 结论与讨论
本研究结果表明:‘狮子头’花椒扦插生根类型以愈伤组织生根型为主,少数为皮部生根类型;在不同的激素种类和质量浓度中,250 mg/L IBA处理花椒插穗后生根效果最好。扦插后,花椒不定根的形成大致分为4 个阶段:扦插后0 ~10 d为花椒愈伤组织诱导期;扦插后10 ~30 d 为不定根形成期;扦插后30 ~40 d 为不定根伸长期;扦插40 d 以后为生根后期。适宜浓度的外源激素可促进生根关键酶活性的提高,促进花椒不定根的发生,且不定根发生与插穗可溶性蛋白含量关系密切。外源IAA 和IBA 处理中,随着激素浓度的增加,插穗成活率先升高、后降低,且在激素质量浓度为250 mg/L 时到达峰值;外源NAA 处理中,500 mg/L 处理的插穗生根效果最好。花椒插穗生根过程中,可溶性蛋白和可溶糖含量表现为先降低、后升高、再降低的单峰型变化规律。在愈伤组织诱导期,呼吸作用增强,代谢旺盛,二者含量迅速下降;在不定根伸长期,随着叶片光合作用增强,光合产物不断积累,二者含量到达最高点;随着幼苗生长消耗,其含量逐渐下降。外源激素的种类及其浓度对花椒扦插生根相关酶活性的提高有显著影响。SOD 活性提高利于不定根的形成;PPO 与IAAO 变化趋势相似,二者均与愈伤组织的形成关系密切;POD 同样对根原基的诱导和不定根的发生起重要作用。
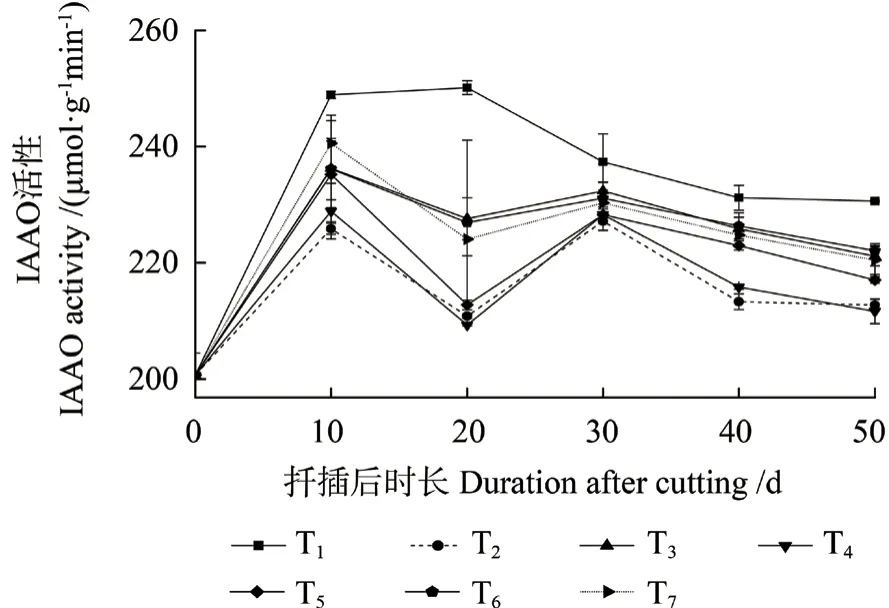
图7 不同激素处理中花椒插穗IAAO 活性的变化Fig.7 Changes of indoleacetic acid oxidase (IAAO) activity during rooting process of pepper cuttings
植物激素具有促进植物细胞分裂和伸长的作用,可以促进插穗不定根的伸长生长,植物生长激素的种类及其浓度与植物生根有密切关系[12]。Yan 等[13]用1 500 mg/L IBA 处理绣球丁香Syringa microphylla后,插穗成活率显著提高;郭其强等[14]经研究发现使用100 mg/L ABT 溶液浸泡插穗3 h,对藏柏Cupressus torulosa和巨柏C.gigantea愈伤组织产生和根系发育有促进作用;外源激素不仅可以提高插穗的成活率,还可以加快根原基的诱导,促进不定根的发生[15]。不同种类的外源激素对植物的作用效果有所差异,且其浓度的不同对不定根发生与生长的作用也有差异。因此,在实际生产中,应严格选择植物外源激素的种类,并控制激素的浓度和处理时间,做到因植物种类而异,因植物的生物学特性而异。在本试验条件下,从综合成活率和生根效果指数来看,选取250 mg/LIBA 浸泡处理‘狮子头’花椒插穗2 h 最为适宜。在相关研究报道中,在速蘸条件下,IAA 与NAA配合使用,‘大红袍’插穗生根效果更佳[6];在50 ~100 mg/L 的IBA 中浸泡12 h,插穗的生根率较高[5-6];600 mg/L GGR 处理日本朝仓花椒插穗,可提高其扦插成活率[16]。因此,各种生长素混合使用,可以提高插穗的成活率,缩短育苗时间和幼苗生根发育进程,促进根系发育。本试验中激素种类和处理时间单一,应对混合激素的种类、浓度和处理时间在花椒扦插繁育中的应用进一步研究。
在插穗愈伤组织发生和不定根生长过程中,营养物质被大量消耗,供应细胞分裂与分化所需养分,维持插穗正常的生命代谢活动[17]。可溶性糖可作为呼吸底物直接被利用,在插穗切口处迅速积累,供给大量不定根形成所需的消耗,是插穗生根过程中的直接能量来源[18]。本研究结果表明,花椒插穗整个生根过程中可溶性糖含量均大于可溶性蛋白含量,与闽楠Phoebe bournei嫩枝扦插与枫杨Pterocarya stenoptera硬枝扦插的研究结论一致[19-20]。这是因为二者在氧化分解、释放能量的同时,保留叶片和插穗新梢叶片可通过呼吸作用加速淀粉水解为可溶性糖,同时将过剩的可溶性糖储存,使得其含量增加。在本研究中还发现,外源激素处理条件下,可溶性糖和可溶性蛋白2 类营养物质的含量在生根过程中呈现“下降—上升—下降”的变化规律,这与欧榛Corylus avellana和蒙椴Tilia mongolica的扦插试验结果相似[21-22]。产生这种变化趋势的主要原因是,在愈伤组织诱导期,呼吸作用增强,代谢旺盛,为防止切口感染,插穗进行自我保护而消耗能量,二者含量迅速下降;在不定根伸长期,随着叶片抽梢生长,光合作用增强,光合产物不断积累,二者含量到达峰值;在不定根形成后期,花椒幼苗进行正常生理活动,消耗糖和蛋白质等营养物质,使得二者含量降低。而清水处理中营养物质含量变化相对较小,峰值出现的时间存在滞后现象,可见,适宜浓度的外源激素处理对花椒不定根发生的促进作用与营养物质的合成和积累密切相关[23]。
生根相关生物酶活性对花椒扦插苗不定根的发生与生长具有直接或间接的作用[24-25]。本研究结果表明,SOD 和PPO 活性在生根进程中均呈现先升高、后降低的趋势,外源激素的添加促进了花椒插穗生根前期诱导酶活性的升高,这与滇杠柳Periploca forrestii和青榨槭Acer davidii的扦插试验结果一致[26-27]。在本研究中,SOD 活性峰值出现在不定根表达时期,PPO 活性峰值出现在不定根形成期,这表明SOD 活性提高有利于不定根的形成与分化,这与东京野茉莉Styrax tonkinensis扦插生根过程中SOD 活性的变化趋势一致[28]。PPO 促进愈伤组织形成,在不定根伸长期,较低活性的PPO可以提高IAA 水平,从而促进不定根发育[29]。
POD 和IAAO 活性同样可以作为评价愈伤组织形成能力和不定根生成能力的指标[30]。本研究结果表明,POD 和IAAO 活性在愈伤组织诱导期均呈上升趋势,之后下降,在不定根形成期又明显升高,于不定根表达期再次下降,二者均呈双峰型变化,分别参与愈伤组织的诱导和不定根的表达,这与朝鲜蓟Cynara scolymus和文冠果Xanthoceras sorrborifolia的扦插试验结果一致[31-32],但与王艳晶等[33]得出的研究结论不同。可见,POD 和IAAO 对插穗产生不定根的影响较为复杂,可能因树种或处理方式的不同而产生不同的作用效果,应进一步研究POD 和IAAO 影响花椒扦插苗根系发生的作用机理。
