CD49a分子研究进展①
2020-09-30田志刚郑晓东
张 彧 田志刚 孙 汭 郑晓东
(中国科学技术大学免疫学研究所,合肥 230027)
1 CD49a概述
1.1CD49a的发现与沿革 1983年Hemler团队发现,经丝裂原或者同种异体抗原刺激,活化的人T细胞表面存在分子量为210 kD与130 kD的糖蛋白复合物,且分子量为210 kD的糖蛋白仅表达于活化的T细胞表面[1]。该团队后续研究发现该T细胞活化相关蛋白复合物的表达时相明显晚于其他T细胞活化标志物,如CD25等,因此称其为晚期活化抗原1(very late antigen-1,VLA-1),以定义T细胞活化的“晚期”阶段[2,3]。VLA为整联蛋白的亚群,VLA-1的α链为整联蛋白α1,于1989年在第四届国际人类白细胞分化抗原大会上将其命名为CD49a。
1994年研究发现CD49a主要与细胞外基质(ECM)上的胶原蛋白Ⅳ结合,并于小鼠T细胞上发现了人VLA-1的同源分子[4,5]。1995年成功研制了CD49a的阻断性单克隆抗体Ha31/8,广泛应用于各种肿瘤及疾病模型研究[6]。同年首次发现CD49a在子宫蜕膜NK细胞上高表达[7]。1996年成功构建CD49a缺陷小鼠,其可正常发育分化,但会导致细胞黏附功能缺陷[8]。2003年成功研发CD49a的小分子选择性抑制剂Obtustatin[9]。2013年作者所在实验室发现小鼠肝脏表达CD49a的NK细胞具有驻留特征,开创了CD49a作为组织驻留淋巴细胞生物标志物的新时代[10]。同年开展了CD49a的单克隆抗体用于关节炎治疗的临床试验,2017年已完成Ⅱ期临床试验。
1.2CD49a的细胞表达谱 CD49a主要表达于神经细胞、间充质细胞、上皮组织细胞及多种肿瘤细胞表面,介导人骨髓间充质干细胞(MSCs)的发育和分化[11-16]。此外,CD49a也表达于NK细胞、T细胞、NKT细胞及巨噬细胞等多种免疫细胞,参与调节固有免疫和适应性免疫应答[17-22]。
1.3CD49a的分子结构 VLA蛋白家族由不同的α亚基与共同的β1亚基非共价结合组成[23]。VLA-1也称α1β1,由210 kD的CD49a和130 kD的CD29 2个亚基组成异源二聚体[24]。CD49a为单次跨膜受体,胞外段共有1 100多个氨基酸残基,包含1个约200个氨基酸的β螺旋结构域Ⅰ,在配体识别过程中发挥重要作用[25]。但CD49a胞内段仅有15个氨基酸残基,其中的GFFKR序列在CD49a信号传导方面起重要作用[26-28]。
1.4CD49a的信号传导 CD49a与配体结合后,激活并介导细胞信号转导,通过胞内段的GFFKR序列招募并磷酸化酪氨酸激酶Fyn,磷酸化Shc,并将Grb2/SOS复合物招募至细胞膜上,从而激活Ras-MEK-ERK激酶途径,导致一系列转录因子激活以增强细胞的抗凋亡能力[8-10,29]。此外CD49a与配体胶原蛋白结合后,也可通过胞内段直接结合并激活T细胞蛋白酪氨酸磷酸酶(TCPTP),TCPTP通过抑制表皮生长因子受体(EGFR)磷酸化,进而抑制细胞增殖,但该途径不会影响Ras-MEK-ERK激酶信号通路[30]。
1.5CD49a的家族分子与配体 在哺乳动物中,整联蛋白由18种α亚基与8种β亚基非共价结合形成24种不同功能的异源二聚体[31]。VLA蛋白家族由不同的α亚基(α1-α6)和共用β1亚基非共价结合所组成,介导细胞对细胞外基质组分如纤连蛋白、胶原蛋白、层粘连蛋白的黏附[23,32]。CD49a主要配体为细胞外基质(ECM)上的胶原蛋白Ⅳ,亲和力远大于胶原蛋白Ⅰ,也可以与胶原蛋白Ⅸ、胶原蛋白ⅩⅢ、胶原蛋白ⅩⅥ及CD108(Semaphorin7A)结合从而传递胞内信号[5,33-36]。
1.6CD49a的基本功能 CD49a作为T细胞晚期活化抗原,表征T细胞的活化时相,在炎症反应及调节生长分化方面具有重要作用,且可介导固有免疫和适应性免疫应答[10,21,22,37-39]。CD49a作为整联蛋白,除起黏附作用外,也是组织驻留淋巴细胞的生物标志物。
2 CD49a的黏附功能与组织驻留的生物标志物
CD49a是黏附分子中整联蛋白家族成员,与胶原蛋白结合后可使细胞黏附于细胞外基质,对细胞附着于组织局部起关键作用[40,41]。近年研究发现CD49a在多种组织驻留淋巴细胞上表达,为其重要的表面标志物。
2.1CD49a的黏附功能
2.1.1淋巴细胞的黏附 作为黏附分子,CD49a表达于多种活化的淋巴细胞。淋巴细胞可通过 CD49a与细胞外基质中的胶原蛋白Ⅳ结合而黏附于组织局部,发挥抗感染、抗肿瘤作用[42]。采用抗体阻断或敲除CD49a,可抑制此黏附作用,显著降低组织局部的淋巴细胞数目,从而抑制其抗感染、抗肿瘤作用。研究发现多种组织驻留淋巴细胞高表达CD49a,对其维持组织驻留特性至关重要,因而CD49a被认为是组织驻留淋巴细胞的标志性分子之一[10]。关节炎、炎性结肠病等自身免疫病中,病理性淋巴细胞通过CD49a黏附于关节滑膜或肠道黏膜引起免疫损伤。靶向阻断CD49a,可降低炎症部位的病理性淋巴细胞数量,延缓自身免疫病进程[42,43]。因此,靶向CD49a的治疗策略为自身免疫病的治疗提供新的思路。
2.1.2单核巨噬细胞的黏附 单核细胞和巨噬细胞上CD49a分子在静息状态下并不表达,但经刺激活化后开始表达。巨噬细胞上CD49a与胶原蛋白Ⅳ结合可抑制巨噬细胞游走,对巨噬细胞在炎症部位的黏附具有重要作用,当使用CD49a阻断抗体或CD49a缺陷小鼠体内可明显增加炎症部位巨噬细胞的迁出[44]。
2.2CD49a作为组织驻留淋巴细胞的重要标志 淋巴细胞通常被认为在全身各器官及血液中不断循环,当组织局部发生炎症或损伤时,淋巴细胞迁移至病变部位发挥功能。近年研究发现,在多种非淋巴组织中存在特殊表型及功能的淋巴细胞,被称为组织驻留淋巴细胞,主要包括ILC、iNKT、γδT、MAIT、Trm等细胞,在转录因子、表型及功能等方面与循环淋巴细胞存在较大差异,从而可有效区分二者。这些淋巴细胞长期驻留于组织局部而几乎不进入外周循环,在受到病原体入侵时,组织驻留淋巴细胞可迅速反应发挥免疫防御作用。
2.2.1天然免疫细胞 2013年作者所在实验室首先界定了一群肝脏驻留NK(liver resident NK,LrNK)细胞,命名为肝脏ILC1。通过其独特表型CD49a+NK1.1+CD49b-与经典NK细胞(conventi-onal NK,cNK,CD49a-NK1.1+CD49b+)进行区分,LrNK细胞驻留于肝脏组织,不随血液循环进入外周循环,脱颗粒及分泌IFN-γ的能力较弱[10]。众多研究者在子宫、唾液腺、脂肪、肾脏等器官或组织中均发现了CD49a+NK细胞,因而CD49a被认为是组织驻留NK细胞的标志性分子[45]。
ILC是重要的组织驻留淋巴细胞,存在于肠道、肺脏和脂肪等组织,对入侵病原体迅速反应,维持机体稳态[46]。根据转录因子表达、细胞因子分泌及表面标志等指标可将ILC分为3个类型,即ILC1,ILC2和ILC3。几乎所有的ILC1均表达CD49a,因而CD49a是区分ILC1与cNK细胞的重要表面标志之一[10]。文献报道肠道NKp46+CCR6-和NKp46-CCR6-ILC3细胞均表达CD49a,而NKp46-CCR6+细胞则不表达CD49a,因而CD49a表达下降可能标志ILC3细胞由不成熟发展为成熟[47]。
2.2.2其他天然免疫淋巴细胞 iNKT细胞表达恒定TCRα链,识别由CD1d递呈的脂质抗原。通常情况下iNKT细胞为非循环组织驻留细胞,优先驻留于肝脏、脂肪、肺脏、肠道等外周淋巴器官,并表达CD49a、CD69等组织驻留相关标志物[48,49]。
γδT细胞于发育早期便向组织迁移,最终驻留于皮肤、呼吸道和小肠黏膜等黏膜组织中,对感染和肿瘤起免疫监视作用[50-52]。组织驻留γδT细胞表达多种驻留相关分子如CD69、CD103和CD44等,静息的γδT细胞不表达CD49a,但活化后高表达CD49a[5,53]。
MAIT细胞是非经典天然免疫T细胞,通过MR1(MHC-Ib-related protein 1)识别微生物抗原,高表达CD49a、CD69、CD103等组织驻留标志物,并倾向于驻留在肠道固有层[48,54]。
2.2.3获得性免疫淋巴细胞 组织驻留记忆T(tissue-resident memory T,Trm)细胞是位于各组织的T细胞谱系,驻留于多种非淋巴组织(如肠道、脑、皮肤和肺脏),保护外周组织[55-59]。Trm细胞在其驻留的组织中占据独特位置,并呈现出树突状形态与循环的记忆T细胞区分[60]。研究表明,可通过CD49a表达差异区分Trm细胞亚群,如皮肤的CD49a+CD8+Trm能够分泌大量IFN-γ及细胞毒颗粒,而不表达CD49a的CD8+Trm主要产生IL-17[57]。CD49a+CD4+Trm也具有类似的现象[61]。因此,表达 CD49a的Trm细胞功能更强[18,62-64]。
2.2.4CD49a作为组织驻留淋巴细胞生物标志的意义 不同的组织驻留淋巴细胞其表型各不相同,但大部分均特征性表达CD49a、CD103、CD69及CD44等分子(表1)。通过特征性分子和趋化因子受体的组合可定义组织驻留淋巴细胞的表型,并与外周循环淋巴细胞加以区分,如作者所在实验室发现LrNK细胞表达CD49a、CXCR6等分子,并可与外周NK细胞区分[10]。
CD69是Ⅱ型跨膜糖蛋白,属于C-型凝集素受体家族[65],通常被认为是淋巴细胞活化的早期标志物。CD69在外周静息淋巴细胞表面表达(约1%~7%),但受外界刺激后表达水平迅速提高(约30%~90%)[66-68]。此外,CD69在胸腺细胞上也有较高表达(42%)[69]。CD103是整联蛋白αEβ7的α链,作为E-钙黏着蛋白受体介导细胞黏附,在外周淋巴细胞表面也有一定表达(约3%~4%)[67,70,71]。CD44是单次跨膜糖蛋白,为透明质酸受体,调节细胞-细胞和细胞-基质的黏附,表达谱较广,在多种组织驻留淋巴细胞和外周循环淋巴细胞上均有表达,在外周静息淋巴细胞上表达超过97%[72-74]。而CD49a在外周静息淋巴细胞上几乎不表达(<2%),只在ILC1、Trm等多种组织驻留淋巴细胞有较高表达[10,71]。因此与其他组织驻留标志性分子相比,CD49a表达更为特异,更容易区分组织驻留与外周循环淋巴细胞。
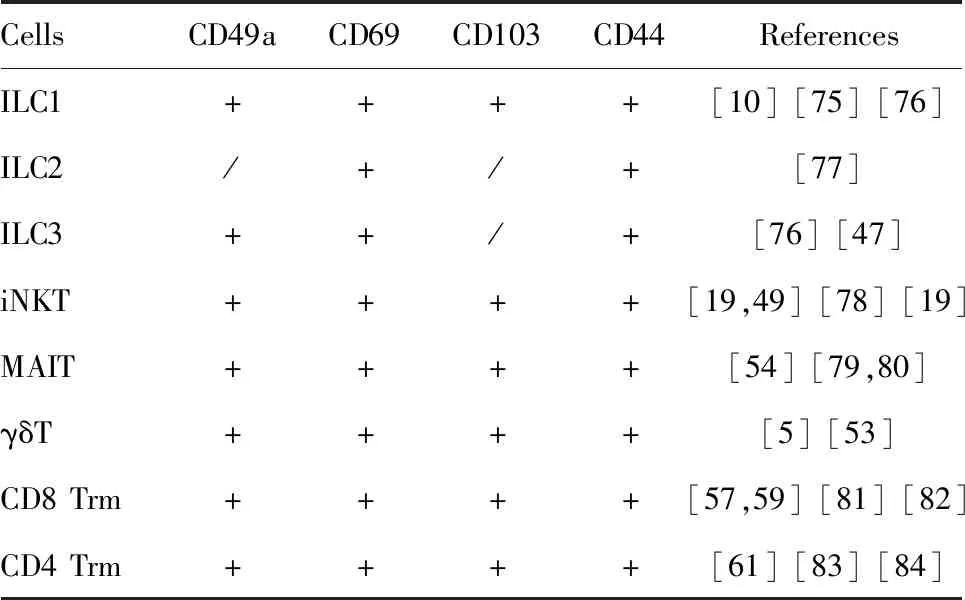
表1 标志分子在不同组织驻留淋巴细胞的表达
3 CD49a的免疫学功能
CD49a不仅介导淋巴细胞黏附及组织驻留,还可调节免疫学应答。在不同类型或同一类型不同状态的免疫细胞上,CD49a对免疫系统的调节作用存在差异,有些细胞表现为更为活化的状态,而另一些则处于更为抑制的状态,但大部分研究认为CD49a表达的细胞处于更加活化的状态。
3.1CD49a促进免疫系统活化 研究表明CD49a可活化T细胞、巨噬细胞及iNKT细胞,促进其分泌细胞因子,增强其抗凋亡及抗病毒能力等。
3.1.1T细胞 CD49a可促进 CD8+T细胞介导抗病毒及抗肿瘤免疫。静息状态的外周T细胞上几乎不表达CD49a,而在流感病毒感染期间大多数外周CD8+T细胞开始表达CD49a,特别是在流感病毒特异性CD8+T细胞上高表达CD49a。随着感染的消退,表达CD49a的抗原特异性CD8+T细胞具有更强的抗凋亡能力。二次感染中,大部分抗原特异性CD8+T细胞均表达CD49a,且CD49a对抗原特异性CD8+T细胞于肺部及其他非淋巴组织中的聚集发挥关键作用,用抗体阻断CD49a可使肺部抗原特异性CD8+T的细胞数量显著减少,从而减弱机体对病毒再次感染的清除能力[18]。此外,荷瘤小鼠接种肿瘤疫苗后,小鼠抗原特异性CD8+T细胞高表达CD49a,并归巢于肿瘤部位呈现出更为活化的表型。使用抗体阻断CD49a后,肿瘤生长加速,小鼠生存期明显缩短[62-64]。
感染流感病毒后,CD4+T细胞开始表达CD49a,病毒清除后,气道中CD49a+CD4+T细胞比例明显升高。二次感染中,气道中CD49a+CD4+T可分泌IFN-γ抵抗感染,提高细胞抗凋亡能力。
研究发现利用抗CD49a抗体可交联γδT细胞表面的VLA-1,导致γδT细胞活化,促进IL-2受体表达[5]。作为T细胞活化晚期阶段的标志,CD49a通常在T细胞活化的2~3周后表达[2]。无论是CD8+T、CD4+T还是γδT细胞,CD49a+细胞都具有更强的抗凋亡及清除病原体能力,提示这些细胞处于更为活化的状态。
3.1.2巨噬细胞 肝脏内CD49a+巨噬细胞成熟和活化标志(如CD69、CD80、CD83、CD86等)的表达水平较CD49a-巨噬细胞更高,且TNF-α和IL-12的分泌能力更强,表现出M1型巨噬细胞表型,提示表达CD49a的巨噬细胞处于更为活化的状态[22]。此外,巨噬细胞上CD49a与CD108的结合能够激活巨噬细胞,增强其分泌IL-6、TNF-α等炎症细胞因子的能力,加重自身免疫病,因而CD49a-CD108的识别作用可能成为某些自身免疫病的治疗靶点[20,85]。
3.1.3iNKT细胞 iNKT细胞存在于多个组织,并具有组织驻留特性[49]。肝脏iNKT细胞高表达CD49a,而CD49a对NKT细胞介导炎症发生尤其是分泌炎症因子具有重要作用。ConA诱导的急性肝损伤中,CD49a+iNKT细胞分泌IFN-γ和IL-17A等炎症因子的能力增强,介导肝脏炎症及肝细胞坏死。敲除或阻断CD49a可抑制iNKT细胞分泌IFN-γ和IL-17A,缓解肝脏损伤,因此,靶向CD49a可能是治疗急性肝衰竭的新策略[19]。
3.2CD49a的免疫抑制功能 CD49a具有免疫抑制作用。在结核杆菌感染模型的CD8+T细胞及子宫蜕膜NK细胞中,CD49a表达往往伴随细胞因子分泌降低和细胞毒性减弱,使免疫细胞处于抑制状态。
3.2.1T细胞 抗原特异性CD8+T细胞在免疫应答的效应、扩增、衰退和记忆阶段均持续高表达CD49a,CD49a负调控免疫应答衰退期抗原特异性CD8+T细胞的功能。结核杆菌感染中,CD49a既不介导抗原特异性CD8+T细胞迁移至肺部,也不参与记忆性T细胞维持,但在免疫应答的衰退阶段,阻断CD49a可促进抗原特异性CD8+T细胞分泌IFN-γ 并增强脱颗粒能力[86]。初次免疫衰退期和二次感染初期,CD49a反向调节抗原特异性CD8+T作用,可能由于T细胞所处时相不同,但具体机制尚需进一步研究[18]。
3.2.2蜕膜NK细胞 早期蜕膜组织中NK细胞占淋巴细胞总数的70%以上,超过85%的NK细胞表达CD49a。与外周血NK细胞相比,蜕膜NK细胞表达更高水平的CD49a并伴随细胞毒性减弱[87-89]。利用抗体阻断CD49a后,蜕膜NK细胞迁移和黏附能力下降而细胞杀伤能力明显上升。此外,复发性自然流产患者的蜕膜NK细胞CD49a表达水平较低,但穿孔素、颗粒酶B及IFN-γ表达显著提高[39]。因此CD49a可使蜕膜NK细胞处于免疫抑制状态,维持正常妊娠的免疫耐受状态。
3.2.3ILC1 Peng等[10]研究发现,与经典NK细胞(CD49a-CD49b+)相比,小鼠肝脏CD49a+NK(即ILC1)细胞脱颗粒及分泌IFN-γ的能力较弱。LCMV病毒感染时,ILC1可通过高表达PD-L1抑制T细胞的抗病毒功能,发挥免疫负调作用[90]。与此类似,在TGF-β作用下,肿瘤浸润的NK细胞(NKp46+CD49a-CD49b+)表面CD49a表达逐渐提高,最终转化为ILC1(NKp46+CD49a+CD49b-),而肿瘤组织浸润的ILC1无法有效抑制肿瘤生长。随肿瘤体积增大,肿瘤浸润NK细胞比例逐渐降低,而ILC1比例提升并与肿瘤不良预后呈正相关[91]。ILC1高表达CTLA-4、CD96和LAG-3等免疫抑制分子,呈现出“耗竭”的表型,且ILC1 IFN-γ能力分泌下降、细胞毒活性降低、血管内皮生长因子(VEGF)分泌增加,对IL-2治疗几乎无响应[17,92]。因此,ILC1负调控机体的抗肿瘤免疫应答,促进肿瘤发生发展。
4 CD49a的其他生物学作用
CD49a除表达于免疫细胞外,在血管内皮及肿瘤细胞上亦有表达。肿瘤细胞CD49a表达可增强肿瘤细胞的耐药性、抗凋亡及坏死能力[93]。血管内皮细胞表达CD49a可促进肿瘤周围血管生成,导致肿瘤生长及转移。
4.1促进肿瘤血管生成 研究发现CD49a与肿瘤组织微血管生成密切相关,VEGF是血管生成必需的细胞因子,肿瘤需在VEGF作用下生成大量新血管,最大限度获取营养物质以满足其生长需求[94,95]。VEGF可诱导血管内皮细胞表达CD49a,CD49a增强VEGF对血管内皮细胞的活化作用,促进血管生成。使用抗体阻断CD49a可降低VEGF对血管内皮细胞的活化作用,抑制肿瘤周围血管生成[96]。此外,CD49a还可通过抑制基质金属蛋白酶(matrix metalloproteinase,MMP)合成促进肿瘤血管生成。Cd49a-/-小鼠的血管内皮细胞中MMP7和MMP9显著增加,通过降解纤溶酶原产生血管生成抑制素,抑制血管内皮细胞增殖。对Cd49a-/-小鼠进行荷瘤发现,肿瘤组织的血管数量和管径均明显降低,肿瘤体积明显减小,血浆MMP9浓度与肿瘤生长呈负相关[97]。
4.2促进肿瘤细胞原位生长及转移
4.2.1原位生长 CD49a在黑素瘤、胃癌细胞、结直肠癌、胰腺癌等肿瘤细胞高表达,对肿瘤细胞存活和增殖起重要作用[15,98]。使用抗体阻断或敲低CD49a,肿瘤细胞凋亡和坏死显著增加,肿瘤周围血管生成减少,肿瘤生长被抑制,表明CD49a对肿瘤的发生发展具有重要作用。
4.2.2肿瘤转移 肿瘤细胞附着于富含胶原纤维的微环境是肿瘤细胞转移的前提。肿瘤细胞表面CD49a与细胞外层黏连蛋白、胶原蛋白等结合可介导肿瘤侵袭。研究发现CD49a可上调肿瘤细胞MMP3表达,而MMP3是多种肿瘤侵袭的必需物质,阻断CD49a可显著抑制肿瘤侵袭及转移[15,98-100]。因此,CD49a与肿瘤细胞的增殖、存活和转移密切相关,是肿瘤患者预后不良的指标之一[101-103]。
5 展望
CD49a分子首次被鉴定于活化的T细胞,随后发现其可表达于免疫细胞、内皮细胞及肿瘤细胞等多种细胞表面[2,10,14,15,18,22,97]。CD49a分子主要与胶原蛋白结合发挥黏附分子作用,对淋巴细胞及单核巨噬细胞在组织的黏附具有重要作用。CD49a作为免疫细胞组织驻留的生物标志物,在NK细胞、ILC、iNKT细胞、γδT细胞和Trm细胞均有表达,对免疫细胞发挥正调或负调作用。CD49a表达使巨噬细胞及二次免疫的组织驻留记忆T细胞更为活化,增强机体抵御病原体入侵的能力。免疫应答衰退期,CD49a表达可降低T细胞分泌细胞因子及脱颗粒能力,使细胞处于抑制状态。CD49a+NK细胞高表达抑制性分子,但杀伤和分泌细胞因子能力较弱。此外,CD49a在肿瘤细胞及血管内皮细胞表达,可促进肿瘤细胞增殖及转移,加速肿瘤发生发展。
根据CD49a在细胞黏附及组织驻留方面的特性而申请其治疗自身免疫性疾病的临床试验正在开展,治疗类风湿关节炎的Ⅱ期临床试验已结束。不同疾病中,CD49a对不同病原体及免疫应答不同阶段所发挥的免疫调节作用具有一定差异,具体机制仍需进一步研究。CD49a可通过多种机制促进肿瘤发生发展,为肿瘤检查点的生物治疗提供新靶点。综上所述,针对CD49a或其配体的阻断抗体的临床研究,联合放化疗或其他免疫治疗的治疗方案的深入探讨,都可能成为肿瘤或自身免疫病治疗的新方向。
