北京地区GPC3参考区间的建立及验证
2020-09-29董美衬刘向祎
董美衬,刘向祎
(1.首都医科大学附属北京同仁医院检验科,北京 100730;2.中国中医科学院西苑医院检验科,北京 100091)
磷脂酰肌醇蛋白聚糖3(GPC3)是一种细胞表面硫酸乙酰肝素蛋白多糖,属于与甘氨酸相关的整体膜蛋白多糖亲缘蛋白。GPC3通常在胎儿肝脏和胎盘中表达,在健康成人肝脏中不表达,但在肝癌患者的肝脏中呈高度表达。GPC3对诊断肝癌有着较高的灵敏度和特异度,同时在监测肝癌预后和复发中也有重要价值[1-2]。参考区间是临床判断受检者健康与否的依据,其准确性、适用性直接影响着疾病的诊疗效率。参考区间的不确定会导致错误的医学判断和干预,导致漏诊患者错过最佳治疗时机,导致误诊患者承担不应有的心理和经济负担。目前,我国肿瘤标志物的检测系统和检测方法不统一,研究表明,约83.1%的实验室指标参考区间来自检测系统说明书,且各检测系统的参考区间之间存在明显差异[3]。因此,各实验室应建立适合于该地区人群的参考区间,以提高诊断的准确性。本研究建立了适用于北京地区健康人群的GPC3参考区间,现将结果报道如下。
1 资料与方法
1.1一般资料 选取2018年11月至2019年1月于中国中医科学院西苑医院体检中心健康体检者198例为研究对象,其中男112例,女86例。纳入标准:根据《临床实验室检验项目参考区间的制定:WS/T 402-2012》[4]标准剔除离群值;血常规、尿常规、肝肾功能、血糖、血脂均正常,腹部B超、胸部CT无异常,既往无肝、胆、胃、肠、胰腺疾病及慢性疾病史,无家族遗传疾病史。所有研究对象中19~<30岁者65例,其中男50例,女15例;30~<40岁者55例,其中男30例,女25例;40~<50岁者27例,其中男11例,女16例;50~<60岁者29例,其中男14例,女15例;≥60岁者22例,其中男7例,女15例。另收集2019年1月于中国中医科学院西苑医院体检中心健康体检者20例对建立的参考区间进行验证。
1.2仪器与试剂 仪器包括大龙兴创实验仪器有限公司生产的Top Pette移液器,海门市其林贝尔仪器制造有限公司生产的Mini Shaker MH-1微孔板振荡器,北京拓普分析仪器有限责任公司生产的DEM-3型自动酶标洗板机和奥地利Tecan公司生产的Tecan sunrise酶标仪。试剂包括康乃格诊断产品(北京)有限公司生产的GPC3试剂、配套校准品和质控品,试剂盒批号为41651U。
1.3方法
1.3.1标本采集 所有研究对象禁食8 h后于清晨采集5 mL静脉血,置于分离胶促凝采血管中,离心分离血清,于-80 ℃冰箱保存待测。
1.3.2标本检测 将冷冻血清标本恢复至室温,待完全溶化后充分混匀备用。用清洗缓冲液清洗微孔板1次,将100 μL GPC3校准品、GPC3质控品及待测标本加至微孔中;然后向各个微孔中加入50 μL生物素抗GPC3溶液,振荡2 h,清洗3次;向各个微孔中加入100 μL示踪剂,振荡1 h,清洗6次;向每个微孔中加入100 μL TMB HRP底物,振荡30 min,再向各个微孔中加入100 μL终止液;加入终止液15 min内,使用微孔板分光光度计读取450 nm处的吸光度值,使用曲线拟合法计算检测结果。
1.4统计学处理 采用SPSS20.0软件对数据进行分析。采用Kolmogorov-Smirnov检验进行正态性验证;不符合正态分布的计量资料以M(P25,P75)表示,两组间比较采用Mann-WhitneyU检验,多组间比较采用Kruskal-WallisH检验;以P5作为参考区间下限,以P95作为参考区间上限。以P<0.05为差异有统计学意义。
2 结 果
2.1不同性别及年龄人群GPC3水平及参考区间 纳入人群GPC3水平呈偏态分布(P<0.05);人群总体GPC3水平为[0.006(0.000,0.015)]ng/mL,参考区间为0.000~0.036 ng/mL;男女GPC3水平比较,差异无统计学意义(Z=-1.618,P=0.106);男性GPC3参考区间为0.000~0.028 ng/mL,女性GPC3参考区间为0.000~0.040 ng/mL,见表1。GPC3水平随年龄增长有下降趋势,但不同年龄段人群GPC3水平比较,差异均无统计学意义(H=4.144,P=0.387);不同年龄段人群GPC3水平及参考区间见表2。

表1 不同性别人群GPC3水平及参考区间
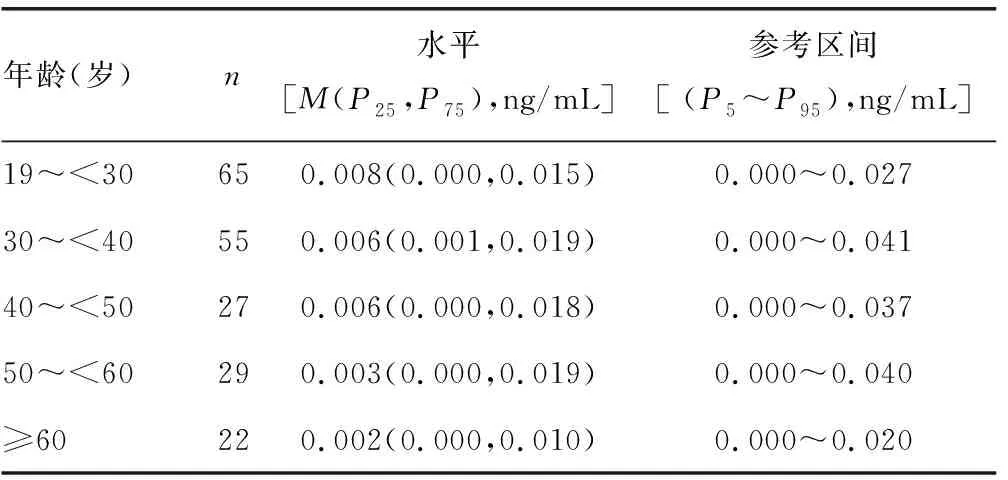
表2 不同年龄人群GPC3水平及参考区间
2.2参考区间验证 按照《临床实验室检验项目参考区间的制定:WS/T 402-2012》[4]中的相关要求,对所建立的GPC3参考区间进行验证,结果显示,另收集的健康体检者20例GPC3水平均处于所建立的参考区间范围内。
3 讨 论
肿瘤标志物在临床应用中具有重要意义,规范肿瘤标志物在肿瘤临床诊疗中的科学使用,是临床与检验共同关心的问题[5]。GPC3作为早期诊断肝癌的理想标志物,能够弥补现有肝癌肿瘤标志物甲胎蛋白、甲胎蛋白异质体3等灵敏度和特异度不高的缺点,联合检测更能提高对肝癌的诊断效能[6]。1项关于GPC3的Meta分析发现,GPC3诊断肝癌的特异度很高,灵敏度中等,诊断效能较好[7-8]。
目前,GPC3还没有明确的标准化临界值,所以建立合适的参考区间,寻找合理的临界值,是亟待解决的问题。建立参考区间时所纳入的健康人群不可能是绝对健康的,且目前还没有相关标准明确规定一定要纳入完全健康的个体,故只要不存在相关疾病和干扰研究项目的因素,即可纳入作为研究对象,同时可通过离群值的剔除来提高参考区间准确性[9]。本研究对北京地区198例健康体检者血清GPC3水平进行检测,得出参考区间为0.000~0.036 ng/mL,与厂家提供的数据一致,但与费乐学等[10]、田江川[11]所建立的参考区间有明显差异,考虑与以下因素相关:各研究所用的检测试剂不同,费乐学等[10]的研究中,采用的是上海通蔚试剂公司生产的GPC3检测试剂盒,田江川[11]的研究中所用试剂由武汉优尔生科技股份有限公司提供,而本研究使用的是康乃格诊断产品(北京)有限公司生产的GPC3试剂、配套校准品和质控品。此外,检测仪器及研究对象的纳入及排除标准也会影响参考区间的结果。其他部分研究对健康人群与疾病患者的GPC3水平进行了相关比较,虽未明确标明参考区间,但从健康人群的GPC3数据来看,各研究有很大区别[12-15],这些差异的产生可能与研究对象的纳入差异、检测试剂、方法、仪器、实验环境,以及选择样本量的不同等诸多因素有关,因此,实验室建立符合要求的参考区间是十分必要的。
本研究中,女性GPC3水平略高于男性,且随着年龄的增长GPC3水平有下降趋势,虽然差异均无统计学意义(P>0.05),但针对该结果可进一步扩大样本量去证实不同性别、年龄的健康人群是否存在GPC3的水平差异。本研究参考区间验证结果符合行业标准,能满足实验室检测需求,可提高临床诊断准确性。
